一种用于筛选丙烯酰胺抑制剂的模型的建立
2012-12-05黄滟波
黄滟波,魏 东
(1.华南理工大学制浆造纸工程国家重点实验室,广东广州510640;2.华南理工大学轻工与食品学院,广东广州510640)
丙烯酰胺是一种常用的化工原料,广泛用于生产聚丙烯酰胺。动物实验表明,丙烯酰胺具有神经毒性、生殖毒性,可以引起动物的致畸、致癌[1]。1994年,国际癌症研究机构已将其归为人类潜在的致癌物[2]。2002年4月,瑞典国家食品管理局首次从某些高温加工食品中检出高含量的丙烯酰胺,如油炸薯条、薯片、炸鸡翅、面包等,其最高含量达到12800μg/kg[3]。这一结果引起了国际社会广泛重视,各国纷纷针对食品加工过程中丙烯酰胺的形成机理及抑制方法展开大量的研究。丙烯酰胺形成于食品的高温加热过程中,而食品基质非常复杂,影响因素众多,这些就为对丙烯酰胺进行深入研究带来了一定的困难。目前一般认为,丙烯酰胺是天冬酰胺和还原糖在高温加热(大于120℃)条件下,由美拉德反应生成[4],研究中常采用化学模型模拟丙烯酰胺的形成过程。利用化学模型进行研究可以忽略丙烯酰胺形成过程中的次要因素,抓住天冬酰胺和还原糖这一对影响丙烯酰胺形成的主要因素,对于简化研究过程,减少因复杂基质影响而形成的误差有重要的帮助[5]。同时,由于食品加工过程复杂,影响因素众多,因此,还需要建立真实食品模型对化学模型进行验证,以提高筛选过程的准确性。本文旨在建立模拟丙烯酰胺形成过程的化学模型,并对其进行优化以作为丙烯酰胺抑制剂的筛选平台。同时建立形成丙烯酰胺的食品模型,用于化学模型的验证参考。
1 材料与方法
1.1 材料与仪器
丙烯酰胺 99%,Sigma-Aldrich;无水葡萄糖、天冬酰胺、无水硫酸锌、亚铁氰化钾、溴化钾、溴酸钾、硫代硫酸钠、氯化钙 均为分析纯;土豆 购于广州市场;金龙鱼大豆油 南海油脂工业(赤湾)有限公司。
6890-5975 气相色谱-质谱联用仪 Agilent Technologies;DB-FFAP毛细管气相色谱柱 Agilent Technologies;U-3900紫外分光光度计 Hitachi;恒温油浴锅 江苏省金坛市宏华仪器厂;不锈钢密封管、试管架 自制。
1.2 实验方法
1.2.1 化学模型的建立 自制长约100mm、内径约10mm的不锈钢螺口密封管,耐200℃高温的密封垫及螺口试管盖,确保试管在装有液体高温加热时密闭性良好。将试管架放入油浴锅中,加热,使其升温至170℃并保持稳定。在不锈钢密封管中分别加入一定量的葡萄糖、天冬酰胺及去离子水,混匀后加上垫圈及试管盖,密闭。将装有反应物的密封管放入试管架并迅速置于油浴锅中,开始计时。5min后,迅速取出密封管,置入冰水中冷却。待其冷却后,取出反应液稀释至40mL。取其中20mL溴化衍生检测其丙烯酰胺含量,再取余下液体稀释2倍后检测其在420nm处吸光值。
1.2.2 食品模型的建立 油浴锅中加入约1L市售大豆油,加热到一定温度(150℃或170℃)并保持稳定。选取市售新鲜土豆,清洗、去皮,切为约2mm厚、40mm直径的薄片,置入蒸馏水中浸泡3min,取出,用滤纸吸去表面多余水分,加入热油中炸一定时间,取出,用滤纸吸取表面多余油脂,粉碎,溴化衍生检测其丙烯酰胺含量,并将水提液稀释20倍后检测其在420nm处的吸光值。
1.2.3 丙烯酰胺的检测
1.2.3.1 溴化衍生 取20mL反应液加入CarrezⅠ、CarrezⅡ试剂各0.5mL。振荡2min后于4℃、14000r/min离心15min,取10mL离心上清液,加入2g溴化钾、2mL 0.1mol/L溴酸钾溶液、1.2mL硫酸(10%,V/V)进行溴化衍生,4℃避光静置1h后,再加入 1mL 0.2mol/L硫代硫酸钠溶液终止溴化反应。溴化后溶液约11mL用10mL乙酸乙酯萃取,重复三次,取乙酸乙酯层,于45℃、90kPa减压旋转蒸发至1mL。加入0.1mL三乙胺,进行气质联用仪分析。
1.2.3.2 GC-MS分析 毛细管色谱柱:DB-FFAP(30m ×0.25mm ×0.25μm);进样量:1μL;载气:氦气;载气流速:1mL/min;升温程序:60℃保持2min,然后以10℃/min的速度升温到200℃,保持5min。
电离方式:EI源;离子源温度:230℃;四级杆温度:150℃;扫描方式:选择离子扫描(SIM)模式,检测离子为 m/z=106、133、151;质量扫描范围:33~550。
1.2.4 抑制剂的筛选 以在化学模型中加入3mL去离子水为空白,加入3mL 0.5%的氯化钙溶液为阳性对照,按前所述方法加热,并检测其丙烯酰胺含量。
以将土豆片在蒸馏水中浸泡3min作为空白,将土豆片在0.5%氯化钙溶液浸泡3min作为阳性对照,按前述方法油炸并分别检测其丙烯酰胺含量。
化学模型及食品模型中,添加剂对丙烯酰胺的抑制率按以下方法计算:
抑制率(%)=(D-E)/D×100
式中,D:模型中丙烯酰胺的产生量(mg/L或mg/kg);E:添加抑制剂后模型中丙烯酰胺的产生量(mg/L或mg/kg)。
抑制率为正值时,表示有抑制作用;抑制率为负值时,表示有促进作用。
2 结果与分析
2.1 化学模型含水量的选择
文献[6-7]在研究影响丙烯酰胺形成各因素时,采用了无水天冬酰胺/还原糖模型,将等摩尔比的天冬酰胺/还原糖粉末仔细混匀后进行加热。反应后产物采用UPLC-MS/MS或GC-MS检测,检测结果较稳定。因此,在化学模型建立过程中,本研究先尝试建立无水模型体系。结果发现,在170℃高温加热之后,无水葡萄糖与天冬酰胺的产物结块膨胀,在将其转移出不锈钢密封管溶于去离子水的过程中损失较大。葡萄糖、天冬酰胺粉末在混合过程中,混匀程度不易掌握,而且与溶液相比固体传热较慢,因此在加热过程中葡萄糖、天冬酰胺粉末在试管内受热不均匀,反应结果重复性较差,从肉眼便可观察到各平行样中反应程度差别较大。因此,在之后的研究中未采用无水模型体系。
2.2 化学模型中葡萄糖与天冬酰胺的添加量的选择
化学模型中初始反应物的浓度及比例、加热温度、加热时间等因素都会影响化学模型中丙烯酰胺的形成[8]。其中还原糖与天冬酰胺的摩尔比这一因素对化学模型中丙烯酰胺的形成有较大影响[6]。文献[9]表明按照三种不同的葡萄糖/天冬酰胺摩尔比例(1∶3,1∶1 和 3∶1)制备化学模型反应物,当葡萄糖/天冬酰胺摩尔比例在1∶1~2∶1时,丙烯酰胺产生量较高。鉴于许多研究采用的化学模型中葡萄糖与天冬酰胺的摩尔比为1∶1[10],本章未再深入探讨葡萄糖/天冬酰胺摩尔比例对丙烯酰胺产生量的影响,而是在确定葡萄糖/天冬酰胺摩尔比为1∶1的条件下,探讨三种不同的葡萄糖/天冬酰胺添加量在模型中产生丙烯酰胺的情况,结果如表1所示。
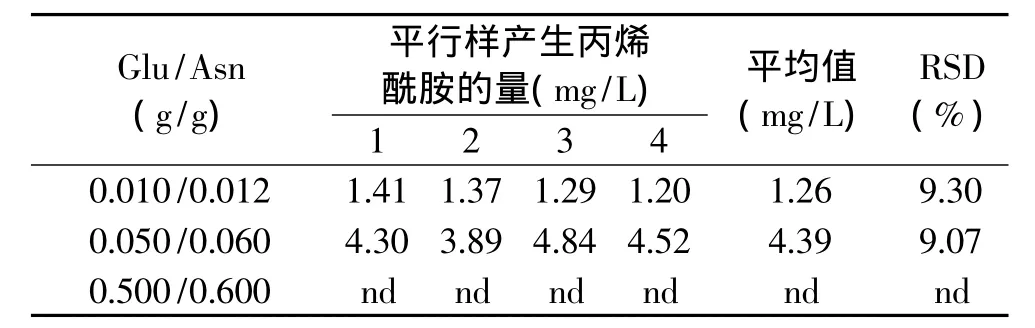
表1 三种Glu/Asn添加量在模型中产生丙烯酰胺的情况Table 1 Yield of acrylamide in three Glu/Asn contents in model system
当模型中Glu/Asn的添加量为0.500g/0.600g时,产物进行 GC-MS检测,发现总离子流图在15.291min时并未有峰。将此样品按相同的色谱条件进行检测,质谱采用全扫描(Scan)模式收集信号,发现在12.553min时,有较大峰出现,经质谱图检索确定该峰为丙烯酰胺单体。究其原因,可能是因为Glu/Asn添加量为0.500g/0.600g时,模型中产生的丙烯酰胺量过多,以至于在对丙烯酰胺进行溴化衍生时溴化反应不完全,体系中仍有大量丙烯酰胺单体存在,使得色谱图中主要峰为丙烯酰胺,主峰拖尾覆盖了溴化产物峰,影响了溴化丙烯酰胺的检出。
当模型中Glu/Asn的添加量为0.010g/0.012g和0.050g/0.060g时,产生丙烯酰胺的平均量分别为1.26mg/L和4.39mg/L,RSD均在10%内,平行样间的稳定性较好。GC/MS分析结果显示,溴化反应基本完全。总离子流图在15.291min处有2-溴丙烯酰胺峰出现,而在12.553min,未发现丙烯酰胺单体。
综合以上结果可见,当 Glu/Asn添加量为0.500g/0.600g时,产生丙烯酰胺量过多,影响溴化效率;当 Glu/Asn添加量为0.010g/0.012g和0.050g/0.060g时溴化反应基本完全,模型较为稳定。0.050g/0.060g与0.010g/0.012g相比,反应物质量增加到5倍,检测到丙烯酰胺产量未成正比增加。考虑到反应物添加量较低,称量时更容易引入误差,因此选取Glu/Asn添加量为0.050g/0.060g作为丙烯酰胺化学模型中的反应物加入量。
2.3 化学模型反应温度、时间的选择
2.3.1 反应温度、时间对化学模型丙烯酰胺生成量的影响 Glu/Asn添加量为0.050g/0.060g时,分别在 150、170℃油浴加热 2、4、5、6、8min,冷却后检测其丙烯酰胺含量,结果见图1。
在150℃和170℃两种不同的温度条件下,化学模型中丙烯酰胺含量总体变化趋势是温度越高含量越高。在反应温度为150℃时,加热2min后反应体系中丙烯酰胺的浓度达到0.92mg/L,继续加热,体系中丙烯酰胺的浓度逐步增加,加热8min后,反应体系中丙烯酰胺的浓度为5.50mg/L。170℃时,情况与150℃时相似。体系中丙烯酰胺浓度随加热时间延长而逐步增加。加热8min后,反应体系中丙烯酰胺浓度达到11.36mg/L。
文献[11]采用Glu/Asn摩尔比为1∶1的化学模型,在120、140、160、180℃等温度条件下加热不同时间(0~45min),发现在加热的开始阶段,反应体系中丙烯酰胺的产生量都是逐渐上升。而当加热到一定时间后,丙烯酰胺的产生量达到最高值,然后逐渐下降。高温条件下,达到丙烯酰胺产生量最大值所需的时间更短。本论文所研究的加热最大时间为8min,由图1可见,两种不同的加热温度下,8min内丙烯酰胺的产生量仍处在上升阶段,未达到最高值。考虑到化学模型体系的评价效率问题,本文未再深入研究加热较长时间与反应中丙烯酰胺的产生量之间的关系。
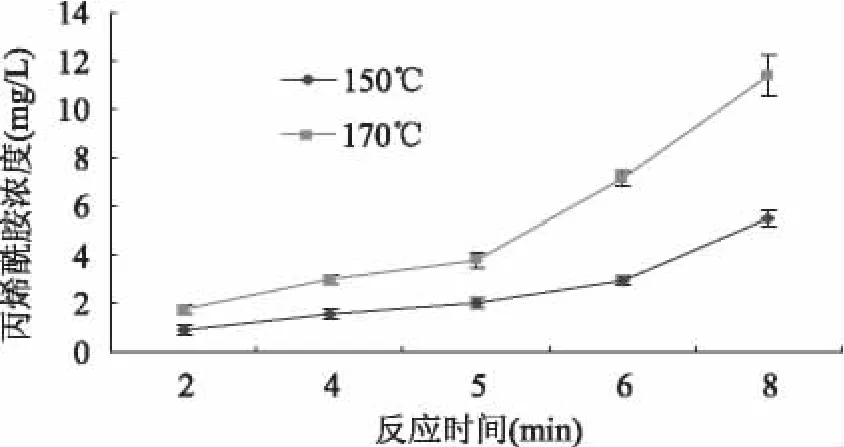
图1 反应温度、时间对化学模型中丙烯酰胺产生量的影响Fig.1 Effect of reaction time and temperature on yield of acrylamide in chemical model
2.3.2 反应温度、时间对化学模型产物颜色的影响 当淀粉类食品中在较高的温度条件下进行加工时,常常会伴随着发生美拉德反应(Maillard reaction)。美拉德反应对食品的感官性质有重要影响,是其色泽和风味的主要来源。因此,在建立化学反应模型作为丙烯酰胺抑制剂评价体系时,不仅要考虑到化学模型中丙烯酰胺的产生量,还要考虑化学模型中的颜色变化,以免影响食品感官品质。初步研究表明,产物的颜色会随着加热温度、时间的增加逐步变深,达到最大值后基本保持稳定,之后温度、时间等条件对产物颜色的影响不明显。因此,要使抑制剂对于产物颜色的影响有较明显的体现,在选择反应体系温度、时间时,应尽量避免选择产物颜色峰值处。本文采用样品溶液对波长为420nm可见光的吸收来表征样品的颜色[12]。
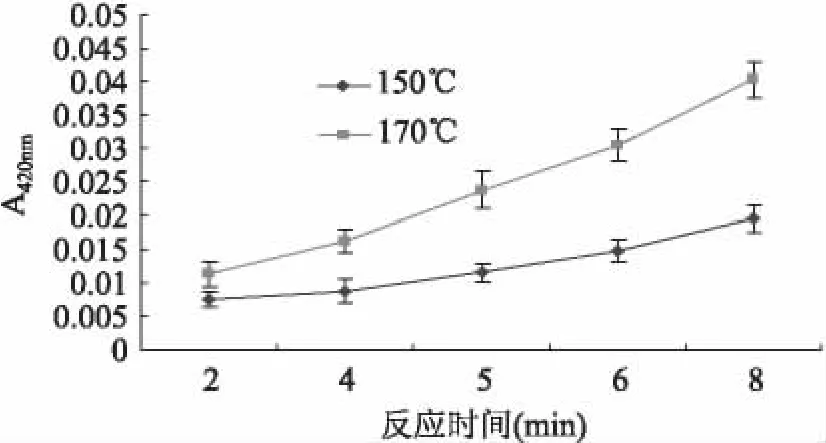
图2 温度、时间对化学模型中反应产物吸光值的影响Fig.2 Effect of reaction time and temperature on absorbency of chemical model production
如图2所示,在150℃和170℃两种不同的温度条件下,化学模型中产物颜色的总体变化趋势是随着温度升高而颜色加深。文献[9]采用Glu/Asn摩尔比为1∶1的化学模型,研究了在150、170℃等温度条件下不同加热时间对反应体系颜色的影响,结果表明,两种温度下,反应体系的颜色逐渐变深;而当加热到约30~40min后,反应产物的吸光度达到最高值,然后逐渐下降。由此可见,本文拟选用的加热温度170℃,反应时间5min条件,得到的反应产物颜色适中,未达到最大值,可同时评价抑制剂对反应体系颜色的影响。
2.4 食品模型中反应温度、时间的选择
2.4.1 反应温度、时间对食品模型丙烯酰胺生成量的影响 在丙烯酰胺的研究中,有学者采用薯片[13]、薯条[14]、饼干和面包[15]等食品作为食品模型,研究温度、时间、抑制剂等条件对模型体系感官性质、丙烯酰胺产生量的影响。鉴于油炸薯片具有容易制备、加工条件容易控制、丙烯酰胺含量相对较高等特点,本论文采用油炸薯片作为化学模型评价体系的补充手段,对经过化学模型筛选得到的抑制剂进行功能验证。
在对薯片进行油炸的过程中,丙烯酰胺的生成量一般随着温度和时间的延长而增加。而当加热进行到一定阶段后,可能由于丙烯酰胺的聚合或者分解而使食品基质中丙烯酰胺的生成量有所降低。本研究结果见图3,150℃油炸条件下,2min时在薯片中丙烯酰胺的产生量低于方法的检测限,之后丙烯酰胺的产生量随时间延长逐渐增加,至8min时达到5.98mg/kg,而后丙烯酰胺的产生量呈降低趋势。在170℃条件下,加热6min丙烯酰胺产生量达到最高,之后也呈下降趋势。在170℃、5min的条件下,薯片中丙烯酰胺的检测含量为6.88mg/kg,含量较高且未达到最大的丙烯酰胺产生量,考虑到与化学模型的反应条件相对应,本研究中采用约2mm厚薯片,在蒸馏水或抑制剂溶液中浸泡3min后,于170℃油炸5min作为食品模型。

表2 CaCl2对化学模型和食品模型中丙烯酰胺及产物吸光度的影响Table 2 Effects of CaCl2on yield of acrylamide and absorbance of chemical and food model system
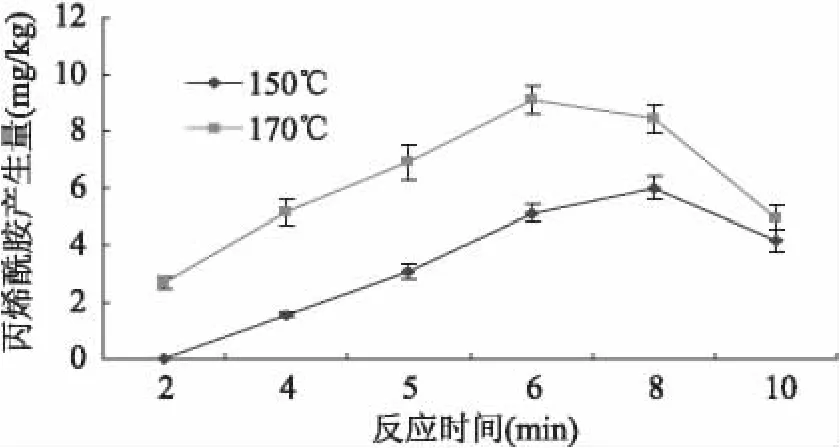
图3 温度、时间对食品模型中丙烯酰胺产生量的影响Fig.3 Effect of reaction time and temperature on yield of acrylamide in food model
2.4.2 温度、时间对食品模型颜色的影响 由图4可见,150℃条件下,油炸时间在2~8min范围内,薯片水提液420nm处吸光值逐渐加大,8min后薯片颜色的加深速率明显加大。170℃时,初始阶段随时间延长薯片颜色逐渐加深,8min时吸光值增至较大值,之后保持稳定。可见,当加热时间较长时,产物吸光值可能达到最大值,在一定范围内改变油炸温度、时间等参数不会使产物吸光值发生较大改变,应避免在此条件下进行抑制剂的筛选评价。本文所采用的条件为170℃油炸5min,产物吸光值适中,并未达到最大阶段,可以用来进行抑制剂评价工作。
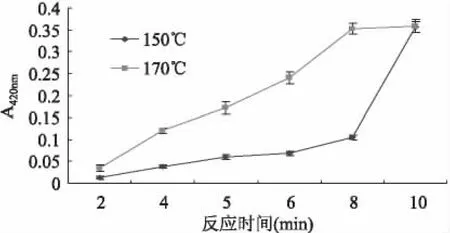
图4 温度、时间对食品模型中反应产物吸光值的影响Fig.4 Effect of time and temperature on absorbency of food model production
2.5 化学模型及食品模型的验证
在丙烯酰胺抑制剂的相关研究中,CaCl2对丙烯酰胺的抑制作用得到了广泛的证明[16]。因此,本论文中采用CaCl2溶液分别加入到化学模型和食品模型中,作为阳性对照,验证化学模型和食品模型对抑制剂的筛选能力,结果如表2所示。结果表明,阳性对照品CaCl2溶液对化学模型及食品模型中丙烯酰胺有抑制作用,此结果与已有的关于CaCl2溶液对丙烯酰胺抑制作用的报道基本相符。说明本文所建立的化学模型与食品模型,可以准确的评价抑制剂对于丙烯酰胺的抑制作用与抑制率。本研究的结果初步显示CaCl2溶液的添加对于化学模型颜色无明显影响,可能与本研究中CaCl2溶液的添加量较少有关,需要进行进一步研究。
3 结论
本文研究了不同温度、时间及反应物的添加量对模型中丙烯酰胺产生量及产物颜色的影响。综合考虑丙烯酰胺生成量以及反应时间等方面的因素,本文建立的化学模型的反应条件为:0.050g天冬酰胺、0.060g葡萄糖加入3mL水,于不锈钢试管中170℃油浴加热5min。食品模型的反应条件为:约2mm厚薯片,在蒸馏水中浸泡3min后,于170℃油炸5min。此模型简单地模拟了丙烯酰胺在食品加工过程中的形成条件,操作便捷、稳定,可以广泛用于丙烯酰胺抑制剂的筛选评价,对于控制食品加工中丙烯酰胺的形成有重要意义。
目前已知的对食品加工中丙烯酰胺的形成有抑制作用的物质有离子化合物、有机酸、植物黄酮等,由于加工工艺和食品口感等原因,尚未有成熟的抑制剂用于食品的生产加工过程。丙烯酰胺抑制剂的筛选还需要进行大量的工作和深入的研究。
[1]Paulsson B,Granath F,Grawe J,et al.The multiplicative model for cancer risk assessment:aplicability to acrylamide[J].Carcinogenesis,2001,22:817-819.
[2]IARC.Acrylamide IARC monographs on the evaluation of carcinogenic risks to humans[R].Lyon,International Agency for Reseach on Cancer,1994,60:389-433.
[3]Swedish National Food Administration.Information about acrylamide in food,2002-5-24,http://www.slv.se.
[4]Zyzak D V,Sanders R A,Stojanovic M,et al.Acrylamide formation mechanism in heated foods[J].J Agric Food Chem,2003,51:4782-4787.
[5]Becalski A,Lau B P Y,Lewus D,et al.Acrylamide in foods:occurrence,sources,and modeling[J].J Agric Food Chem,2003,51(3):802-808.
[6]Zhang Y,Wang J,Zhang Y.Study on formation of acrylamide under low-moisture asparagine-sugar reaction system[J].Food Chem,2007,104:1127-1135.
[7]Kolek E,Simko P,Simon P.Inhibition of acrylamide formation in asparagine/D-glucose model system by NaCl addition[J].Eur Food Res Technol,2006,DOI 10.1007/s00217-006-0319-8.
[8]Stadler R H,Robert F,Riediker S,et al.In-depth mechnistic study on the formation of acrylamide and other vinylogous compounds by the maillard reaction[J].J Agric Food Chem,2004,52:5550-5558.
[9]Ehling S,Shibamoto T.Correlation of acrylamide generation in thermally processed model system of aspraragine and glucose with color formation,amounts of pyrazines formed,and antioxidative properties fo extracts[J].J Agric Food Chem,2005,53:4819-4829.
[10]Robert F,Vuataz G,Pollien P,et al.Acrylamide formation from asparagine under low moisture maillard reaction conditions.2.crystalline vs amorphous model system[J].J Agric Food Chem,2005,53:4628-4632.
[11]Jeroen J K,Wil A M L,Jozef P H L,et al.Toward a kinetic model for acrylamide formation in a glucose-asparagine reaction system[J].J Agric Food Chem,2005,53:6133-6139.
[12]Moreno F J,Molina E,Olano A,et al.High-pressure effects on Maillard reaction between glucose and lysine[J].J Agric Food Chem,2003,51:394-400.
[13]Viklund G,Mendoza F,Sjoholm I,et al.An experimental set-up for studying acrylamide formation in potato crisps[J].LWT,2007,40:1066-1071.
[14]Pedreschi F,Bustos O,Mery D,et al.Color kinetics and acrylamide formation in NaCl soaked potato chips[J].Journal of Food Engineering,2007,79:989-997.
[15]Ahrne L,Andersson C,Floberg P,et al.Effect of crust temperature and water content on acrylamide formation during baking of white bread:steam and falling temperature baking[J].LWT-Food Sci Technol,2007,40(10):1708-1715.
[16]欧仕益,张玉萍,黄才欢.几种添加剂对油炸薯片中丙烯酰胺产生的抑制作用[J].食品科学,2006,27(5):137-140.
