β伴大豆球蛋白糖基化改性对其乳化性影响的研究
2012-12-05迟玉杰
张 波,迟玉杰,2,*
(1.东北农业大学食品学院,黑龙江哈尔滨150030;2.大豆生物学教育部重点实验室,黑龙江哈尔滨150030)
大豆蛋白是一种重要的植物蛋白资源,具有较高的营养价值和独特的功能性质,乳化性是其在食品工业生产上重要的功能性质[1]。大豆中近90%的蛋白质是以贮藏蛋白的形式存在,其中主要是大豆球蛋白(11S)和β-伴大豆球蛋白(7S)。大豆蛋白的乳化性与这两种成分密切相关[2-3]。Rivas曾报道7S球蛋白的乳化性能要明显高于11S球蛋白[4]。目前,工业上生产的大豆分离蛋白(SPI)是11S和7S球蛋白的混合物,11S和7S各自的功能特性得不到充分体现,制约了大豆分离蛋白在食品加工中的应用。近年来,蛋白质与多糖的糖基化改性受到广泛地关注,经改性的蛋白质功能性(如水溶性、乳化性、疏水性及脂肪吸收力等)有很大地改善[5]。蛋白质的糖基化反应主要有干热法和湿热法[6]。湿热法较干热法相比,条件相对简单,反应速率快,主要用于蛋白质与单糖或双糖的接枝反应,而与多糖进行反应的报道相对较少,有研究表明,多糖的加入较单糖与双糖更能提高蛋白质的功能性质[7]。黄原胶(XG)具有独特的物理性质(高粘度,假塑性)和化学性质(高溶解性,pH稳定性)而被广泛地应用在食品工业生产中[8]。本文选用黄原胶对β-伴大豆球蛋白进行湿法糖基化改性,优化制备具有良好乳化性能的7S球蛋白改性条件,为高乳化性大豆蛋白的实际生产提供一定的理论依据,同时丰富功能专用型大豆蛋白的种类,并拓宽大豆蛋白在食品工业中的应用范围。
1 材料与方法
1.1 材料与设备
低温脱脂豆粕(蛋白质:53.61%、脂肪:0.92%、灰分:5.80%、水分:9.1%) 黑龙江省哈高科大豆食品有限责任公司,经粉碎,过60目筛得脱脂豆粉;大豆油 九三集团哈尔滨惠康食品有限公司;邻苯二甲醛(OPA)Sigma公司;葡萄糖、乳糖、黄原胶 天津市天理化学试剂有限公司;十二烷基磺酸钠(SDS)化学纯;其他试剂均为分析纯。
LD4-2A型离心机 北京医用离心机厂;FDU-1200型冷冻干燥机 上海爱朗仪器有限公司;KND-HYP8型消化炉、KDN-2008全自动定氮仪上海纤检仪器有限公司;FS-1可调高速匀浆机 金坛市荣华仪器制造有限公司;TU-1810紫外可见分光光度计 北京普析通用仪器有限责任公司;荧光分光光度计(LS55) 美国Perkin-Elmer公司。
1.2 实验方法
1.2.1 大豆7S球蛋白的制备 大豆7S球蛋白根据国际上普遍使用的 Thanh 等人[9]和 Nagano 等人[10]的经典方法为基础进行优化制备[11-12]。凯氏定氮法测定β-伴大豆球蛋白的蛋白质含量为92.30%(N×6.25)。
1.2.2 分析方法 蛋白质含量按GB 5009.5-2010,使用凯氏定氮法测定,蛋白质转换算系数以6.25计。水分按GB 5009.3-2010测定。灰分按GB 5009.4-2010测定。
1.2.3 SDS-PAGE电泳 用SDS-PAGE非连续凝胶电泳对1.2.1中提取的大豆7S球蛋白组分进行分析,浓缩胶和分离胶的质量分数分别为4.0%和12%,考马斯亮蓝R-250染色。用BandScan5.0软件对电泳凝胶图像进行分析。
1.2.4 乳化活性及乳化稳定性的测定 本实验采用浊度法测定[13],略作改进:用 pH7.0,0.1mol/L 的磷酸盐缓冲溶液配制100mL 0.5%(m/v)的蛋白悬浮液,取30mL蛋白液于高速匀浆机中,加入10mL大豆油,10000r/min均质1min以形成乳浊液,均质后,分别在0min与10min时从底部吸取100μL分散于10mL 0.1%SDS(m/v)中,于500nm处测定吸光度值(测定三次取平均值),以A0表示乳化活性(EAI),乳化稳定性(ESI)的表示方法为:
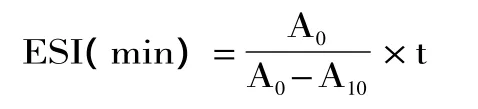
式中:A0:0min时的吸光度值;t:测定乳化性的两次时间间隔,本实验取10min;A10:10min时的吸光度值。
1.2.5 糖基化蛋白的制备 根据N Diftis等人[14]的实验方法,称取一定量的β-伴大豆球蛋白,溶于0.01mol/L磷酸盐缓冲液(pH7.0),按一定比例添加糖,充分搅拌溶解。将烧杯用保鲜膜封口,放置到一定温度的水浴中恒温反应,每间隔30min取样,装到离心管中,冰浴冷却后1500g离心15min除去不溶物,上清液4℃透析24h,冻干得到糖基化产物。
1.2.6 糖基化程度测定 采用OPA法对蛋白中糖基化程度(DG)进行测定[15]。
1.2.7 表面疏水性的测定(H0) 表面疏水性是用1-苯氨基萘-8-磺酸(ANS)作为荧光探针进行测定[16]。
1.2.8 溶解度的测定 蛋白质溶解性采用氮溶解指数(NSI,%)表示,采用 Lowry 法[17]测定。
1.2.9 褐变程度的测定 取反应后样品液2mL,加入2mL稀释液(含质量分数10%SDS,0.05mol/L硼砂),以蒸馏水(稀释液)做空白,测420nm处的吸光值,褐变程度以吸光值大小表示[18]。
1.2.10 实验设计 根据单因素实验结果与实际生产要求选取合适的因素水平,并根据螺旋中心组合设计原理,采用软件 Design Expert 7.1中 Box-Behnken模型对反应条件进行优化。各因素水平编码表如表1所示。
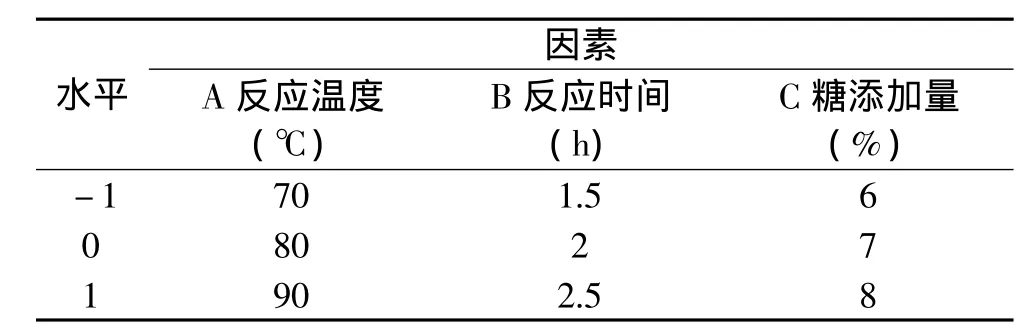
表1 实验因素水平编码表Table 1 Experiment design for levels of factors
2 结果与分析
2.1 大豆7S球蛋白SDS-PAGE电泳分析
由图1可以明显看出,电泳图中大豆7S球蛋白三个亚基(α',α,β)分离较明显,且泳带上几乎不存在大豆11S球蛋白的两个亚基染色带(AS,BS),表明所提取的大豆7S球蛋白组分纯度较高。通过BandScan5.0软件对图像进行分析,得出7S组分纯度达89%以上。
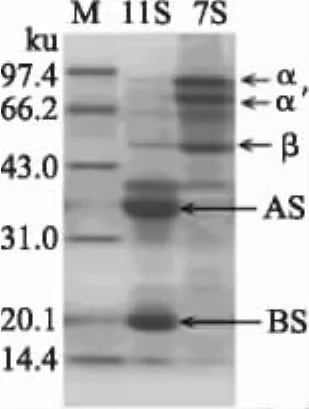
图1 大豆11S蛋白和大豆7S球蛋白样品电泳图Fig.1 Electrophoresis picture of β-conglycinin and glycinin
2.2 湿法糖基化反应的单因素研究
本实验选择以黄原胶为糖基供体,分别对反应温度、反应时间、多糖添加量进行单因素实验,根据糖基化β-伴大豆球蛋白的乳化活性高低初步确定反应条件。
2.2.1 反应温度对乳化活性的影响 如图2所示,糖基化β-伴大豆球蛋白乳化活性随反应温度升高呈现先增加后降低的趋势,反应温度对糖基化产物具有显著影响(p<0.01)。糖基化改性的目的是在蛋白分子结构改变较小的情况下,尽量增加蛋白质中亲水性基团的数量,从而使蛋白质达到更好的亲水亲油性的平衡。在一定范围内随反应温度升高,β-伴大豆球蛋白与糖共价交联速度加快,蛋白质结构展开,提高大分子表面活性,增加复合物亲水性,从而提高其乳化活性;但当反应温度继续升高超过一定程度时,蛋白质变性严重,共价复合物界面活性降低,导致糖基化β-伴大豆球蛋白乳化活性降低。
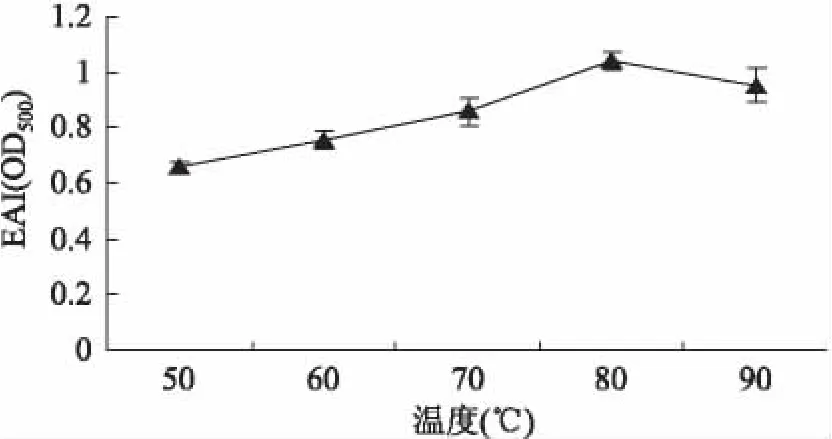
图2 不同反应温度对乳化活性的影响Fig.2 Effect of different reaction temperature on emulsifying activity index
2.2.2 反应时间对乳化活性的影响 结合图3可以看出,随着反应时间的增加,复合物的乳化活性呈现先上升后下降的趋势。当反应时间为2h时,乳化活性最高。这可能由于反应开始糖链的引入,羟基的亲水特性使得蛋白质的溶解性显著提高,糖基化改性的蛋白质部分可有效地吸附在油—水界面上,降低界面的张力,共价结合的糖分子(特别是多糖分子)链在吸附膜的周围形成立体网络状结构增加了膜的厚度和机械强度,从而增加了接枝物的乳化活性。随着反应到一定程度以后,其交联程度越来越高,使复合物过于亲水而失去界面活性,从而产物的乳化活性开始降低。
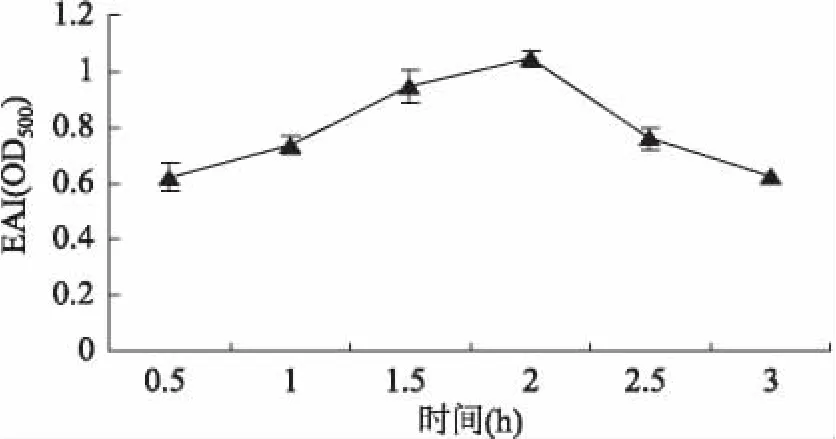
图3 不同反应时间对乳化活性的影响Fig.3 Effect of different reaction time on emulsifying activity index
2.2.3 糖添加量对乳化活性的影响 蛋白和多糖的分子间共价结合是在一定的基团间进行的,适当的反应物配比不仅可以提高反应的速度和最终的反应程度,而且还可以减少副反应(如焦糖化)的发生。由图4可以发现,糖添加量对糖基化蛋白乳化活性具有显著影响(p<0.01),随着糖的添加量增加而呈现出先上升后下降的趋势。糖的添加量为7%时,蛋白的乳化活性最大。
2.3 响应面实验优化结果
2.3.1 响应面实验设计方案及实验结果 根据实验因素水平编码表,响应面实验设计方案及结果见表2:
以乳化活性和乳化稳定性为响应值,运用Design expert 7.1软件对实验数据进行回归拟合分析,建立各因子对响应值的回归方程:
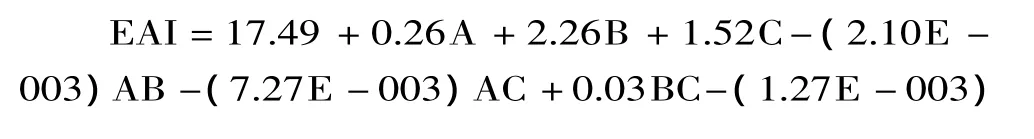
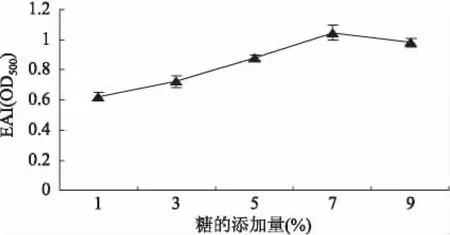
图4 不同黄原胶添加量对乳化活性的影响Fig.4 Effect of adding contents of different xanthan gum on emulsifying activity index
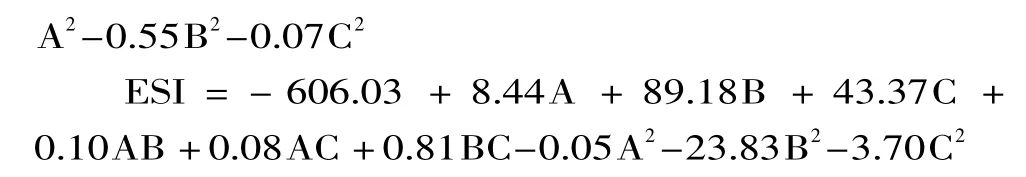
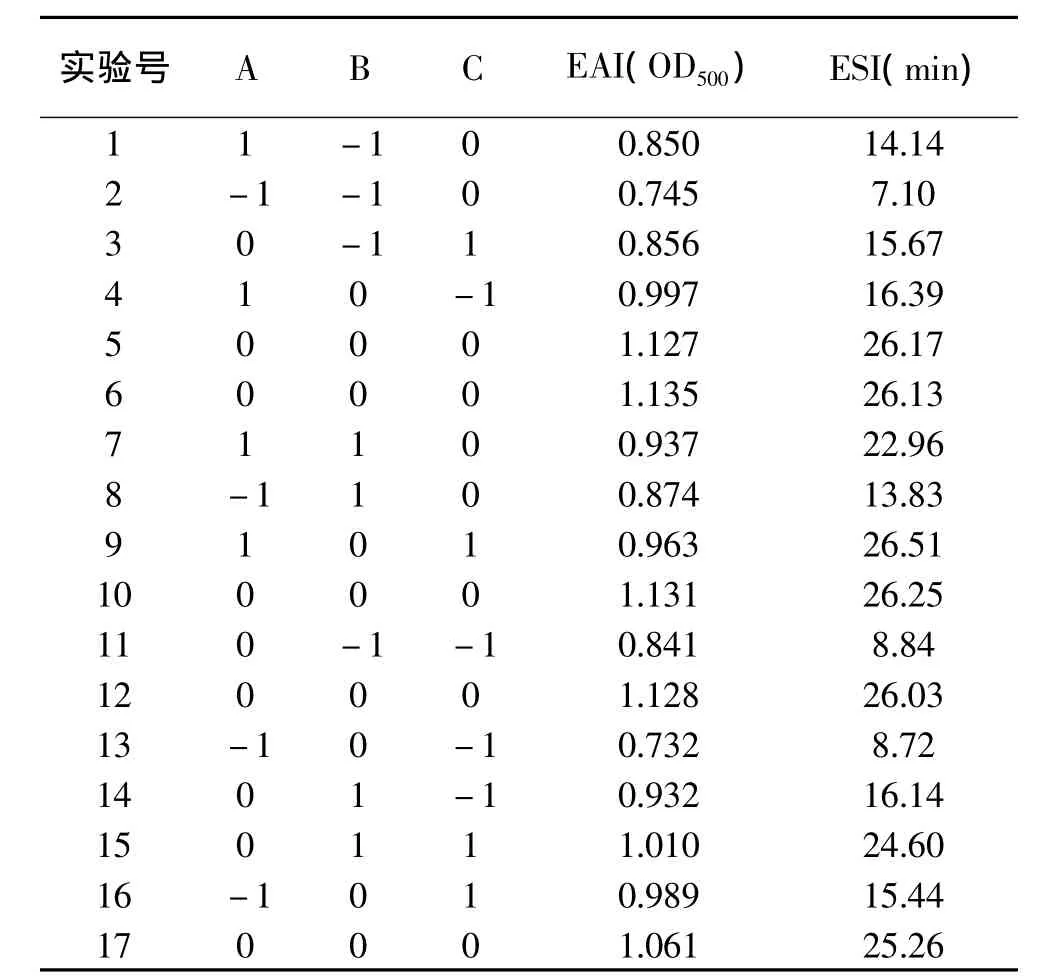
表2 实验设计条件及结果Table 2 Design and results of experiment
由表3的方差分析可以看出,乳化性和乳化稳定性回归方程模型F检验显著(p<0.05),EAI/ESI失拟项不显著(0.4860>0.0500;0.2062>0.0500),说明回归方程的拟合程度较好,实验误差较小,同时,模型的决定系数(0.9977)均大于0.8000,因此,该模型可用于预测不同条件下糖基化复合物的乳化性,也可用于优化湿法糖基化反应条件。
2.3.2 响应面的优化 根据复合物乳化活性和乳化稳定性模型的二次回归方程,利用Design Expert 7.1软件对湿法糖基化反应工艺条件进行优化,如图5~图6。以乳化活性为响应值,反应温度为89.19℃,反应时间为2.08h,糖添加量为6.82%,乳化活性可以达到1.062;而以乳化稳定性为响应值,反应温度为90℃,反应时间为2.13h,糖添加量为7.54%,乳化稳定性可以达到27.22min。考虑到具体实验的可操作性,以减少能量损耗和反应时间为基准,选择反应温度为90℃,反应时间为2h,糖添加量为7%条件下进行了5次验证实验(数据未显示),乳化活性平均为1.132,乳化稳定性平均为27.16min,验证实验结果与理论预测值接近,表明Box-Behnken模型优化可用
于糖基化反应条件优化,所得参数准确可靠,具有实用价值。由表4可以看出,经优化后的糖基化β-伴大豆球蛋白的乳化活性和乳化稳定性分别是未经处理7S的2.15倍和2.26倍,增加了蛋白质的表面疏水性和溶解性,且褐变程度不明显;对比发现单独的添加黄原胶(不加热)没有明显改善大豆7S球蛋白的表面疏水性、溶解性及乳化性;此外发现7S球蛋白经90℃加热2h后乳化性明显降低。这可能是由于蛋白质加热破坏了蛋白质的分子结构,促使蛋白质内部的疏水基团暴露,表面疏水性提高,溶解性降低造成的。
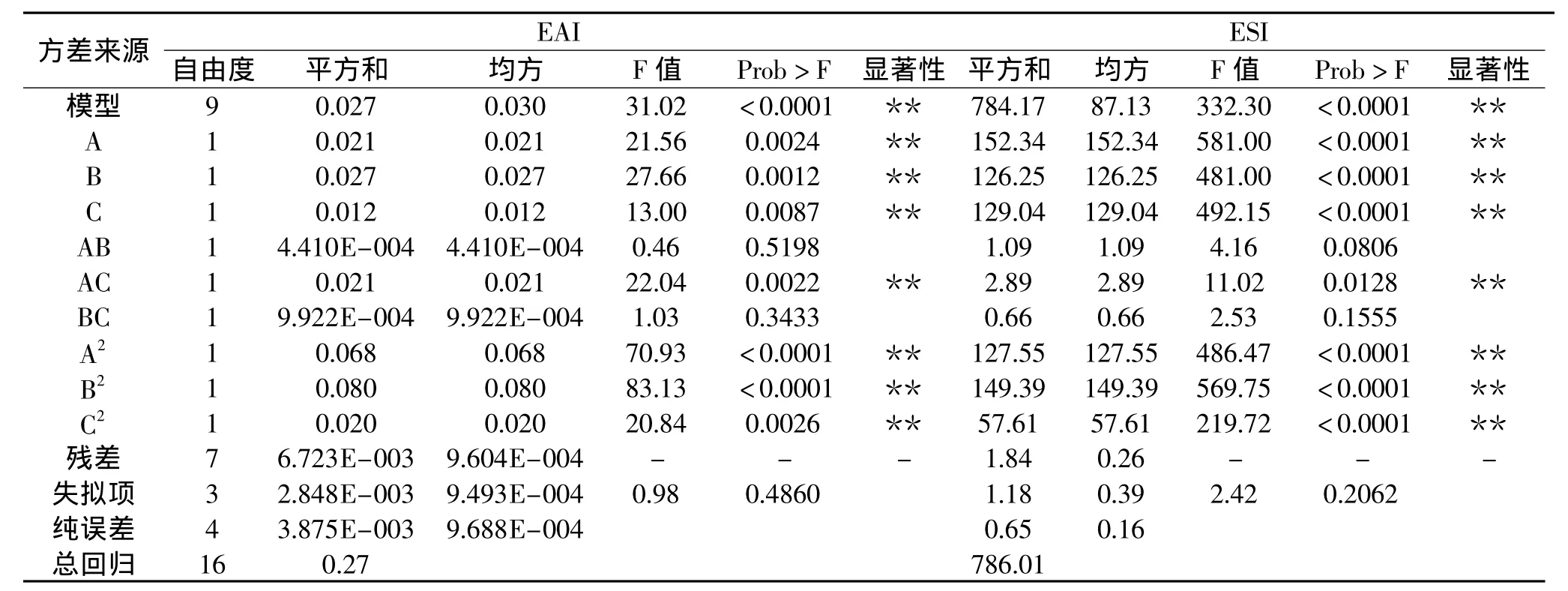
表3 乳化活性/乳化稳定性回归方程的方差分析表Table 3 Variance and significant analysis for regression equation of EAI/ESI

表4 空白与糖基化改性β-伴大豆球蛋白性能的比较(pH7.0)Table 4 Comparison of the properties between native and glycosylation modification 7S at pH7.0
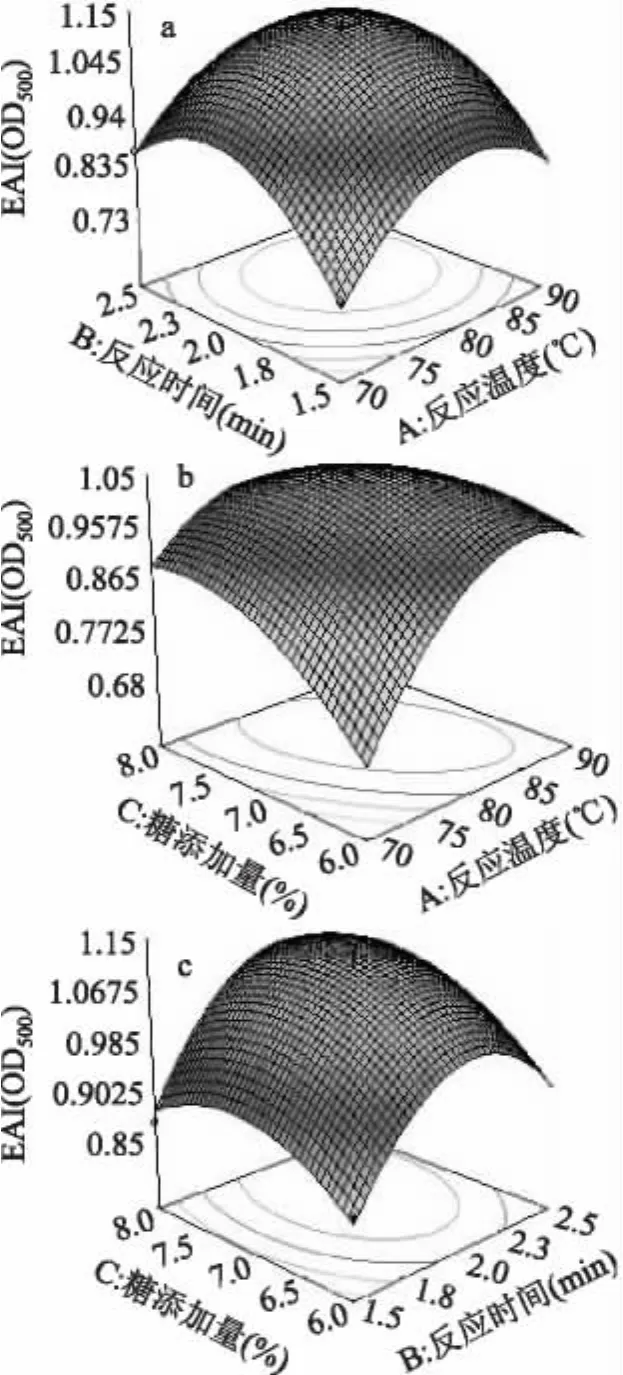
图5 乳化活性影响因素的响应面分析Fig.5 Response surface analysis of factors influencing EAI
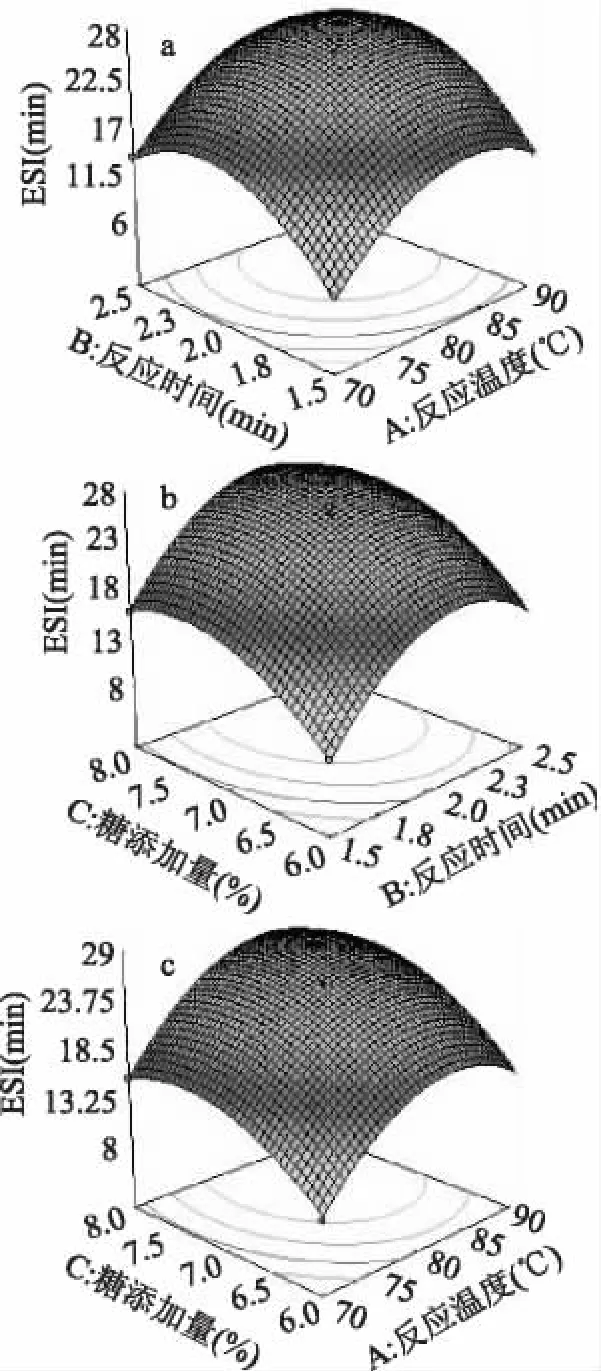
图6 乳化稳定性影响因素的响应面分析Fig.6 Response surface analysis of factors influencing ESI
3 结论
3.1 单因素实验结果表明,反应温度、反应时间、黄原胶添加量均对制备复合物乳化活性和乳化稳定性影响显著(p<0.01)。
3.2 利用Box-Behnken模型对湿法糖基化β-伴大豆球蛋白的制备技术进行了优化,方差分析表明拟合较好。结果表明多糖黄原胶与β-伴大豆球蛋白湿法糖基化反应能够显著改善复合物的乳化性。优化条件为:反应温度90℃,反应时间2h,糖添加量7%,乳化活性(EAI)为1.132,乳化稳定性(ESI)为27.16,分别是未改性7S球蛋白的2.15倍和2.26倍。
[1]MCPuppo,V Beaumal,N Chapleau,et al.Physicochemical and rheological properties of soybean protein emulsions processed with a combined temperature/high- pressure treatment[J].Food Hydrocolloids,2008(22):1079-1089.
[2]Mujoo R,Trinh D T,Ng P K W.Characterization of storage proteins in different soybean varieties and their relationship to tofu yield and texture[J].Food Chemistry,2003,82:265-273.
[3]Prak K,Nakatani K,Katsube- Tanaka T,et al.Structurefunction relationships of soybean Proglycinins at subunit levels[J].Journal of Agricultural and Food Chemistry,2005,53:3650-3657.
[4]U Shigeru,M Yasuk I,Tomohikomor I.Structure- function relationships of soy proteins.Food Proteins and Their Applications[M].France:Institus Nationalde la Recherché Agromomique Center de Recherchéde Tours Nouzilly,1997:257-289.
[5]Oliver C M,Melton L D,Stanley R A.Creating proteins with novel functionality via the Maillard reaction:A review[J].Critical Reviews in Food Science and Nutrition,2006,46:337-350.
[6]Jun-Jun Guan,Ai-Yong Qiu,Xiao-Ya Liu,et al.Microwave improvement of soy protein isolate-saccharide graft reactions[J].Food Chemistry,2006,97:577-585.
[7]Shu W,Sahara S,Nakamura S.Effect of the length of polysaccharides chains on the functional properties of the maillard-polysaccharide conjugate[J].Agric Food Chem,1996,44:2544-2548.
[8]Kobori T,Matsumoto A,Sugiyama S.pH - Dependent interaction between sodium caseinate and xanthan gum[J].Carbohydrate Polymers,2009,75(4):719-723.
[9]Thanh V H,Okubo K,ShibasakiK.Isolation and characterization of the multiple 7S globulins of soybean proteins[J].Plant Physiology,1975,56(1):19-22.
[10]Nagano T,Hirotsuka M,Mori H,et al.Dynamic viscoelastic study on the gelation of 7S globulin from soybeans[J].Journal of Agricultural and Food Chemistry,1992,40(6):941-944.
[11]姜剑,迟玉杰,孙艳梅,等.分离β-伴大豆球蛋白和大豆球蛋白工艺研究[J].食品科学,2011,32(6):13-15.
[12]朱晓烨,迟玉杰,刘红玉.大豆蛋白7S和11S组分分离方法的优化[J].食品工业科技,2011,32(7):267-269.
[13]Perace K N.Emulsifying properties of proteins evaluation of aturbidretric technique[J].Journal of Agricultural and Food Charistry,1978(26):716-723.
[14]N Diftis,V Kiosseoglou.Improvementofemulsifying propertiesofsoybean protein isolate by conjugation with carboxymethyl cellulose[J].Food Chemistry,2003,81:1-6.
[15]Brands C M J,van Boekel M A J S.Kinetic modelling of reactions in heated disaccharide- casein systems[J].Food Chemistry,2003,83:13-26.
[16]Alizadeh-Pasdar N,Li-Chan E C.Comparison of protein surface hydrophobicity measured at various pH values using three different fluorescent probes[J].Journal of Agriculture and Food Chemistry,2000,48(2):328-334.
[17]Lowry O H,Rosebrough N J,Farr A L,et al.Protein measurement with the Folin phenol reagent[J].The Journal of Biological Chemistry,1951,193:265-275.
[18]Fogliano V,Monti S M,Musella T,et al.Formation of coloured maillard reaction products in a gluten-glucose model system[J].Food Chemistry,1999,66:293-299.
