白木通籽分离蛋白的理化与功能性质研究
2012-12-05杜研学钟红兰白春清黄声芳
史 卿,杜研学,赵 强,阮 霞,熊 华,钟红兰,白春清,黄声芳
(南昌大学食品科学与技术国家重点实验室,江西南昌330047)
白木通(Akebia trifoliate(Thunb.)Koidz.var.australis(Diels)Rehd)属于木通科木通属植物,据《中国药典》2005版一部记载,其干燥茎藤入药可作木通用,味苦,性寒,具利尿、活血通脉、抗菌消炎之功效[1]。白木通果肉呈乳白色,含丰富的淀粉和可溶性糖,味美可食,果肉中含17种氨基酸,蛋白质总量为0.98g/100g,维生素 C含量高达84mg/100g,另外还含丰富的钙、钠、锌、镁、钾等矿质元素[2],其果肉的营养成分结构与沙棘大体相当。据医学研究表明,白木通茎藤具利尿、镇痛和抗炎的作用。白梅荣等[3]通过大鼠代谢笼法、体外抑菌实验、小鼠耳肿胀法研究比较三叶木通和五叶木通的水煎剂利尿、抑菌和抗炎作用,结果发现两种木通的利尿等药理作用基本相同。除此之外,木通中还具有抗癌功效的成分。白木通果无毒。江西省很多地区,如九江、萍乡、抚州等地,长期以来白木通都作为野生水果被食用,囊肉可用于熬糖;根、茎、叶可以泡茶;皮、籽、根、茎和叶均可入药。江西省科研技术人员通过采集白木通野生藤,经过多年驯化种植,已经培育出高产油、高结果率的新白木通果,平均产量可达3000斤/亩,最高产量可达6000斤/亩。通过对白木通籽和果皮基本组成进行成分分析,证明白木通是非常有价值的资源,急需开发利用。白木通籽是一种油料籽,有关部门已将其作为一种特种油来开发以缓解国内食用油资源紧张的压力。白木通籽中油脂含量为39.33%、粗蛋白含量为17.89%[4],经提取油脂后,其饼粕中含有大量的蛋白(约42%),为提高木通籽的综合利用,急需对蛋白进行开发研究。本文以白木通籽为原料,利用经典的碱提酸沉法,制备了白木通籽分离蛋白,系统的探讨了蛋白的理化性质、功能性质及评价,旨在初步研究白木通籽蛋白的物化特性,为其应用于工业化生产提供一定的理论基础。
1 材料与方法
1.1 材料与仪器
白木通籽 庐山东林寺果园;大豆油 市售;牛血清白蛋白 上海蓝季科技发展有限公司;四甲基乙二胺(TEMED)、十二烷基硫酸钠(SDS)、三羟甲基胺基甲烷(Tris)、1-苯胺基萘-8-磺酸(ANS)、β-巯基乙醇、氢氧化钠、盐酸、溴酚蓝、磷酸氢二钠、磷酸二氢钾等试剂 均为分析纯。
KDY-9820凯氏定氮仪 厦门精艺兴业科技有限公司;FD-1冷冻干燥机 北京神泰伟业仪器设备有限公司;LXJ-IIB离心机 上海安亭科学仪器厂;RH basic 1磁力搅拌器、高速分散匀浆机 德国IKA公司;新世纪T6紫外分光光度计 北京普析通用仪器有限公司;L8800氨基酸自动分析仪、F-4500荧光分光光度计 日本日立公司;SPX-250电泳仪 美国伯乐公司;MOS-450圆二色光谱仪 法国Bio-Logic公司;Quanta200F电子扫描显微镜 美国FEI公司;精密pH计 赛多利斯科学仪器(北京)有限公司。
1.2 实验方法
1.2.1 原料前处理 白木通籽干燥去除水分后,手工去皮,粉碎过筛,按固液比1∶3加入正己烷室温下磁力搅拌脱脂2h,重复三次,离心、烘干正己烷后得到脱脂白木通籽粉(DAF)。
1.2.2 白木通籽分离蛋白(API)的制备 采用碱提酸沉法制备白木通籽分离蛋白:50g DAF溶解至500mL蒸馏水中,用1mol/L NaOH调节pH至10.0,温度35℃,在磁力搅拌器上搅拌提取1.5h后离心(5000×g,15min),残渣重复提取2次,合并上清液。用1mol/L HCl调节上清液pH至4.5,4℃静置30min后离心(5000×g,15min)弃去上清液,水洗,调pH至7.0后置于超低温冰箱中-80℃预冻过夜,后置于真空冷冻干燥箱中干燥。
1.2.3 白木通籽化学组成分析 采用国家标准方法对样品的水分、灰分、蛋白、脂肪和纤维素进行测定。
1.2.4 氨基酸组成及评价 称取白木通籽分离蛋白0.25g,将样品置于水解管中,加入含有10mmol/L多酚的6mol/L盐酸溶液,真空封口。在110℃下水解24h,冷却后定容、过滤和蒸干,采用氨基酸自动分析仪上样测定蛋白质的氨基酸含量。氨基酸含量以g/100g蛋白表示。
1.2.4.1 氨基酸评分(%) 以 FAO/WHO(2007)[5]小孩推荐模式为参考按照如下公式计算:

1.2.4.2 九种必需氨基酸的数量与总氨基酸的数量之比 E/T(%)。
1.2.4.3 蛋白质功效比值(PER)的估算 Alsmeyer[6]等人提出的回归方程计算:


1.2.4.4 蛋白质生物价(BV)的估算 根据Morup和Olesen[7]提出的回归方程计算:

1.2.5 十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析 参考 Laemmli方法[8]采用不连续缓冲液系统,浓缩胶和分离胶质量浓度分别为5%和12.5%。蛋白样品溶解于0.05mol/L Tris-HCl缓冲溶液(含质量分数1%的SDS,1%的β-巯基乙醇,40%的蔗糖和0.02%的溴酚蓝)中配制成质量浓度1mg/mL的溶液,样品上样前在沸水中加热5min,离心(10000×g,10min)。取上清液10μL进样,电泳在室温条件下,浓缩胶中电流恒定为15mA,当样品前沿到达分离胶时电流改为25mA。电泳结束后,用0.05%考马斯亮蓝R-250溶液(染料溶解于体积比为46∶227∶227的冰乙酸、甲醇和水混合溶液中)染色3h,后用体积比为50∶75∶875的甲醇、乙酸和水混合溶液对凝胶脱色6h。蛋白标品的分子量范围15~170ku。
1.2.6 扫描电镜(SEM)观察 采用FEI公司的Quanta 200F型电子扫描显微镜(Scanning Electron Microscope,SEM)对蛋白显微形态进行观察。蛋白样品经过粘台、喷金等步骤后,在加速电压为20kV的条件下用SEM进行观察。
1.2.7 圆二色谱分析 蛋白样品的二级结构组成采用法国Bio-Logic公司的MOS-450型旋光分光计测定。称取一定质量的蛋白样品,分散于10mmol/L磷酸缓冲液(pH7.2)中使蛋白质量浓度为0.1mg/mL。测定前过微孔滤膜(0.45μm),采用远紫外区CD光谱,扫描范围为190~250nm,样品池光程1mm,每个样品扫描三次取平均值,测定参数:分辨率1nm,捕获时间1s,带宽0.5nm,灵敏度100mdeg/cm。以磷酸缓冲液为空白对照[9]。
1.2.8 溶解度 将蛋白样品溶于蒸馏水中,配制成质量分数为1%的蛋白溶液,于磁力搅拌器上搅拌30min使其充分分散,而后用 0.5mol/L盐酸或0.5mol/L氢氧化钠将溶液pH分别调至2~12,25℃继续搅拌溶解30min后5000×g离心15min。用Lowry法[10]测定上清液中蛋白质的含量,以牛血清蛋白为标准蛋白。每组实验做三组平行对照。

1.2.9 表面疏水性测定 采用荧光探针剂ANS法[11]。将样品分散于0.01mol/L、pH7.0磷酸缓冲液中配制成1mg/mL的原液,后用相同缓冲液将其稀释成50、100、150、200、250μg/mL 五个系列浓度的溶液。每4mL系列浓度的蛋白溶液加入50μL的1-苯胺基-8-萘磺酸(1-anilino-8-naphthalene sulfonic acid,ANS)溶液(8mmol/L ANS溶于0.01mol/L磷酸盐缓冲液)。混匀后采用荧光分光光度计测定,操作条件为:激发波长390nm,扫描范围400~700nm,扫描速度500nm/min,激发狭缝和发射狭缝宽均为3nm。响应时间为0.1s,记录470nm波长处的荧光发射强度,用荧光强度对蛋白溶液浓度作图并进行线性回归,以线性回归斜率作为表面疏水性的指标。每组实验做三组平行对照。
1.2.10 起泡性与起泡稳定性 参照文献[12]以不同 pH(3.0、5.0、7.0、9.0)的磷酸缓冲溶液配制20mL质量浓度为1%的蛋白溶液,采用高速分散匀浆机均质1min(15000r/min)后,迅速记录泡沫所占的体积V1;室温下静置30min后,再次记录泡沫的残余体积V2,每组实验做三组平行对照。计算公式如式5、式 6:
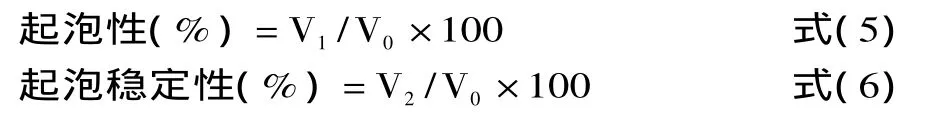
式中:V0为蛋白溶液的体积,即20mL。
2 结果与分析
2.1 白木通籽化学组成分析
对白木通籽化学组成进行分析,每个成分测定三次,取平均值。白木通籽中水分为6.23%,灰分3.58%,粗脂肪38.83%,蛋白质17.23%。其中粗脂肪含量与花生中油脂含量相当,蛋白质含量略高于豆荚中蛋白含量。白木通籽经脱皮和脱脂后,油脂和蛋白含量分别为5.12%和41.83%。白木通籽分离蛋白的纯度为86.04%,其提取率为82.65%。可见,白木通籽中蛋白含量高,经油脂加工后,脱脂粉将会作为一种新型的丰富植物蛋白资源而被大力开发。
2.2 氨基酸组成及评价
表1为白木通籽分离蛋白的氨基酸含量分析结果,并以FAO/WHO(2007)推荐模式作对照对其氨基酸进行评价。数据显示,白木通籽分离蛋白中谷氨酸和天门冬氨酸含量最高,分别为17.84g/100g蛋白和11.63g/100g蛋白。必需氨基酸中,与 FAO/WHO(2007)2~5岁小孩的推荐模式相比,白木通籽分离蛋白含较高的缬氨酸、亮氨酸、异亮氨酸、组氨酸、赖氨酸和芳香族氨基酸;苏氨酸和含硫氨基酸含量与之相比较低。然而,此8种必需氨基酸含量均高于FAO/WHO(2007)成人推荐模式。值得一提的是,赖氨酸一般是谷物中的限制性氨基酸,白木通籽分离蛋白中赖氨酸含量为5.91/100g蛋白,明显高于大米中赖氨酸的含量(3.7g/100g)[13]。白木通籽分离蛋白组分与FAO/WHO(2007)小孩推荐模式相比的氨基酸评分结果显示,苏氨酸为白木通籽分离蛋白的第一限制性氨基酸,含硫氨基酸为分离蛋白的第二限制性氨基酸。白木通籽分离蛋白E/T值高于FAO/WHO衡量理想蛋白资源的推荐值(36%),其PER值与优质蛋白的衡量标准值2.00相比属于优质蛋白。

表1 白木通籽分离蛋白氨基酸分析结果(g/100g蛋白)及其氨基酸评价Table 1 Amino acid composition of API and its amino acid score
2.3 SDS-PAGE分析
图1为白木通籽分离蛋白在还原状态下的电泳图谱。由图可知,白木通籽分离蛋白的主要亚基分子量范围为25~35ku。与传统蛋白资源(如花生、大豆蛋白)相比,白木通籽分离蛋白的亚基分子量较小。
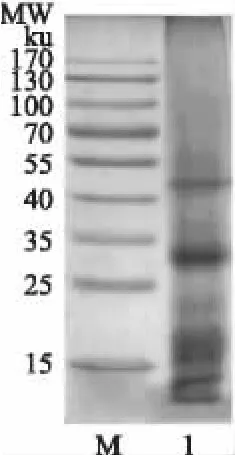
图1 白木通籽分离蛋白SDS-PAGE电泳图Fig.1 SDS-PAGE patterns of API
2.4 表面形态观察
蛋白提取过程中,采用不同的萃取液制备的蛋白可能会呈现不同的分子形态结构。传统碱提酸沉法提取得到的白木通籽分离蛋白在400、1600倍的扫描电镜下的表面微观结构如图2所示。白木通籽分离蛋白的分子结构形态类似晶状体,晶状体结构比较疏松,分布不均匀,而且表面也不平整。

图2 API超微结果Fig.2 Microphotograms of API in SEM
2.5 圆二色谱结果
采用远紫外圆二色光谱测定白木通籽分离蛋白的二级结构组成。结果显示,白木通籽分离蛋白的二级结构由11.9%的 α-螺旋,31.2%的 β-折叠,20.3%的转角和36.6%的无规则卷曲构成,如表2所示。这说明β-折叠和无规则卷曲是白木通籽分离蛋白的主要二级结构,荞麦蛋白中也发现了相类似的结果[14]。

图3 白木通籽分离蛋白的圆二色谱曲线Fig.3 Circular dichroism spectroscopy of API

表2 白木通籽分离蛋白圆二色谱结果Table 2 Secondary structures of API
2.6 溶解性
蛋白质的溶解性是功能性质中最重要的一个性质,它会极大地影响其他功能性质,同时又受pH的影响。白木通籽分离蛋白溶解性随pH的变化曲线如图4所示。白木通籽分离蛋白的溶解性曲线呈现U形,随着pH的增加,溶解度先降低,而后在pH5~10范围内持续上升。在pH4~5内,蛋白溶解度呈现最低值,此时白木通籽分离蛋白的溶解度为2.10%。一般而言,蛋白质的溶解度在其等电点附近是最低的,越远离等电点,溶解性越好。原因是在等电点时,电荷斥力消失,从而导致蛋白分子表面电荷为零[15]。白木通籽分离蛋白的高溶解性能在 pH达10.0以上呈现出来。
2.7 表面疏水性
表面疏水性表明了蛋白质分子疏水性区域的暴露程度,能够极大地影响蛋白质的表面张力和乳化活性。表明疏水性数值越高,蛋白分子间凝聚作用力越低[16]。白木通籽分离蛋白在pH7.0时的表面疏水性为379.4。

图4 白木通籽分离蛋白溶解度随pH变化情况Fig.4 Solubility of API as influenced by pH
2.8 起泡性与起泡稳定性
pH对蛋白起泡与起泡稳定性的影响如图5所示。一般而言,蛋白质的高溶解性是其拥有良好起泡性和起泡稳定性的先决条件。蛋白适当的溶解能够增强表面吸附,对于泡沫的形成十分有利。许多蛋白在等电点附近容易凝聚,从而降低蛋白成膜的稳定性[17]。在强酸或强碱环境中,由于蛋白质表面的静电荷增多,从而使蛋白质的溶解性能和表面活性增强,最终使蛋白的起泡性能得到增强[18]。图5显示,起泡性图像与白木通籽分离蛋白的溶解性曲线呈现高度的相关性。在pH5.0处,API的起泡性值最低,为10.4%。同时,API在pH9.0处呈现最高的起泡性值(63.1%)。这种起泡性值随着pH由5.0增加到9.0上升的现象是由蛋白质的柔性增强引起的。蛋白伸展开来使其快速分散到空气与水界面包埋空气颗粒,从而使起泡能力增强[19]。
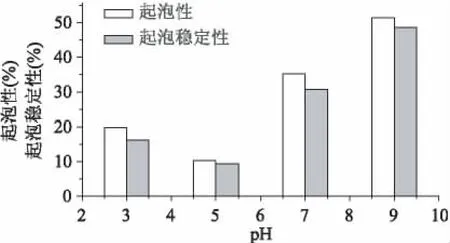
图5 白木通籽蛋白起泡稳定性随pH变化情况Fig.5 Foaming capacity and foaming stability of API by pH
3 结论
本实验采用碱提酸沉法对白木通籽中可溶性蛋白进行了提取,并对其理化性质与功能性质进行了分析。研究表明,白木通籽分离蛋白含17种氨基酸,其中谷氨酸和天门冬氨酸的含量相对较高,有贮藏蛋白的共性。苏氨酸为白木通籽分离蛋白的第一限制性氨基酸。白木通籽分离蛋白的等电点在pH4~5之间,在此pH范围内,蛋白的溶解性和起泡能力均为最低。这些结果可为白木通籽分离蛋白的开发、可食用植物蛋白质的资源开发应用提供理论依据,为开辟白木通附加值的新途径提供参考资料。
[1]马双成,陈德昌,赵淑杰.蓣知子的化学成分研究I.白木通种子中的3位单糖链皂甙化合物[J].中草药,1994,25(4):171-174.
[2]刘占朝.三叶木通研究进展综述[J].河南林业科技,2005,25(1):20-22.
[3]白梅荣,张冰,刘小青,等.三叶、五叶木通提取物药效及对药酶影响的比较研究[J].中华中医药学刊,2008,26(4):732-735.
[4]蒋岩,杜研学,熊华,等.白木通籽油的理化性质与热氧化稳定性[J].食品科学,2011,32(15):34-38.
[5]潘敏尧.大米浓缩蛋白的研制及蛋白改性的研究[D].杭州:浙江大学,2006.
[6]RH Alsmeyer,AD Cunningham,M L Happich.Equations predict PER from amino acid analysis[J].Food Technology,1974(28):34-38.
[7]IK Morup,ES Olesen.New method for prediction of protein value from essential amino acid pattern[J].Nutrition Report Kit,1976(13):355-365.
[8]Laemmli U K.Cleavage of saturated proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227:680-685.
[9]F Massimo,Marcone,Y Kakuda,et al.Salt- soluble seed globulins of dicotyledonous and monocotyledonous plants II.Structural characterization[J].Food Chemistry,1998,63(2):265-274.
[10]Lowry O H,Rosembroug H J,Lewis A,et al.Protein measurement with the Folin Phenol reagent[J].Journal of Biological Chemistry,1951,193(1):265-275.
[11]Haskard C A,Li- Chan E C Y.Hydrophobicity of bovine serum albumin and ovalbumin using uncharged(PRODAN)and anionic(ANS-)fluorescent probes[J].Journal of Agricultural and Food Chemistry,1998,46(7):2671-2677.
[12]Sze-Tao K W C,Sathe S K.Functional properties and in vitro digestibility of almond(Prunus dulcis L.)protein isolate[J].Food Chemistry,2000,69(2):153-160.
[13]Eknayake S,Jansz E R,Nair B M.Proximate composition,mineral and amino acid content of mature Canavalia guadiata seeds[J].Food Chemistry,1999,66(1):115-119.
[14]Tang C H,Wang X Y,Liu F,et al.Physicochemical and conformational properties of buckwheat protein isolates:influence of polyphenol removal with cold organic solvents from buckwheat seed flours[J].Journal of Agricultural and Food Chemistry,2009,57(22):10740-10748.
[15]Chavan U D,McKenzie D B,Shahidi F.Functional properties of protein isolates from beach pea(Lathyrus maritimus L.)[J].Food Chemistry,2001,74(2):177-178.
[16]Hojilla- Evangelista M P,Evangelista R L.Functional properties of protein from Lesquerella fendleri seed and press cake from oil processing[J].Industrial Crops and Products,2009,29(2):466-472.
[17]Mwanjala A M,Kharidah M,Jamilah B,et al.Influence of altered solvent environment on the functionality of pigeonpea(Cajanus cajan)and cowpea(Vigna unguiculata)protein isolates[J].Food Chemistry,2000,71(2):157-165.
[18]DiaelDin M R,Elfadil E B,Abdullahi H E.Fractionation,solubility and functional properties of cowpea(Vigna unguiculata)proteins as affected by pH and/or salt concentration[J].Food Chemistry,2004,84(2):207-221.
[19]Chau C F,Cheung K,Wang Y S.Functional properties of protein isolates from three indigenous legume seeds[J].Journal of Agricultural and Food Chemistry,1997,45(7):2500-2503.
