Folin-Ciocalteu比色法测定黑莓多酚的含量
2012-12-03居正英赵慧芳吴文龙
居正英,赵慧芳,吴文龙
(江苏省·中国科学院植物研究所,江苏 南京 210014)
黑莓(Blackberry)为蔷薇科(Rosaceae)悬钩子属(Rubus L.)植物,原产北美[1],是当今风靡欧美的第三代小果类果树的重要成员。黑莓果实营养丰富,富含多酚类物质和花色苷色素,具有较强的抗氧化[2]、清除自由基[3]、抗癌[4]、抗突变[5]、预防动脉硬化等作用。2000年以来黑莓的抗氧化作用逐渐成为研究的热点[6],而黑莓多酚物质含量的测定可以较好的衡量黑莓果实的抗氧化能力。因此,建立快速准确测定黑莓果实中多酚类物质的方法,具有重要的意义。
目前总多酚含量的测定有纸层析、薄层层析、高效液相色谱、气液色谱-质谱联用、Folin-Ciocalteu试剂等多种方法[7-8]。其中纸层析、薄层层析在分离效果、速度和准确定量方面存在缺陷;气液色谱——质谱联用用于植物酚类物质的分离测定速度快、灵敏度高,但该法需要衍生化处理,前处理比较麻烦;而高效液相色谱法费用较高,不适于大量的定量分析。比较而言,Folin-Ciocalteu比色法有价格低、操作方便等特点。为了建立一种简便、快速、准确地测定黑莓果实中多酚含量的光谱分析方法,本实验对Folin-Ciocalteu比色方法的主要影响因素及稳定性、重现性、精密度等方面进行了研究,建立了测定黑莓总多酚含量的Folin-Ciocalteu法。为黑莓资源的高效开发利用提供参考。
1 材料与方法
1.1 材料
Boysen品种黑莓冻果:2009年6月采于江苏省中国科学院植物研究所黑莓品种园,-18℃速冻保存。
1.2 试剂和仪器
没食子酸标准品、Folin-Ciocalteu's试剂(2moL/L)、碳酸钠、乙醇为分析纯;EX-200A型电子天平:慈溪市天东衡器厂;HR2838PHILIPS搅拌机:飞利浦电子公司;TU-1810紫外可见分光光度计:北京普析通用仪器有限公司;PL-5-B型低速离心机:上海安亭科学仪器厂;KQ-100DE数控超声波清洗仪:昆山市超声仪器有限公司。
1.3 方法
1.3.1 样品的预处理
取黑莓冻果400 g于微波炉中微波解冻,用搅拌机匀浆,备用。
1.3.2 总多酚的提取
称取4.000 g黑莓匀浆,用120 mL 60%乙醇混匀,置于50 Hz,40℃超声仪中超声提取40 min,提取完成后,4000 r/min离心10 min,取上清液定容至200 mL,此样品液备用。
1.3.3 标准曲线的绘制
1.3.3.1 没食子酸标准溶液配制
准确称取0.5000 g没食子酸,用纯净水溶解,并定容至 1000 mL,分别移取 1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0 mL 到 100 mL 容量瓶中,加水定容。其中没食子酸的浓度分别为 5、10、15、20、25、30、35、40、45、50 mg/L。
1.3.3.2 标准曲线的绘制
按照1.3.3.1方法配制各浓度的没食子酸溶液,在0.5 mL各浓度没食子酸标准溶液中加人2.5 mL 0.1 moL/L Folin-Ciocaltou试剂,然后加入2 mL 7.5%的Na2CO3,置于25℃下反应120 min后在765 nm下测定吸光度值,以吸光度为纵坐标,标准溶液浓度为横坐标,绘制的标准曲线。
1.3.4 Folin-Ciocalteu法测定条件的优化[9-10]
1.3.4.1 最佳波长的测定
取50 mg/L没食子酸标准溶液及处理的样品液各0.5mL中加入2.5mL 0.1moL/L Folin-Ciocaltou试剂,然后再加入2 mL 7.5%Na2CO3,25℃避光静置120 min,用分光光度计在400 nm~900 nm波长范围内分别扫描没食子酸标准溶液与处理样品液的吸收光谱,确定其最大吸收波长。
1.3.4.2 试剂浓度的优化
Folin-Ciocaltou试剂浓度的确定:取4支10 mL具塞刻度试管,分别加入0.5 mL 50 mg/L没食子酸标准品溶液后,然后分别加入0.08、0.1、0.12、0.2 mol/L的Folin-Ciocaltou试剂各2.5mL,混匀,最后依次加入2mL 7.5%的Na2CO3振荡混匀,25℃避光反应120 min后,于最大吸收波长处测定其吸光度,以吸光度最高的反应体系的Folin-Ciocaltou试剂浓度为最优浓度。
Na2CO3溶液浓度的确定:取4支10 mL具塞刻度试管,分别加入0.5 mL 50 mg/L没食子酸标准品溶液后,再分别加入2.5 mL 0.1 mol/L Folin-Ciocaltou试剂后立即混匀,再分依次加入2 mL不同浓度5%、7.5%、10%、15%的Na2CO3溶液混匀,25℃避光反应120 min后,于最大吸收波长处测定其吸光度,以吸光度最高的反应体系的Na2CO3溶液浓度为最优浓度。
1.3.4.3 显色温度与显色时间的优化
在10 mL具塞刻度试管中先加入0.5 mL 50 mg/L没食子酸溶液,再加入2.5mL 0.1mol/L Folin-Ciocaltou试剂,然后加入2 mL 7.5%的Na2CO3振荡混匀,分别在室温(20℃)、25、30、40℃下,分别反应 15、30、60、120、180 min后在765 nm下测定吸光度值。
2 结果与分析
2.1 Folin-Ciocalteu法测定条件的优化
采用Folin-Ciocaltou试剂法测定总多酚,其原理是酚酸类化合物分子上有极易氧化的羟基,Folin-Ciocalteu试剂中的钨钼酸可以将其氧化,自身被还原,在碱性条件下生成蓝色化合物。颜色的深浅与酚酸含量呈正比,此反应在一定条件下遵从Lambert-Beer定律,可测定酚酸总量[11-12]。
Na2CO3控制着反应体系的酸碱环境及蓝色物质的生成,不同浓度的Na2CO3可能会影响体系的反应颜色,因此有必要对反应体系中Na2CO3的添加量进行研究。此外,对Folin-Ciocalteu法测定黑莓样品液中多酚含量条件的优化中,主要从影响显色反应的4个因素:显色剂的用量、溶液的酸度、显色温度、显色时间方面进行优化。
2.1.1 最佳检测波长的测定
按照1.3.4.1的方法测定没食子酸标准溶液与处理黑莓样品液在400 nm~900 nm波长范围内进行全波长扫描得图1、图2。
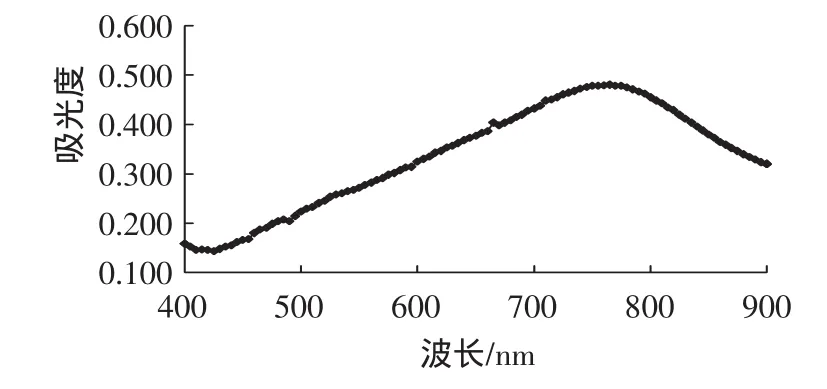
图1 没食子酸标准液加显色剂显色后全波长扫描谱Fig.1 The wavelength scanogram of Gallic acid after colorable reaction

图2 黑莓样品液加显色剂显色后全波长扫描图Fig.2 The wavelength scanogram of blackberry sample after colorable reaction
由图可知:没食子酸对照品溶液和黑莓样品溶液与Folin-Ciocalteu试剂反应显色全波长扫描结果显示在700 nm~770 nm之间均有明显的吸收峰,因此采用没食子酸标准溶液的最大吸收波长765nm作为黑莓样品液的最佳检测波长。
2.1.2 试剂浓度的优化
按照1.3.4.2方法对Folin-Ciocaltou试剂浓度进行优化的试验结果表明:显色反应2 h后各反应液的吸光度随着Folin-Ciocaltou浓度的不同存在差异,当Folin-Ciocaltou浓度大于等于0.1 mol/L时吸光度为0.400左右,此时反应体系的显色反应较充分且趋于稳定,根据测定总多酚的原理可知,黑莓样品液中的酚酸类化合物分子上有极易氧化的羟基已完全被氧化,生成蓝色化合物。因此在利用Folin-Ciocalteu法测定黑莓样品液时本着节约的原则选择Folin-Ciocaltou试剂浓度为0.1 mol/L。
对在不同浓度Na2CO3溶液下进行反应所测定的吸光度进行单因素方差分析结果表明:5%、7.5%Na2CO3的反应体系中所测定的吸光度无明显差异,然而10%、15%Na2CO3反应系所测吸光度与5%、7.5%Na2CO3反应体系所测的吸光度有明显的差异且当Na2CO3浓度为7.5%时可测得最大吸光度,说明7.5%Na2CO3可提供显色反应所需的最适pH,故选择Na2CO37.5%作为最佳浓度。
通过不同Folin-Ciocaltou试剂浓度与不同Na2CO3溶液浓度的两因素正交试验结果分析可知:0.08 mol/L Folin-Ciocaltou试剂浓度与5%与7.5%碳酸钠进行组合所测吸光度无显著差异,但与10%、15%Na2CO3组合所测定的吸光度有显著的差异。此外,0.1 mol/L Folin-Ciocaltou试剂与0.08 mol/L Folin-Ciocaltou试剂时与各浓度碳酸钠之间的组合所测定的吸光度值无显著的差异性,故从Folin-Ciocaltou试剂量的量取及实验误差角度考虑,最终选2.5 mL 0.1 mol/L Folin-Ciocaltou试剂与2 mL 7.5%碳酸钠为最佳组合,作为Folin-Ciocalteu法测定总多酚含量的试剂用量的选择。
2.1.3 显色温度与显色时间的优化
按照1.3.4.3的方法对Folin-Ciocalteu法的显色温度与显色时间优化,结果如图3所示。
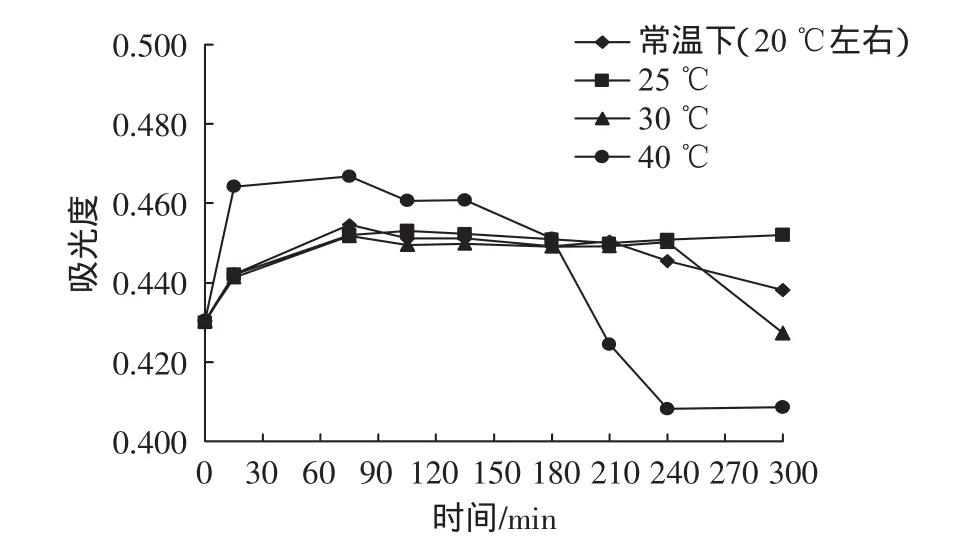
图3 不同温度下没食子酸溶液加显色剂后显色不同时间所测定的吸光度Fig.3 The optical densities of the Gallic acid solution after colorable reaction in different temperatures and time
试验结果表明,在不同的温度下,多酚与显色剂在45 min内吸光度增大,显色反应迅速,反应液的颜色变蓝且蓝色逐渐加深,在45 min以后吸光度的值趋于稳定,且在随后的4 h甚至更长时间保持稳定。为保证反应完全,将显色反应时间定为120 min,由图3可知显色反应温度对显色效果也有一定的影响,在相对低温的条件下,显色反应缓慢,吸光度小,但随着温度升高,多酚与显色剂充分反应所需的时间缩短,吸光度也有增加,但是反应体系在40℃中并不能较长时间的保持稳定性,随着时间延长,反应体系颜色变浅,吸光度下降。这表明生成的蓝色物质在高温下不稳定,容易分解褪色。此结果与何莎莉[13]的研究结果一致。此外由图3可知,多酚与显色剂在25℃下的反应完成后稳定性最好,从节约实验室资源的角度考虑可将Folin-Ciocalteu法测定黑莓样品液的温度确定为25℃,避光反应120 min在765 nm处测定吸光度,以计算黑莓样品液中总多酚的含量。
2.2 Folin-Ciocaltou比色方法的评价
2.2.1 标准曲线的绘制
按照1.3.3.2的方法绘制标准曲线如图4所示。
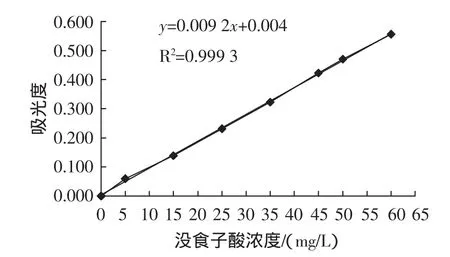
图4 没食子酸的标准曲线Fig.4 Standard curve of gallic acid
由图4可知,回归方程为Y=0.0092X+0.004,相关系数R2为0.9993,结果表明:没食子酸浓度在0~60 mg/L范围内与吸光度存在较好的线性关系。通过回归方程、稀释倍数及测得的吸光度可计算出样品液的浓度,进一步计算出不同黑莓样品中的多酚含量。
2.2.2 稳定性试验
按照Folin-Ciocaltou法对黑莓样品液中的显色反应进行稳定性试验,于25℃反应分别放置0、0.5、1、1.5、2、3、4、5、6、7 h 隔时测定其吸光度分别为 0.104、0.106、0.107、0.107、0.110、0.110、0.113、0.114,相对标准偏差(RSD)为0.352%,表明该方法在7 h内有较好的稳定性。
2.2.3 重复性试验
按照Folin-Ciocaltou法对4份不同的黑莓样品液的总多酚含量进行显色反应重现性,4份样品液中所测得的黑莓果中总多酚的含量为2.699、2.676、2.690、2.677 mg/g,其相对标准偏差RSD为1.124%,说明该方法在测定黑莓处理液具有较好的重现性。
2.2.4 精密度实验
按照Folin-Ciocaltou法对同一黑莓处理样品液进行6次总多酚含量的测定,根据所测定的分光光度值计算样品中总多酚的含量的结果为2.659、2.636、2.661、2.663、2.661、2.663 mg/g,相对标准偏差 RSD 为1.051%,说明此方法具有很高的精密度,能够达到样品分析要求。
2.2.5 黑莓中多酚含量的测定
黑莓中多酚含量的测定如表1。
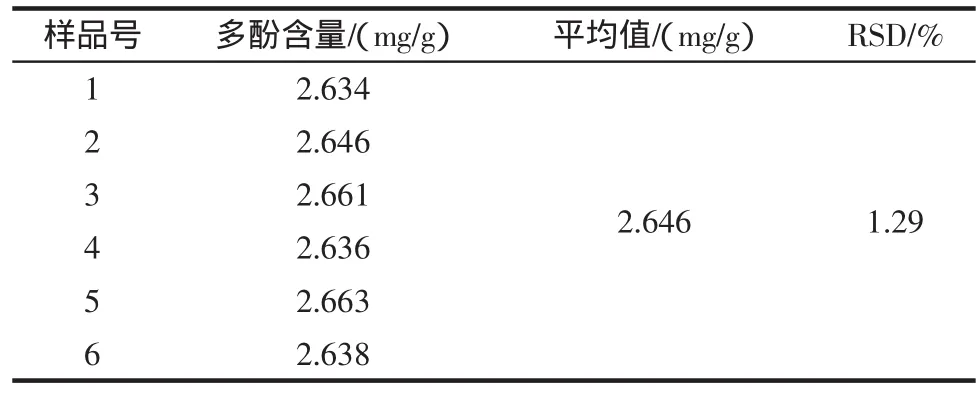
表1 黑莓中多酚含量的测定结果Table 1 The result about the content of polyphenol in blackberry
取黑莓冻果,按照方法1.3.1、1.3.2制备黑莓样品溶液,将样品溶液稀释5倍后,按照1.3.4所述方法测定吸光度,按照下面的公式计算黑莓中多酚的含量:
TP(mg/g)=C×V/(1000×m)×100%
式中:V为黑莓样品液的总体积;C是由吸光度根据回归方程计算出稀释后黑莓样品液中的多酚的浓度,(mg/L);m为称取的黑莓匀浆4.000 g,由此,计算出黑莓果实中多酚的平均含量及RSD分别为2.646 mg/g,1.29%。
2.2.6 加样回收试验[14]
在黑莓的样品液中分别加入不同量的没食子酸标准溶液,分别测定其总多酚的含量,并计算其回收率。

按照测定黑莓中多酚的方法进行测定黑莓样品处理液的加标回收试验,由表可知,5次加标回收试验的最低回收率为98.5%,最高回收率为101.8%,平均回收率为100.2%,其相对标准偏差RSD为1.40%。表明该方法准确可靠,此法可用来对黑莓处理样品液进行总多酚含量检测。
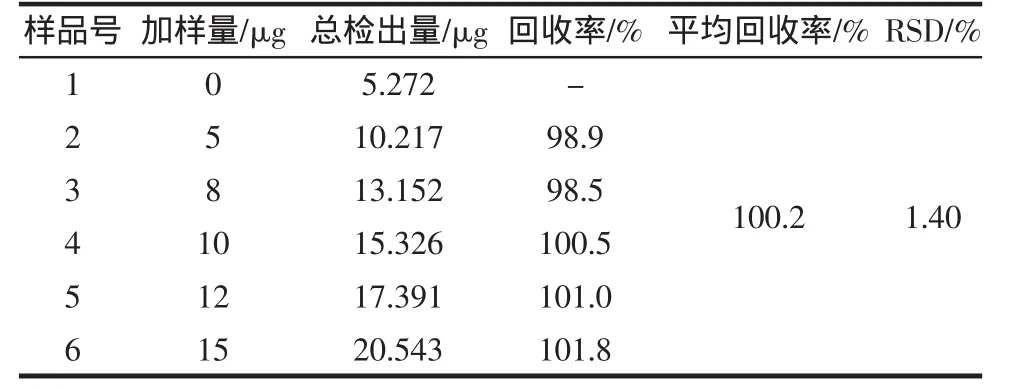
表2 没食子酸添加样回收试验结果Table 2 Result of gallic acid recovery experimentation in blackberry sample
3 结论
以没食子酸为标准对照品的Folin-Ciocalteu法测定黑莓果实多酚含量的最佳条件为:在5 mL的反应体系中,加入0.5 mL样品液,2.5 mL 0.1 mol/L的Folin-Ciocaltou试剂,2 mL 7.5%的Na2CO3溶液,显色温度25℃,反应时间120 min,检测波长为765 nm。在此条件下,没食子酸浓度在0~60 mg/L范围内与吸光度存在较好的线性关系。
利用优化后Folin-Ciocaltou方法测得Boysen品种黑莓冻果的总酚含量为2.646 mg/g(RSD为1.29%)。在加样回收试验中,没食子酸的平均回收率为100.2%(RSD为1.40%)。
此总多酚含量的检测方法具有操作过程简单、便捷、灵敏度高、稳定性好、精密度高、准确可靠等优点,建立的测定黑莓果实总多酚含量的Folin-Ciocalteu法的最佳条件,为测定黑莓果实总多酚含量的测定提供了可靠的方法,同时也为高效开发利用黑莓资源提供参考。
[1]吴文龙,顾姻.新经济植物黑莓的引种[J].植物资源与环境学报,1994,3(3):45-48
[2]Tate P,God J,Bibb R,et al.Inhibition of metalloproteinase activity by fruit extracts[J].Cancer letters,2004,212:153-158
[3]Seeram N P,Momin R A,Nair M G,et al.Cyclooxygenase inhibitory and antioxidant cyaniding glycosides in cherries and berries[J].Phytomedicine,2001,8(5):362-369
[4]Boateng J,Verghese M,Shackelford L,et al.Selected fruits reduce azoxymethane(AOM)-induced aberrant crypt foci(ACF)in Fisher 344malerats[J].Food and chemical toxicology,2007,45:725-732
[5]Elisia I,Hu C,Popovich D G,et al.Antioxidant assessment of an anthocyanin-enriched blackberry extract[J].Food chemistry,2007,101:1052-1058
[6]Sellappan S,Casimir C Akhon,Krewer G.Phenolic Compounds and Antioxidant Capacity of Georgia-Grown Blueberries and Blackberries[J].Agricultural food chemistry,2002,50:2432-2438
[7]徐宝才,肖刚,丁霄霖.苦荞中酚酸和原花色素的分析测定[J].食品与发酵工业,2002,28(12):32-37
[8]王岚,方瑞斌,李忠,等.固相萃取-高效液相色谱法测定烟草样品中主要的植物多酚[J].色谱,2001,19(6):564-566
[9]Singleton,V L,Rossi J A.Colorimetry of total phenolics with phos-phomolybdic-phosphotungstic acid reagents[J].American journal of enology and viticulture,1965,16:144-158
[10]李静,聂继云,李海飞,等.Folin-酚法测定水果及其制品中总多酚含量的条件[J].果树学报,2008,25(1):126-131
[11]吴萼,徐宁,温美娟.磷钼酸-磷钨酸盐比色法测定土壤中总酚酸含量[J].环境化学,2000,19(1):67-72
[12]Maria T.Phenolic compounds and stability of virgin olive oil PartI[J].Food Chem,1992,45:141-144
[13]何莎莉,王钫.Folin-Ciocalteu比色法测定保健品中多酚总量[J].分析化学,2009,37(zL):1025
[14]杨磊,隋小宇,祖元刚,等.Folin-Ciocalte法测定迷迭香中总酚酸含量[J].中成药,2009,39(2):272-275
