基于Plackett-Burman设计的刺糖多孢菌培养条件优化
2012-12-03沈秀军黄训端
沈秀军,刘 柳,高 亮,黄训端
(安徽大学 生命科学学院,安徽 合肥230601)
多杀菌素是新型生物源农药,杀虫效果高度专一,能有效地控制鳞翅目、双翅目、缨翅目、鞘翅目和直翅目等作物害虫,对昆虫天敌、哺乳动物和水生生物低毒或无毒,可光降解或微生物分解,环境友好[1-7]。多杀菌素类农药通过美国环保局的注册和农业部有机农业使用认证准许,获得了美国“总统绿色化学品挑战奖”[1]。目前,世界上已有多个国家批准使用该类农药,我国多杀菌素类产品主要依赖进口。
刺糖多孢菌(Saccharopolyspora spinosa)是多杀菌素的生产菌。为加快多杀菌素的开发利用,科技人员主要做了两方面工作:第一是刺糖多孢菌菌株选育,主要侧重于多杀菌素的高产性、稳定性等方面[8];第二是刺糖多孢菌生长特性及发酵技术研究,优化与研究刺糖多孢菌培养条件,是提高发酵水平的重要途径。国内外学者相继开展了大量发酵研究工作[9-11],但刺糖多孢菌为好氧生物,培养过程复杂,影响因素多,条件参数可重复性差,需进一步优化处理。
实验优化方法较多,Plackett-Burman设计是最具优势的方法之一。Plackett-Burman设计针对因子数较多、不能判定各个因子作用情况下,选取若干影响因子,通过分析各因子两水平的差异与整体的差异来确定因子的显著性,为优化实验提供依据。Plackett-Burman设计高效、实用,已广泛应用于生物学过程研究中[12-13]。本研究通过Plackett-Burman设计,优化刺糖多孢菌培养条件,为进一步提高多杀菌素产量奠定基础。
1 材料与方法
1.1 材料
刺糖多孢菌,本实验室保藏菌种。
1.2 仪器设备
全温培养摇床,上海新苗医疗器械制造有限公司;超净工作台(SCV-4A1),新加坡ESCO公司;电热恒温鼓风干燥箱,上海精宏实验设备有限公司;立式压力蒸汽灭菌器,上海申安医疗器械厂;离心机;电子分析天平。
1.3 培养基
种子 培 养 基 (g/L):可 溶 淀 粉 20.0,葡 萄 糖10.0,牛肉膏蛋白胨30.0,酵母提取物3.0,MgSO4·7H2O 2.0,KH2PO41.0。发酵培养基(g/L):葡萄糖40.0,牛肉膏蛋白胨 15.0,NaCl 3.0,KH2PO41.0,MgSO4·7H2O 2.0。以上培养基配好后,于121℃湿热灭菌30min,备用。
1.4 培养方法
种子培养方法:将刺糖多孢菌从斜面取适量接种到种子培养基中,30℃条件下,摇床转速240r/min培养至一定菌液浓度,备用。摇瓶发酵培养方法:在装有培养基的250mL三角瓶中,按一定比例接种菌种,在一定温度条件下振荡培养一定时间,测定其生物量。
1.5 生物量测定
采用菌体干重测定法。取10mL培养液于离心管中,3 500r/min离心15min,弃去上清液,将菌体置于105℃下干燥至恒重,称量计算刺糖多孢菌生物量。
1.6 实验设计方法
1.6.1 单因素实验
刺糖多孢菌发酵实验在250mL三角瓶中进行,由于影响微生物生长因素很多,在前期研究的基础上,选择培养基初始pH值、接种量、玻璃珠数、温度、装液量、转速、时间等7个因素,考查各因素对生物量的影响。各种因子设置梯度为:初始pH值分别为6.0、6.5、7.0、7.5、8.0;接种量0.5%、1%、2%、3%、4%;玻璃珠个数1个、5个、10个、15个、20个;温度24℃、26℃、28℃、30℃、32℃、34℃;装液量20 mL、30mL、40mL、50mL;转速160r/min、200r/min、240r/min、280r/min、320r/min;时间为36h、48h、60h、72h、84h、96h、108h、120h、132h、144 h、156h、168h。
1.6.2 Plackett-Burman实验设计
对初始pH值、接种量、玻璃珠数、培养温度、装液量、转速、时间等7因子分别编码(表1),为满足实验误差分析需要,设置4个因子虚拟项,每个因子设置2个水平,高水平赋值为1,低水平赋-1,实验以刺糖多孢菌生物量为响应值(Y),采用 Design Expert软件进行实验设计(表2),共12组实验。

表1 实验因素水平及编码代码
1.7 数据处理
以Design Expert(version 8.0.7.1)为工具,进行数据分析。
2 结果与分析
2.1 培养基初始pH值对刺糖多孢菌生物量的影响
每种微生物有其适宜的pH范围,培养基初始pH值是接种后微生物生长繁殖的重要环境因子,影响微生物的生物量。刺糖多孢菌的生长与初始pH值关系见图1。从图1显示刺糖多孢菌在初始pH值6.5~7.5的范围内能较好生长,在初始pH值为7时,生物量最大,达到8.23g/L。

图1 初始pH值与刺糖多孢菌生物量的关系
2.2 接种量对刺糖多孢菌生物量的影响
将刺糖多孢菌在种子培养基中培养至菌液浓度为1×108CFU/mL,按比例接入发酵培养基,接种量对多杀菌素生产菌生物量的产生了影响(图2),随接种量的增加,生物量呈递增趋势,但随着接种量的进一步增大,生物量下降。接种量大小与菌株在发酵过程中的生长繁殖速度有关。但是过大的接种量往往使菌体生长过快、过稠,造成营养基质缺乏或溶解氧不足而不利于发酵;接种量过小,则会引起发酵前期菌体生长缓慢,使发酵周期延长,还可能产生菌丝团,导致发酵异常等。图2表明,接种量在1%~4%之间较为适宜,以2%为最佳。

图2 接种量与刺糖多孢菌生物量的关系
2.3 添加玻璃珠个数对刺糖多孢菌生物量的影响
在培养基中添加玻璃珠,具有维持液体培养基溶氧和分散菌体的作用。由图3可知,在250mL三角瓶中,玻璃珠数量在5~20个范围内较为合适,其中以15个最佳,玻璃珠数量过多时,虽然溶氧条件改善,但液体的剪切力最加,有可能引起菌体损伤,或细胞死亡。

图3 添加玻璃珠数量与刺糖多孢菌生物量的关系
2.4 温度对对刺糖多孢菌生物量的影响
培养温度是微生物生长繁殖的关键环境因子。图4表明刺糖多孢菌生物量与培养温度呈先增后降的变化规律。当培养温度小于30℃时,温度与生物量呈同向递增的关系;大于30℃,温度与生物量呈反向递减关系。刺糖多孢菌的最适宜温度为30℃。

图4 培养温度与刺糖多孢菌生物量的关系
2.5 摇瓶装液量对刺糖多孢菌生物量的影响
摇瓶装液量与微生物生长中需氧量、微生物分散度都有一定关系。在250mL三角瓶中,摇瓶装液量对多杀菌素生产菌生物量的影响见图5。从图5可以看出,30mL时生物量最大,当装液量大于30时,随着装液量的增加,发酵单位呈显著下降趋势。

图5 摇瓶装液量与刺糖多孢菌生物量的关系
2.6 摇瓶转速对刺糖多孢菌生物量的影响
振荡培养也与液态培养基溶氧、菌体分散、振荡剪切力有关。在250mL三角瓶中,考查了转速范围160~320r/min,对多杀菌素生产菌生物量的影响(图6)。结果表明在200~320r/min转速条件下,生长良好,其中以240r/min最佳。

图6 摇瓶转速与刺糖多孢菌生物量的关系
2.7 培养时间对刺糖多孢菌生物量的影响
培养时间与刺糖多孢菌生物量关系密切(图7),在培养时间72~156h范围内菌体生物量较大,其中培养时间96~120h生物量最大。图7也反映了该菌的生长特性,培养时间在36~84h时处于对数期,生长迅速;84~144h时处于稳定期;144h以后进入衰亡期。

图7 培养时间与多杀菌素生产菌生物量的关系
2.8 刺糖多孢菌培养条件Plackett-Burman分析与优化
根据Plackett-Burman设计要求,开展了12组实验,通过摇瓶实验、生物量的测量,获得了实验响应值Y,实验设计及结果见表2。从响应值来看,刺糖多孢菌生物量范围从5.90g/L到8.98g/L,不同实验条件下,响应值存在差异。
在Design Expert软件辅助下,对Plackett-Burman实验结果进行分析,回归模型方差分析见表3。表3表明,回归模型的P值小于0.01,模型极显著,模型的决定系数R2为0.9767,调整决定系数R2为0.9359,说明回归模型可以解释93.59%的响应值变化,模型的拟合度高。系数显著检验结果显示,初始pH 值(x1)、培养温度(x5)、装液量(x7)、转速(x8),达到极显著或显著水平。

表2 Plackett-Burman实验设计与结果
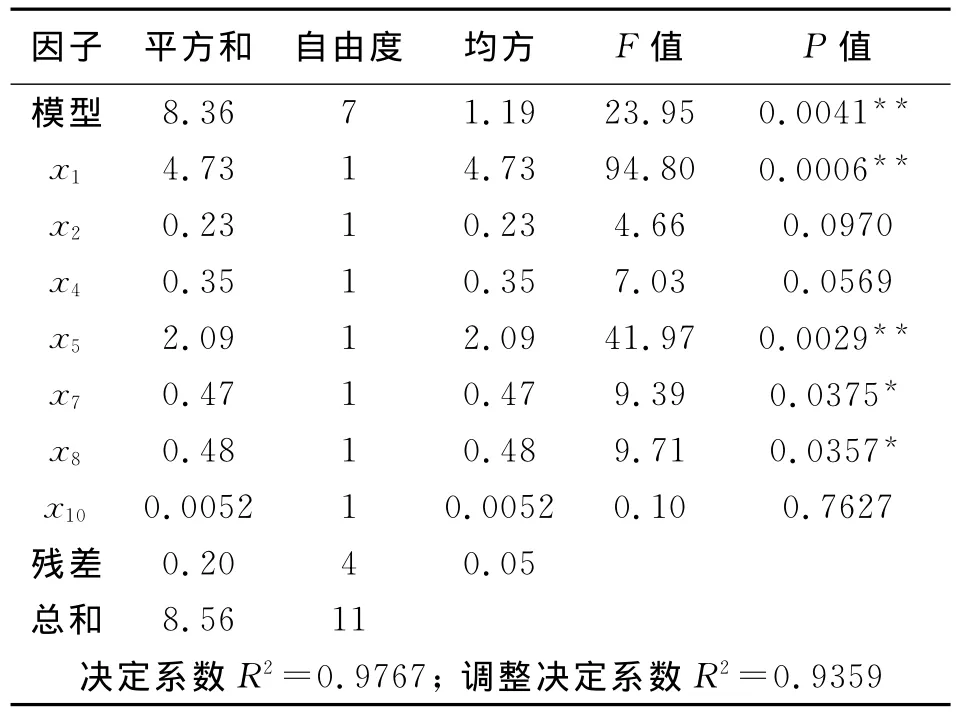
表3 回归模型方差分析表
回归系数估计及因子贡献率见表4。在本实验设计条件下,7个因子的重要性排序为:初始pH值、培养温度、摇瓶转速、摇瓶装液量、玻璃珠数、接种量、时间。从贡献度来分析,前4个因子对响应值的影响贡献率总和达90.8%,其中初始pH值贡献率为55.23%、培养温度为24.45%,两者为重中之重。由此,可以确定初始pH值、培养温度、摇瓶转速、摇瓶装液量为刺糖多孢菌发酵条件的注效因子。
根据表4,建立回归方程:Y=7.73-0.63x1-0.14x2+0.17x4+0.42x5-0.20x7+0.20x8+0.021x10。为重点考虑主效因子的作用,将回归模型修正 为:Y =7.73-0.63x1+0.42x5-0.20x7+0.20x8。利用该模型,预测刺糖多孢菌的最大生物量可达9.18g/L。

表4 回归系数估计及因子贡献率分析
3 结论
在单因子实验基础上,通过Plackett-Burman实验设计,建立刺糖多孢菌生物量回归模型:Y=7.73-0.63x1+0.42x5-0.20x7+0.20x8,模型显著,快速筛选出初始pH值、培养温度、摇瓶转速、摇瓶装液量为显著性影响因子,4因子对响应值变化的影响达90.8%,为进一步开发刺糖多孢菌发酵技术提供了参考。
[1]向双云,周珍辉,马建民,等.新型生物农药——多杀菌素[J].现代生物医学进展,2008,8(9):1750-1752.
[2]Thompson G D,Robert D,Sparks T C.Spinosad— a case study:an example from a natural products discovery programme [J].Pest Management Science,2000,(8):696-702.
[3]De Deken R,Speybroeck N,Gillain G,et al.The macrocyclic lactone“spinosad”,apromising insecticide for tsetse fly control[J].J Med Entomol,2004,41(5):814-818.
[4]Bhadriraju S,Michael D,Klein E,et al.Evaluation of spinosad as a grain protectant on three Kansas farms[J].Crop Protection,2007,26(7):1021-1030.
[5]Mayes MA,Thompson GD,Husband B,et al.Spinosad toxicity to pollinators and associated risk[J].Rev Environ Contam Toxicol,2003,(179):37-71.
[6]Steven P.Arthurs,Lawrence A.Lacey,et al.Evaluation of the codling moth granulovirus and spinosad for codling moth control and impact on non-target species in pear orchards[J].Biological Control,2007,41(1):99-109.
[7]Shangzhong Liu,Qing X Li.Photolysis of spinosyns in seawater,stream water and various aqueous solutions[J].Chemosphere,2004,56(11):1121-1127
[8]陈继红,张利平,郭立格.多杀菌素产生菌株航天育种效果研 究 [J].安徽 农 业 科 学,2008,36(12):4951-4952,4957.
[9]王能强,黎小军.刺糖菌素发酵工艺条件研究[J].湖南科技大学学报,2011,26(4):112-116.
[10]李丽,罗莉斯,王艳萍等.刺糖多孢菌生长特性及培养条件的优化[J].中国粮油学报,2010,25(11):89-93.
[11]张竞立,钱曙光,廖美德,等.刺糖多孢菌分批发酵动力学研究[J].华南农业大学学报,2006,27(3):51-54.
[12]Iuliana Oita,Hadewych Halewyck,Sigrid Pieters,et al.Improving the capillary electrophoretic analysis of poliovirus using a Plackett-Burman design [J].Journal of Pharmaceutical and Biomedical Analysis,2009,50(4):655-663.
[13]Rafaat M.Elsanhoty,I.Al-Turki,et al.Screening of medium components by Plackett-Burman design for carotenoid production using date(Phoenix dactylifera)wastes[J].Industrial Crops and Products,2012,36(1):313-320.
