肝脏特异HPPCn转基因小鼠的建立及表型分析
2012-12-01文川赛岩白纪民刘勇常菁王智崔春萍
文川,赛岩,白纪民,刘勇,常菁,王智,崔春萍
原发性肝癌(primary hepatic carcinoma,PHC)是居全球第 5 位的常见肿瘤,是严重危害人类健康的重大疾病[1]。近年来研究表明,原发性肝癌发病率呈上升趋势,2010年数据显示我国每年死于肝癌的人数约 34.4万人,占全世界肝癌死亡人数的55%。肝癌切除后易复发,对化疗药物不敏感,缺乏有效的系统治疗策略,且在治疗过程中容易产生耐药和复发,导致治疗失败。因此,深入研究肝癌发病机制并发展新的治疗策略是关系人类健康的重大科学问题。
HPPCn(Hepatopoietin Cn)是本室从新生小牛肝脏中分离得到的一种新型肝细胞刺激因子[2],在肝癌细胞中呈高表达,在肝癌患者的癌组织和血清中表达呈阳性。前期研究发现 HPPCn能够特异促进肝细胞的DNA 合成和肝脏再生。为了进一步对HPPCn的功能进行研究,我们构建了携带小鼠白蛋白启动子(Alb promoter)和增强子序列的HPPCn肝脏特异性表达载体,并获得了肝脏高表达HPPCn的转基因鼠,为研究 HPPCn 在肝癌发生过程中的功能奠定基础。
1 材料和方法
1.1 材料
1.1.1 实验动物 4周龄 SPF 级 FVB/N 小鼠,军事医学科学院实验动物中心提供。所有实验用小鼠均在SPF 级动物房饲养和繁殖。温度控制在22 ℃,湿度 70 %,自动光控(12 h 明/12 h 暗),自由采食和饮水。
1.1.2 主要试剂 Taq DNA 聚合酶、dNTPs、DL2000、Xhol I、Not I、BamH I、Pst I 购自中国宝生物工程(大连)有限公司;DNA 回收试剂盒、质粒提取试剂盒购自美国 Qiagen公司;T4DNA连接酶、荧光定量 PCR 反应 Mix、反转录试剂盒购自北京全式金生物技术有限公司;PVDF 杂交膜购自美国 Amersham公司;Hybond+尼龙膜购自美国 Millipore公司;抗 HPPCn 单克隆抗体由本实验室自制;地高辛标记试剂盒购自美国罗氏公司;TRIzol 试剂购自美国 Invitrogen公司;基因组提取试剂盒购自天根生化科技(北京)有限公司;所有引物均由北京奥科鼎盛生物科技有限公司合成。
1.2 方法
1.2.1 携带 HPPCn 重组质粒的构建及转基因小鼠的制备 将 pGEX 载体中的CMV 启动子替换为A1bumin 启动子和增强子序列。该质粒是在限制性内切酶 Xho I、Not I 之间插入了带有 7个组氨酸标签的HPPCn,即为重组质粒 pGEM-A1b/his-HPPCn。采用质粒的PCR和酶切鉴定 750 bp目的HPPCn 条带。重组质粒 pGEM-A1b/his-HPPCn 用限制性内切酶 Apa I和Mlu I 切除其中的原核细胞 DNA 片段部分,把可以在真核细胞中表达的大片段包括 A1bumin promoter,enhancer,his-HPPCn,SV40 PolyA 尾回收供注射,片段大小约为4 kb。将回收的线性化重组片段(3~5 ng/μl)显微注射到 FVB/N 小鼠的受精卵中[3],并将此受精卵植入假孕 FVB/N 母鼠输卵管中,制备首代转基因小鼠。将已鉴定的首代转基因小鼠与野生型FVB/N 鼠配种,对产生的子代鼠基因组进行 PCR鉴定。
1.2.2 PCR和Southern blot 鉴定转基因小鼠 小鼠出生后的第 10 天剪下 2~3 mm的鼠尾,提取小鼠基因组,PCR 法检测小鼠基因型。上游引物为:5' CAAATGGGAGACAAAGAG 3',下游引物为:5' AGATGCGTGAGGTTCG 3'。PCR 反应体系 20 μl,反应条件为:94 ℃ 预变性 5 min 后开始扩增循环,循环参数为94 ℃ 变性 30 s,58 ℃退火 30 s,72 ℃ 延伸 45 s,共 32个循环。目的基因 A1b-HPPCn 片段为650 bp。
PCR 阳性小鼠基因组10 μg 用 EcoR I 酶切2 h 后经 0.8% 琼脂糖凝胶电泳分离后转印至Hybond+尼龙膜,然后用 PCR 扩增重组质粒pGEM-A1b/his-HPPCn的650 bp 片段为探针,按高效 DNA 地高辛标记和检测试剂盒说明书进行Southern blot 检测。
1.2.3 Western blot 检测 His 标签和HPPCn的表达 提取转基因阳性小鼠和同窝阴性小鼠肝脏组织总蛋白,蛋白定量后,进行 SDS-PAGE 凝胶电泳(10% 浓度凝胶),蛋白经半干转印仪转移至PVDF 膜上,置于5% 脱脂牛奶中封闭,一抗用抗HPPCn 单克隆抗体、抗 His 标签抗体,二抗用山羊抗小鼠抗体检测 HPPCn蛋白和His-HPPCn蛋白表达。
1.2.4 Realtime-PCR 检测 HPPCn mRNA的表达 用 TRIzol 试剂提取转基因阳性小鼠和同窝阴性小鼠肝脏组织总 RNA,并以之为模板进行RT-PCR,以所得 cDNA 为模板进行 Realtime-PCR,HPPCn 上游引物为:5' ACGCCCTCTGATGT GAAA 3',下游引物为:5' TTCTGCCAATGCTTCC AC 3',GAPDH 上游引物为:5' GGATTTGGTCGTA TTGGG 3',下游引物为:5' TCGCTCCTGGAAGAT GG 3'。反应条件为:95 ℃ 预变性 5 min,95 ℃ 变性 15 s,58 ℃ 退火 15 s,72 ℃ 延伸 15 s,反应共 40个循环。反应结束统计 CT 值,查看溶解曲线图,以公式:相对表达量=1.5-△△ct统计结果。
1.2.5 组织学检测 选用 4 月龄左右的转基因阳性和同窝阴性小鼠,颈椎脱臼法处死小鼠,打开腹腔取出肝脏,将部分肝脏组织固定在福尔马林中48 h,进行脱水、包埋、切片,HE 染色。另取小块肝脏组织固定在2.5%的戊二醛溶液中,制成透射电镜切片。
2 结果
2.1 高表达 HPPCn 转基因小鼠的建立
限制性内切酶 XhoI、NotI 分别酶切 pGEM载体(图 1)和扩增的his-HPPCn 片段,将其连接转化后,提取质粒进行 PCR 鉴定(图 2)并对构建好的载体进行基因测序,证明 pGEM-Alb/his-HPPCn 载体构建是正确的。我们用 Apa I、Mlu I 对转基因表达载体进行酶切(图 3),目的是从转基因载体上切下目的基因的片段和肝脏特异表达所需的特异性的启动子和增强子。将所需的片段切下后回收供显微注射。PCR(图 4)和Southern blot(图 5)鉴定产生的小鼠基因组型,共产生 2只首建鼠,均可传代。现已成功繁殖到 F4 代,并未出现外源基因的丢失。
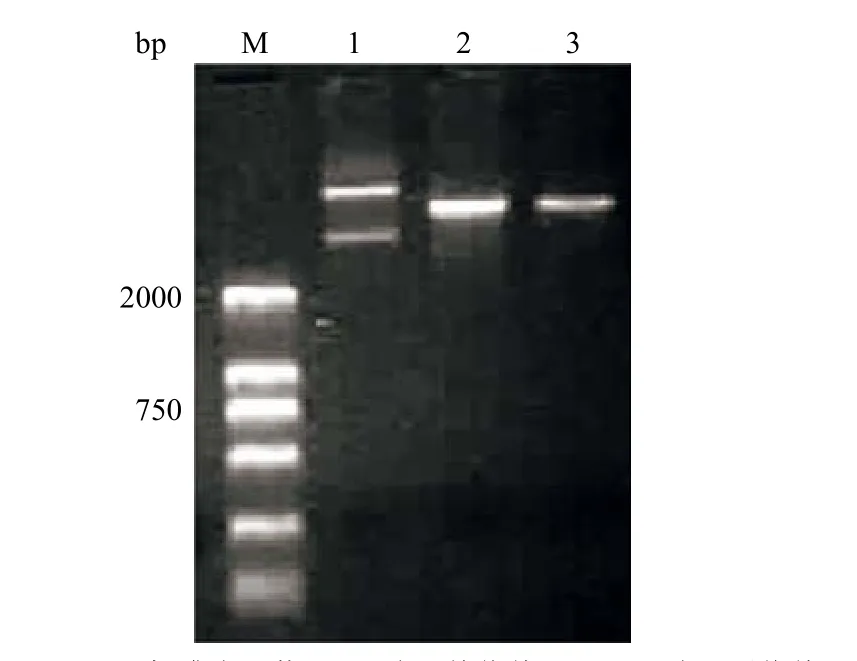
图1 载体的酶切Figure1 Identification of pGEM by restriction enzyme digestion

图2 目的片段的扩增Figure2 Identification of his-HPPCn fragment by PCR
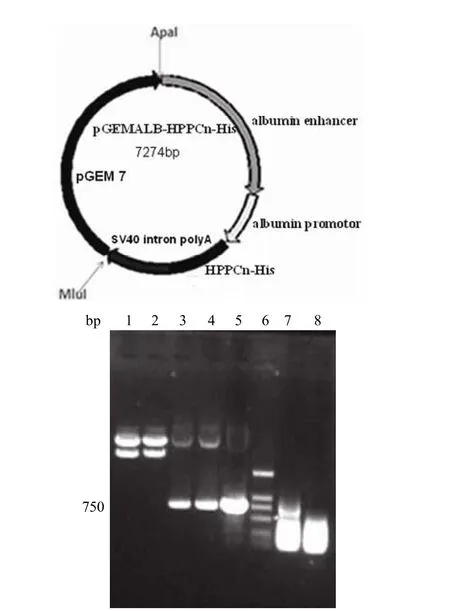
图3 注射用片段的鉴定Figure3 Identification of micro-injection fragment

图4 转基因小鼠 PCR 鉴定Figure4 Identification of transgenic mice by PCR

图5 转基因小鼠 Southern blot 鉴定Figure5 Identification of transgenic mice by Southern blot
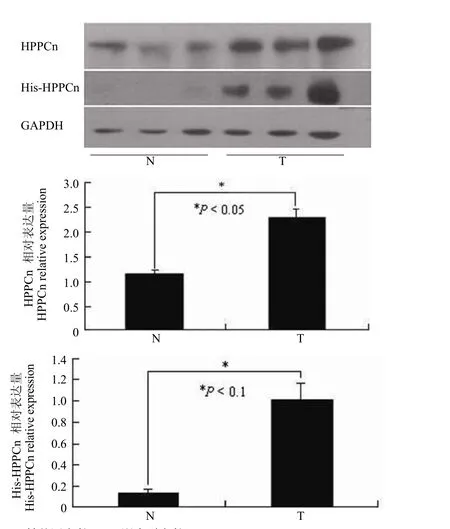
图6 HPPCn和His 标签在转基因阳性和阴性小鼠肝脏中的表达Figure6 The expression of HPPCn and His gene in liver tissues of wild type mice and transgenic mice
2.2 HPPCn 在转基因阳性和阴性小鼠肝脏中的表达
提取 4 月龄的转基因阳性和阴性小鼠肝脏组织总蛋白,Western blot 分析HPPCn和His 标签在肝脏组织的表达。结果显示,所检测蛋白均显著上调(图 6)。
提取 4 月龄的转基因阳性和阴性小鼠肝脏总RNA,Realtime-PCR 分析 HPPCn 基因的mRNA在肝脏中的表达。结果显示,在mRNA 水平上有显著上调(图 7)。
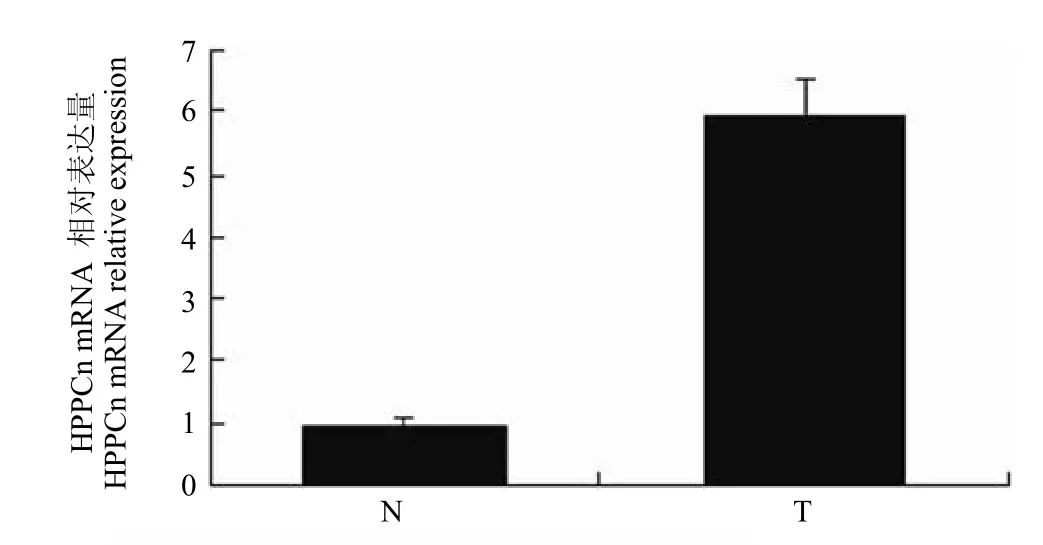
图7 HPPCn 在转基因阳性和阴性小鼠肝脏中 mRNA 水平表达Figure7 The expression of HPPCn mRNA in liver tissues of wild type mice and transgenic mice
2.3 高表达 HPPCn 转基因小鼠组织病理学检测
将 4 月龄的高表达 HPPCn 转基因阳性和阴性小鼠的肝脏和肺脏进行病理解剖,HE 染色和透射电镜观察。结果显示,转基因阳性和阴性的肝脏和肺脏细胞形态未发生明显变化,亚显微结构中转基因阳性小鼠肝脏线粒体发生明显空泡化并且线粒体数量增多(图 8)。
3 讨论
本实验中成功构建了肝脏高表达 HPPCn 转基因小鼠,在蛋白和分子水平上均显示 HPPCn 含量明显上调,为后期建立评价 HPPCn 在体内肝癌发生发展中的功能作用提供了有力工具。

图8 转基因阳性和阴性小鼠肝脏和肺脏组织切片 HE 染色和电镜观察Figure8 The sections of liver and lung tissues from the wild type mice and the transgenic mice were stained with HE and observed by TEM
本实验中,我们着重对比了导入外源基因后FVB/N 小鼠与野生型 FVB/N小鼠之间的表型变化。首先,在外观上,体型、毛发、体重等方面未发现明显不同。我们对肝脏切片做了 HE 染色,在细胞排列方式、细胞形状以及细胞核数量等方面进行比较,也未发现两种小鼠之间有明显的改变。并且,我们对两种小鼠血清中的丙氨酸氨基转移酶(ALT)含量进行了测定,其含量均在正常范围内。其次,我们对肝脏切片做了透射电镜观察细胞亚显微结构,结果显示,转基因小鼠肝脏细胞内的线粒体数量明显增多,有空泡化现象,这种结果可能会影响肝脏能量代谢。之后,对于这种现象我们对两种小鼠做了长时间的观察和对比,结果发现无论从运动状态、精神状况、饮食情况以及小鼠寿命等均未出现明显区别。最后,采用 Western blot和Q-PCR 检测两种小鼠肝脏内 HPPCn 表达水平时,我们发现在转基因小鼠体内 HPPCn能持续性的高于正常水平表达。
本实验采用的建模小鼠是 FVB/N 小鼠,FVB/N 小鼠是常用的转基因模型鼠,因为它的繁殖能力较强,生育的子代数量多,受精卵前核大而显著,易于外源 DNA的注射。我们设计的重组DNA 片段含有白蛋白增强子和白蛋白启动子以及具有 His 标签的HPPCn 片段。小鼠白蛋白主要在肝脏中表达,并在早期胚胎发育过程中开始表达[4]。其启动子包含 CAATbox和TATAbox 及肝细胞核因子(HNF1)结合域[5],在进化史上具有高度保守性[6]。构建含有 cDNA 序列与外源启动子结合的重组质粒以获得转基因目的片段是建立转基因小鼠的手段之一[7]。本室研究人员构建了 Alb 启动子启动的带有 His 标签的HPPCn 真核表达载体,并成功在体外对该载体肝脏表达的特异性进行了验证。进而我们将载体上的白蛋白增强子、启动子及目的基因片段切下后通过显微注射方式注射到受精卵原核中,再植入假孕母鼠的输卵管中,对产生的子代小鼠进行鉴定。
对于本实验中筛选转基因阳性鼠需要的PCR反应引物设计,考虑到 HPPCn的内源性基因,我们设计了可特异地检测转入片段的精确引物,并为了验证其准确性,我们把转入的片段用阴性小鼠基因组稀释 2万倍(按照一个重组片段在小鼠基因组中所占的比例)后仍然能扩增出目的片段,并以此稀释液作为阳性对照。转基因小鼠的鉴定至少需要两次剪尾,并 PCR 鉴定结果一致才能确定,避免有假阳性结果。
HPPCn是富含亮氨酸的酸性壳蛋白,属于LANP 家族,同属于LANP 家族的还包括 pp32、PHAPI、Mapmodulin、I1PP2A、APRIL、pp32r1和pp32r2等,这些蛋白都参与细胞的自我更新过程,并且在一些肿瘤组织中表达较高[8-9],HPPCn 在正常肝组织中表达量较低,经肝部分切除或诱发性肝损伤时,HPPCn的表达上调。体内、体外实验均表明 HPPCn能刺激肝细胞的增殖[10]。本实验是基于这些研究成果,从而构建了高表达 HPPCn 转基因鼠,期望对 HPPCn 在肝脏疾病中所发挥的作用做更深入的研究。
总之,本实验成功建立了肝脏特异 HPPCn 高表达转基因小鼠,为进一步研究 HPPCn的功能和作用机制提供了有力工具。
[1]Parkin DM, Bray F, Ferlay J, et al.Global cancerstatistics, 2002.CA Cancer J Clin, 2005, 55(2):74-108.
[2]Radiation of the PLA Military Academy of Medical Sciences and Institute of Radiation Medicine.Liver regeneration factor and its application: China, CN200610092321.2007-01-17.(in Chinese)中国人民解放军军事医学科学院放射与辐射医学研究所.肝再生因子及其应用: 中国, CN200610092321.2007-01-17.
[3]Gordan JW, Ruddle FH.Integration and stable germline transmission of genes injected into mouse pronuclei.Science, 1981, 214(4526):1244-1246.
[4]Park TJ, Kim JY, Oh SP, et al.TIS21 negatively regulates hepatocarcinogenesis by disruption of cyclin B1-Forkhead box M1 regulation loop.Hepatology, 2008, 47(5):1533-1543.
[5]Teoh NC, Dan YY, Swisshelm K, et al.Defective DNA strand break repair causes chromosomal instability and accelerates liver carcinogenesis in mice.Hepatology, 2008, 47(6):2078-2088.
[6]Zimmers TA, Jin X, Gutierrez JC, et al.Effect of in vivo loss of GDF-15 on hepatocellular carcinogenesis.J Cancer Res Clin Oncol,2008, 134(7):753-759.
[7]Waxman DJ, Azaroff L.Phenobarbital induction of cytochrome P-450 gene expression.Biochem J, 1992, 281(Pt 3):577-592.
[8]Kular RK, Cvetanovic M, Siferd S, et al.Neuronal differentiation is regulated by leucine-rich acidic nuclear protein (LANP), a member of the inhibitor of histone acetyltransferase complex.J Biol Chem, 2009,284(12):7783-7792.
[9]Kadkol SS, El Naga GA, Brody JR, et al.Expression of pp32 gene family members in breast cancer.Breast Cancer Res Treat, 2001,68(1):65-73.
[10]Cui CP, Zhang DJ, Shi BX, et al.Isolation and functional identification of a novel human hepatic growth factor: hepatopoietin Cn.Hepatology, 2008, 47(3):986-995.
