人胚胎主动脉血管内皮祖细胞的分离、培养及鉴定
2012-12-01庄乾淑张文健叶丽亚刘虹麟曹妍婷成兰云丁浩娄晋宁刘鹏李建中
庄乾淑,张文健,叶丽亚,刘虹麟,曹妍婷,成兰云,丁浩,娄晋宁,刘鹏,李建中
血管内皮祖细胞(endothelial progenitor cells,EPCs)是一类具有自我更新能力,并定向分化为成熟血管内皮细胞的前体细胞。近年的研究表明,外周血中存在一定数量的EPCs,其数量的减少是心血管疾病高发生率与高死亡率的一个独立预测因素[1-2]。EPCs 在血管损伤后的内皮细胞修复、防止动脉粥样斑块的形成中发挥重要的作用[3]。循环中的EPCs 在一定的条件下可向血管损伤区或缺血局部迁移,修复内皮细胞的损伤[4]并促进新生血管的形成和侧支循环的建立[5]。因此,EPCs 在心肌梗死、动脉粥样硬化和糖尿病血管并发症等疾病的防治作用中受到越来越多的关注。应用 EPCs 细胞修复血管内皮细胞的损伤或促进缺血区新生血管的形成可能成为未来干细胞临床治疗的一种新技术。然而,目前通过密度梯度离心法或免疫磁珠分选等方法从骨髓、外周血和脐血中分离获得的EPCs 非常有限[6-8],难以满足临床 EPCs 治疗的需要。因此,寻找和建立一种安全、高效的人源化EPCs的分离和培养方法,将为EPCs的临床治疗应用提供可能。
在人胚胎发育过程中,早期胚胎血管中存在大量尚未分化成熟的EPCs[9]。因此,本研究探索从人胚胎早期(14周内)的主动脉分离 EPCs,建立体外扩增 EPCs和诱导其分化成为血管内皮细胞的技术方法,为EPCs的临床治疗应用提供实验依据。
1 材料与方法
1.1 主要试剂和仪器
DMEM/F12 干粉培养基、明胶、I 型胶原酶和白血病抑制因子(leukemia inhibitory factor,LIF)均为美国 Sigma公司产品;干细胞专用血清购自德国 Biochrom公司;人表皮细胞生长因子(human epidermal growth factor,hEGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)和DiI 标记的乙酰化低密度脂蛋白(DiI-Ac-LDL)均为美国 Invitrogen公司产品;小鼠抗人 CD133 抗体、小鼠抗人 CD34 抗体均购自德国 Miltenyi Biotec公司;山羊抗人 VEGFR2 抗体购自美国R&D Systems公司;基质胶购自美国 BD公司;RNA 提取试剂盒、逆转录试剂盒均为美国Promega公司产品。
流式细胞仪为美国 BD公司产品;TSE100 倒置像差显微镜和荧光显微镜均购自日本 Nikon公司;AlphaImagerTM2200 凝胶成像系统购自美国Form公司。
1.2 方法
1.2.1 人胚胎主动脉 EPCs的分离与培养 人胚胎组织来源干细胞的分离和研究方案经卫生部中日友好医院医学伦理委员会审批,并且每个临床流产胚胎均获得患者签署的人胚胎组织捐赠知情同意书。流产 14周龄以内的胎儿在无菌条件下取主动脉,放入 DMEM/F12 培养液中,用镊子将主动脉血管内膜面翻转朝外,用动脉夹将血管两端夹闭,放置在5ml 0.2% I 型胶原酶溶液中,37 ℃ 水浴消化 20 min 后,将主动脉表面细胞吹打下来,用无血清培养基离心洗涤 2 次,细胞悬浮于含有 100μg/ml ECGS、10 ng/ml LIF、10 ng/ml bFGF、20 ng/ml EGF和5% 干细胞血清的DMEM/F12培养液中[10-11],接种于2% 明胶包被的T25 培养瓶中。细胞在37 ℃、5% CO2培养箱中培养,每3 天换液一次。细胞生长汇合后用 0.1% 胰蛋白酶/0.1% EDTA 溶液消化传代培养。3 代以内的EPCs 用于本实验研究。
1.2.2 人胚胎 EPCs的鉴定 以成人肾动脉内皮细胞(renal artery endothelial cells,RAEC)作为对照,通过检测 EPCs的CD133、CD34和VEGFR2的表达进行鉴定。
1.2.2.1 免疫组织化学染色 将人胚胎主动脉和成人肾动脉组织取材后用福尔马林溶液固定,然后制备石蜡切片。按照标准免疫组织化学染色技术进行人 CD133和vWF的染色。
1.2.2.2 逆转录聚合酶链反应 应用试剂盒进行细胞总 RNA的提取和逆转录。以 β-actin 作为内参照,应用 PCR 方法检测细胞 CD133、CD34和VEGFR2的表达。所使用的特异引物序列为:人β-actin 上游引物:5' CTCCATCCTGGCCTCGCTGT 3',下游引物:5' GCTGTCACCTTCACCGTTCC 3',产物长度 268 bp;人 CD133 上游引物:5' CAGAG TACAACGCCAAACCA 3',下游引物:5' AAATCAC GATGAGGGTCAGC 3',产物长度 245 bp;人 CD34上游引物:5' GCGCTTTGCTTGCTGAGTTT 3',下游引物:5' GCCATGTTGAGACACAGGGT 3',产物长度 183 bp;人 VEGFR2 上游引物:5' AACGT GTCACTTTGTGCAAGA 3',下游引物:5' TTCCAT GAGACGGACTCAGAA 3',产物长度 229 bp。PCR产物经 2% 琼脂糖凝胶电泳,用凝胶成像系统观察并分析结果。
1.2.2.3 细胞免疫荧光染色 将细胞接种到96 孔板,培养至 80% 汇合,4% 多聚甲醛室温固定 30 min,PBS 洗 3 次,0.1% BSA 封闭 15 min后,分别与鼠抗人 CD133(5μg/ml),鼠抗人 CD34(10μg/ml),羊抗人 VEGFR2(10μg/ml)的单克隆抗体 4 ℃ 孵育过夜;PBS 洗 3 次,加入兔抗鼠或驴抗羊的Alexa Fluor488 标记的二抗,室温孵育30 min;PBS 洗 3 次,加入 4,6-联脒-2-苯基吲哚(DAPI)1μg/ml 复染,荧光显微镜下观察并拍照。
1.2.2.4 流式细胞术 制备 EPCs 及RAEC 单细胞悬液,用 0.1% BSA 洗涤 2 次后,分别用鼠抗人 CD133、鼠抗人 CD34和羊抗人 VEGFR2的抗体作为一抗,以兔抗鼠或驴抗羊的Alexa Fluor488 标记的IgG 为二抗进行标记,标记后的细胞经离心洗涤 3 次后,悬浮于0.1% BSA 溶液中,用流式细胞仪检测细胞荧光强度。
1.2.3 EPCs的诱导分化 为诱导 EPCs 分化为成熟的内皮细胞,使用添加了 20% 胎牛血清、10 ng/ml血管内皮生长因子和100μg/ml ECGS的培养基培养 EPCs,每 3 天换液一次。培养 14 d后收集细胞,利用流式细胞仪分析诱导前后CD133、CD31 及vWF 表达情况和ELISA 方法检测 ELAM-1的表达变化。
1.2.4 ELISA 方法检测 ELAM-1的表达 将诱导前后细胞按照 1×104细胞/孔分别接种于96 孔板中,在37 ℃,5% CO2培养箱中培养至汇合状态。换成含人重组型 TNF-α(1000 U/ml)的培养基,培养 4 h 后,PBS 洗 2 次,将细胞用–20 ℃ 预冷的冰甲醇固定 10 min,PBS 洗 3 次,1% 过氧化氢封闭 10 min,PBS 洗 3 次,再用 5% FCS/0.05% BSA/0.05% Tween 20/PBS 封闭 15 min,PBS洗 3 次,加入 10μg/ml 鼠抗人-ELAM-1 单克隆抗体,室温孵育 1 h,PBS 洗4 次,加入 HRP 标记的兔抗鼠 IgG 二抗(1∶200 稀释),室温孵育30 min。PBS 洗 4 次,TMB 显色,2 mol/L H2SO4终止反应,于酶标仪 450 nm 检测吸光度值(OD值)。
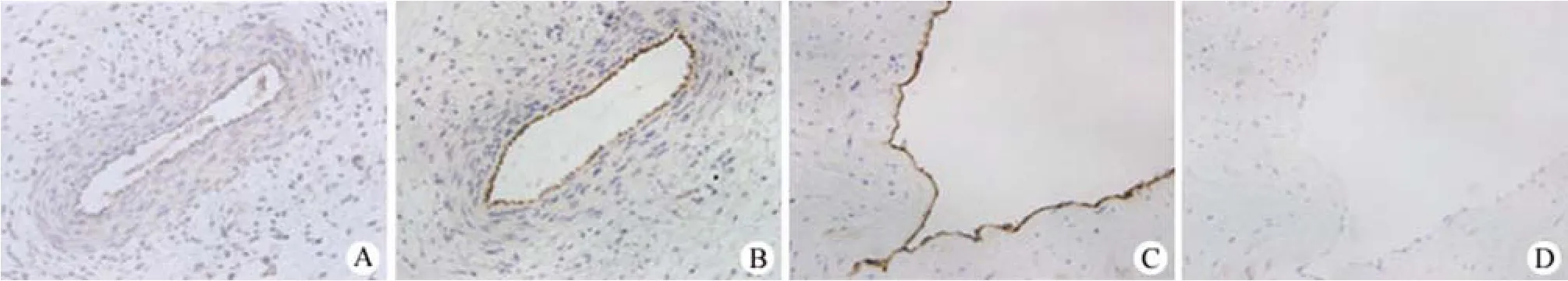
图1 免疫组织化学染色检测人胚胎主动脉上 CD133和vWF的表达(×200)Figure1 Immunohistochemistry staining for CD133 and vWF on human fetal aorta (×200)
1.2.5 EPCs 体外血管形成能力检测 将 EPCs接种于基质胶包被 96 孔板,置于37 ℃,5% CO2的培养箱中培养过夜,通过相差显微镜观察管样结构的形成情况。
1.2.6 摄取 DiI-Ac-LDL的检测 细胞按照 6×104细胞/孔种于24 孔板,培养 24 h 后,换成含有 DiI-Ac-LDL(10μg/ml)的培养液,37 ℃,5% CO2培养箱中培养过夜。PBS 洗涤后,荧光显微镜下观察细胞摄取 DiI-Ac-LDL的能力。
2 结果
2.1 免疫组织化学染色比较人胚胎主动脉上CD133和vWF的表达
免疫组织化学染色发现,小于14周龄的人胚胎主动脉内皮仅有少量细胞表达血管内皮细胞的标志 vWF(图 1A),而大多数细胞都表达 EPCs的特异标志 CD133(图 1B)。并且,随胚胎胎龄的增加,vWF 阳性细胞逐渐增多,而 CD133细胞逐渐减少,表明在小于14周龄的人胚胎主动脉内皮层中存在大量 EPCs。在成熟的人肾动脉上,vWF的表达为强阳性(图 1C),而 CD133的表达为阴性(图 1D)。
2.2 人胚胎主动脉 EPCs的分离和培养
原代分离的EPCs 培养 24 h 后,可见细胞克隆贴壁,并有细胞向外爬出(图2A)。培养 7 d 后细胞进入快速增殖阶段,细胞呈单层生长,具有接触抑制的特性(图 2B)。
2.3 人胚胎主动脉 EPCs的鉴定
RT-PCR(图 3A)及免疫荧光染色(图 3B)结果显示分离培养的细胞表达 EPCs的标志分子
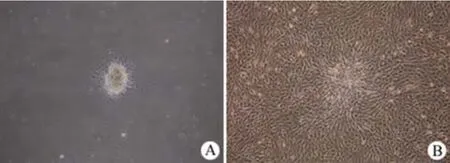
图2 EPCs的形态(倒置相差显微镜×200)Figure2 The morphology of human fetal EPCs cultured in vitro (Inverted phase contrast microscope×200)
CD133、CD34和VEGFR2,而成人肾动脉内皮细胞只表达 CD34和VEGFR2,不表达 CD133。进一步通过流式细胞术分析发现,培养第 2 代的EPCs 中 CD133 阳性细胞占 41.89%,CD34 阳性细胞占 73.03%,VEGFR2 阳性细胞占 50.63%,而成人肾动脉内皮细胞的CD133、CD34和VEGFR2阳性率分别为0.97%、76.89%和71.04%(图 3C)。这些结果证实所获得的细胞为内皮祖细胞。
2.4 EPCS 向血管内皮细胞的诱导分化
2.4.1 EPC 分化为内皮细胞的能力 给予VEGF 进行诱导培养 2周后,EPC 表面干细胞标志分子 CD133的表达转为阴性,表达内皮细胞标志性分子 vWF 及CD31的比例增高(图 4A,4B),并且 TNF 诱导的内皮细胞功能性分子ELAM-1 表达增强(图 4C),说明 EPC 分化为成熟内皮细胞。
2.4.2 形成血管样结构的能力 将 EPCs 接种到基质胶上后可形成血管样网络结构,但其形成的管样结构不成熟,表现为管腔小、管壁厚(图 5A)。应用 VEGF和血清进行诱导分化后,所形成的管样结构较为成熟(图 5B)。

图3 体外培养 EPCs的鉴定Figure3 Identification of EPCs by the expression of CD133, CD34 and VEGFR2
2.4.3 摄取 DiI-Ac-LDL的能力 EPCs 与DiIAc-LDL 共孵育后,在荧光显微镜下可见 EPCs 摄取的DiI-Ac-LDL 分布在胞浆,呈红色荧光,荧光阳性细胞比例大于90%(图 6A)。诱导分化后,细胞摄取 DiI-Ac-LDL的能力增强,表现为胞浆内的荧光强度增加(图 6B)。
3 讨论
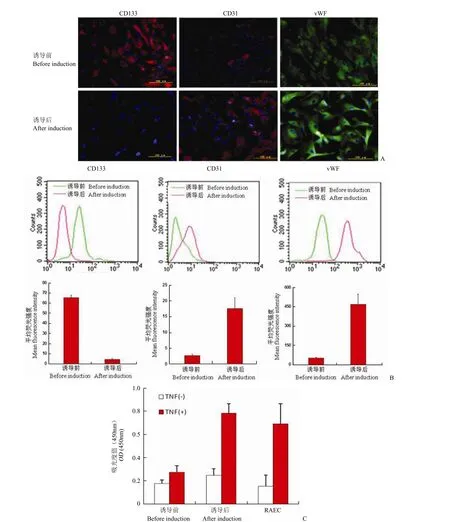
图4 EPCs 分化为成熟内皮细胞的检测Figure4 Differentiation of EPCs into endothelial cells upon induction by VEGF
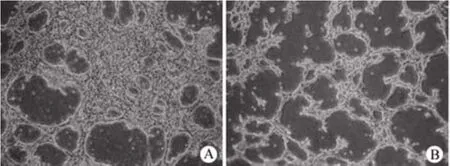
图5 VEGF 诱导前(A)后(B)EPCs 成管能力的检测Figure5 Evaluation of tube formation by EPCs before and after induction on matrigel
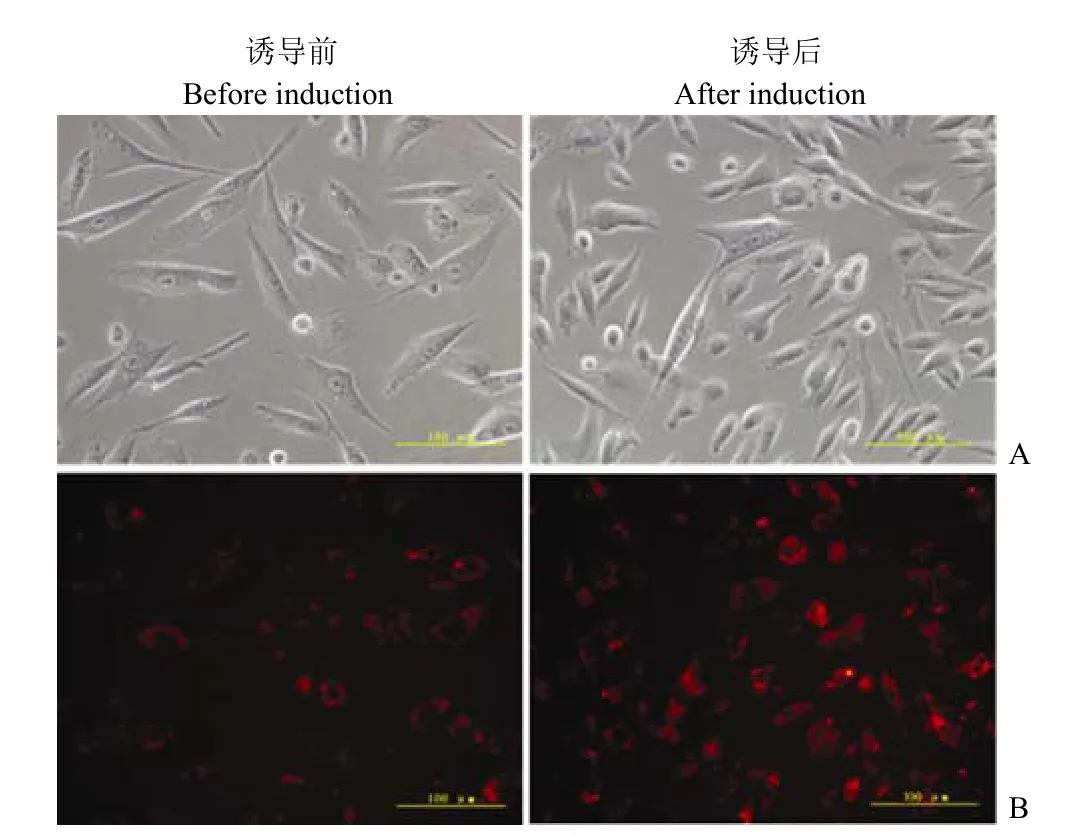
图6 VEGF 诱导前后EPCs 摄取 DiI-ac-LDL的检测荧光显微镜(×400)Figure6 Fluorescence microscopy for uptake DiI-Ac-LDL by EPCs before and after induction with VEGF (×400)
1997年,Asahara等[7]报告:用免疫磁珠方法从外周血中分离得到 EPCs,这些细胞在缺血或VEGF 诱导后,可以分化为成熟的血管内皮细胞,并证实这些细胞可参与血管内皮细胞损伤修复,并参与新生血管的生成。近期的实验发现,EPCs 在糖尿病[12]、冠心病[13]、脑缺血[14]等缺血性疾病的治疗中具有应用价值。然而,外周血中存在的EPCs是非常有限的,难以满足临床治疗的应用,因此,如何获得大量、高纯度的EPCs是临床治疗应用需要解决的首要问题。本研究从人胚胎主动脉中分离得到 EPCs,并证实这些细胞具有纯度高,体外增殖能力强,并具有分化成为成熟血管内皮细胞的能力。
在胚胎血管发育过程中,血管壁的内膜先形成EPCs 细胞,然后分化成为血管内皮细胞。本实验通过选择不同胎龄的主动脉通过免疫组织化学染色证实,14周龄的人胚胎主动脉内膜由 EPCs组成,而 14周龄后的主动脉内膜已经部分分化成为血管内皮细胞。因此,本研究的EPCs 细胞从小于14周龄的胚胎主动脉分离。
在分离 EPCs 以前,我们先将主动脉翻转(内膜翻到外面),并用血管夹夹闭主动脉末端,然后浸泡在胶原酶中消化。这样可以避免血管外膜细胞的污染,通过控制酶消化时间可以获得高纯度的EPCs。在EPCs 体外培养过程中,我们采用含有bFGF、EGF和ECGS的干细胞血清的培养基促进细胞增殖,同时加入白血病抑制因子(LIF)抑制EPCs 在培养过程中的分化。在这种培养基中,EPCs 快速增殖,通常在第 3 代时可以达到 107数量级的细胞。
EPCs 细胞的鉴定一般采用 CD34+ CD133+VEGFR2+ 共表达来作为EPC的分子标记[3,15],其中 CD34和VEGFR2只在EPCs和成熟内皮细胞上表达[16]。我们的结果表明,EPCs 在诱导分化成为血管内皮细胞前后都表达 CD34和VEGFR2,而只有 CD133 在EPCs 诱导成为血管内皮细胞后表达明显降低,表明 CD34和VEGFR2 主要用于区分非内皮类细胞,而 CD133 才是区别内皮细胞和EPC 细胞的特异标志[17]。
文献[18]报道,VEGF 可以诱导 EPCs 分化成为血管内皮细胞。在我们的实验中,EPCs 细胞在经过 VEGF 诱导后,EPCs 细胞的特异标志CD133 表达逐渐减少,而成熟内皮细胞的功能指标如 vWF和ELAM-1 表达增加,表明 EPCs 细胞发生了向血管内皮细胞的分化。ELAM-1是成熟内皮细胞的功能性黏附分子,其基础表达水平很低,在内皮细胞受到刺激时快速表达[19]。因此,我们对VEGF 诱导前后EPCs 上 ELAM-1的表达进行了分析,结果表明诱导后的细胞在给予 TNFα 刺激后出现明显上调的ELAM-1 表达,其表达水平与成人肾动脉内皮细胞相似。
摄取 Ac-LDL和形成血管样网络结构不仅是成熟内皮细胞的功能特性,也是 EPCs的重要功能指标[7-8]。我们的研究发现,胚胎主动脉来源的EPCs 不仅具有摄取 Ac-LDL的能力,而且在基质胶上可形成血管样网络结构,当 VEGF 诱导 EPCs细胞向血管内皮细胞分化后,细胞摄取 Ac-LDL和形成血管样网络结构的能力都明显增强。
这些结果表明,人胚胎主动脉是 EPCs的良好来源,所获得的EPCs 可在体外大量扩增,并且在VEGF的诱导下可以分化为成熟内皮细胞,是干细胞技术治疗血管性疾病的一个新的干细胞材料。
[1]Ma ZL, Mai XL, Sun JH, et al.Inhibited atherosclerotic plaque formation by local administration of magnetically labeled endothelial progenitor cells (EPCs) in a rabbit model.Atherosclerosis, 2009,205(1):80-86.
[2]Kawamoto A, Tkebuchava T, Yamaguchi J, et al.Intramyocardial transplantation of autologous endothelial progenitor cells for therapeutic neovascularization of myocardial ischemia.Circulation,2003, 107(3):461-468.
[3]Briasoulis A, Tousoulis D, Antoniades C, et al.The role of endothelial progenitor cells in vascular repair after arterial injury and atherosclerotic plaque development.Cardiovasc Ther, 2010.
[4]Urbich C, Heeschen C, Aicher A, et al.Relevance of monocytic features for neovascularization capacity of circulating endothelial progenitor cells.Circulation, 2003, 108(20):2511-2516.
[5]Asahara T, Masuda H, Takahashi T, et al.Bone marrow origin of endothelial progenitor cells responsible for postnatal vasculogenesis in physiological and pathological neovascularization.Circ Res, 1999,85(3):221-228.
[6]Benameur T, Tual-Chalot S, Andriantsitohaina R, et al.PPARalpha is essential for microparticle-induced differentiation of mouse bone marrow-derived endothelial progenitor cells and angiogenesis.PLoS One, 2010, 5(8):e12392.
[7]Asahara T, Murohara T, Sullivan A, et al.Isolation of putative progenitor endothelial cells for angiogenesis.Science, 1997,275(5302):964-967.
[8]Ahrens I, Domeij H, Topcic D, et al.Successful in vitro expansion and differentiation of cord blood derived CD34+ cells into early endothelial progenitor cells reveals highly differential gene expression.PLoS One, 2011, 6(8):e23210.
[9]Suda T, Takakura N, Oike Y.Hematopoiesis and angiogenesis.Int J Hematol, 2000, 71(2):99-107.
[10]Rehman J, Li J, Orschell CM, et al.Peripheral blood "endothelial progenitor cells" are derived from monocyte/macrophages and secrete angiogenic growth factors.Circulation, 2003, 107(8):1164-1169.
[11]Caiado F, Carvalho T, Silva F, et al.The role of fibrin E on the modulation of endothelial progenitors adhesion, differentiation and angiogenic growth factor production and the promotion of wound healing.Biomaterials, 2011, 32(29):7096-7105.
[12]Lee MJ,Kim J,Lee KI, et al.Enhancement of wound healing by secretory factors of endothelial precursor cells derived from human embryonic stem cells.Cytotherapy, 2011, 13(2):165-178.
[13]Alev C, Ii M, Asahara T.Endothelial progenitor cells: a novel tool for the therapy of ischemic diseases.Antioxid Redox Signal, 2011,15(4):949-965.
[14]Kocaman SA, Yalçın MR, Yağcı M, et al.Endothelial progenitor cells(CD34+KDR+) and monocytes may provide the development of good coronary collaterals despite the vascular risk factors and extensive atherosclerosis.Anadolu Kardiyol Derg, 2011, 11(4):290-299.
[15]Yoder MC.Defining human endothelial progenitor cells.J Thromb Haemost, 2009, 7 Suppl 1:49-52.
[16]Eggermann J,Kliche S,Jarmy G, et al.Endothelial progenitor cell culture and differentiation in vitro: a methodological comparison using human umbilical cord blood.Cardiovasc Res, 2003, 58(2):478-486.
[17]Yin AH, Miraglia S, Zanjani ED, et al.AC133, a novel marker for human hematopoietic stem and progenitor cells.Blood, 1997, 90(12):5002-5012.
[18]Invernici G, Emanueli C, Madeddu P, et al.Human fetal aorta contains vascular progenitor cells capable of inducing vasculogenesis,angiogenesis, and myogenesis in vitro and in a murine model of peripheral ischemia.Am J Pathol, 2007, 170(6):1879-1892.
[19]Grau GE, Mili N, Lou JN, et al.Phenotypic and functional analysis of pulmonary microvascular endothelial cells from patients with acute respiratory distress syndrome.Lab Invest, 1996, 74(4):761-770.
