锂电池用硫酰氯电解液制备工艺改进
2012-12-01李向阳马素杰
李向阳,李 鲁,李 强,沈 航,马素杰
(1.机电动态控制重点实验室,陕西 西安 710065;2.西安机电信息技术研究所,陕西 西安 710065;3.中铁二十局,陕西 西安 710016)
0 引言
锂和非水无机溶剂如亚硫酰氯(SOCl2)、硫酰氯(SO2Cl2)和某些无机盐组成的无机电解液一次电池,是近年发展起来的新型高能化学电源[1-2]。锂-硫酰氯电池理论比能量和锂-亚硫酰氯电池接近,高达1 400Wh/kg;锂-硫酰氯单体电池开路电压高达3.91V;最大电流密度100mA/cm2;还具备快速大电流放电的能力,尤其是高温大电流放电性能卓越;安全性高,电池湿搁置寿命可长达10年以上[3-4]。锂-硫酰氯电池在美国已形成自动化生产线,产品性能稳定,在欧美、以色列、韩国等部队中有大量的用户群[5]。国内也开展了锂-硫酰氯原电池的研究工作[4,6],但主要用于井下开采、油气生产或指挥控制、航行定位、救护照明等民用方面,国内还没有将锂-硫酰氯电池专门作为储备式化学电源应用于引信方面的先例。
由于从市场上购买的硫酰氯溶液和电解质四氯铝锂杂质和水分含量相对较大,在用原工艺制备的硫酰氯电解液进行原电池摸底放电试验时,发现放电性能与期望值差距较大,本文着手对硫酰氯电解液制备工艺进行了改进。
1 锂-硫酰氯电池工作原理及电解液原工艺
1.1 锂-硫酰氯电池工作原理
锂-硫酰氯电池是以金属锂为负极,液态硫酰氯为正极活性物质,并以多孔炭为正极集流体的电化学体系电源。其中,SO2Cl2既为反应物质又为非水无机溶剂,溶解LiAlCl4等添加剂后的溶液为无机电解液,该体系电池是近年发展起来的新型高能化学电源[2]。
Li-SO2Cl2电池的表达式为:

具体电化学反应式为:
负极反应 2Li-2e-=2Li+
正极反应 2SO2Cl2+2e-=2Cl-+SO2
电池总反应 2Li+SO2Cl2=2LiCl+SO2
电池开路电动势为3.91V。
1.2 硫酰氯电解液原工艺
取市售硫酰氯溶液直接加入一定量的电解质LiAlCl4,然后将溶液加热回流至少12h,在干燥环境下过滤、分装得到电解液[6]。
现有的锂电池用硫酰氯电解液的制备方法多是将电解质锂盐按规定浓度直接溶于硫酰氯溶液中制得电解液。由于该方法没有对原料四氯铝锂和硫酰氯溶液进行用前处理,使得最终电解液中的金属离子和水的含量相对较高,导致电池副反应增多,使电池能量不能有效释放。
结合硫酰氯溶液本身易挥发、强腐蚀、易与水反应的特点,认为由于从市场上购买的硫酰氯原溶液中杂质和水分含量相对较大,造成放电性能欠佳,在参考以往工作经验的基础上,对硫酰氯的原制备工艺进行了改进。
2 硫酰氯电解液新工艺
在硫酰氯电解液原制备工艺的基础上,提出了锂电池用硫酰氯电解液新工艺。取高温处理后的电解质四氯铝锂2 1 0.7g、干净Li片数片和0.5%LiAlCl4的纳米催化剂加入蒸馏好的1L硫酰氯溶液中,然后将该溶液加热回流至少12h,在湿度露点值≤-35℃的干燥环境中过滤、分装,得电解液。
2.1 电解质LiAlCl4高温处理
取电解质LiAlCl4,真空干燥箱加热到190℃,至完全熔融时,停止加热,冷却至室温后,在干燥环境下将熔体重新敲击成粒状,待用。
电解质LiAlCl4经高温处理后,可以将所含的微量水完全除去,LiAlCl4经熔融再结晶后,纯度更高,更有利于后续电池反应。
2.2 原料硫酰氯蒸馏提纯
在湿度露点值小于等于-35℃、相对湿度小于等于1%的干燥环境中,对原料硫酰氯溶液进行蒸馏处理,收集63~66℃馏分。原料硫酰氯溶液经蒸馏提纯后,其有害金属杂质(Fe3+、Fe2+、Pb2+等)和水等其他无机物杂质浓度大大降低,纯度提高,副反应减少,效率提高。
2.3 电解质LiAlCl4浓度选择
选用含高温处理后电解质LiAlCl40.5mol/L、1.5mol/L、2.5mol/L的电解液,制作成原电池后,在电流密度60mA/cm2,湿度露点值小于等于-35℃、相对湿度小于等于1%的干燥环境下,连续放电至终止电压为3V。图1是其放电情况。

图1 LiAlCl4浓度对比放电曲线Fig.1 Comparison discharge curves of LiAlCl4concentration
从图1可以看出:1.5mol/L LiAlCl4电解液装配成电池的平均负载电压,放电电压都比较高,故LiAlCl4浓度选1.5mol/L较为合适。
2.4 纳米催化剂用量选择
向1.5mol/L电解液中分别加入含0%、0.5%、1%LiAlCl4的纳米催化剂金属钯,制作成原电池后,在电流密度60mA/cm2,湿度露点值小于等于-35℃的干燥环境下,连续放电至终止电压为3V。放电情况如图2所示。

图2 纳米催化剂对比放电曲线Fig.2 Comparison discharge curves of nano-catalyst
从图2可以看出,配制纳米催化剂金属钯用量为0.5%LiAlCl4时,电解液的起始电压,平均负载电压都相对较高,因此加入纳米催化剂金属钯0.5%LiAlCl4时电解液放电效果最佳。
电解质LiAlCl4经高温处理,硫酰氯溶液经蒸馏提纯后,其有害金属离子(Fe3+、Fe2+、Pb2+等)和水等其他无机物杂质浓度大大降低,使电解液纯度提高,副反应减少,效率提高。同时,适量电解质LiAlCl4的加入,使带电离子保持最佳浓度,提高了溶液电导率和带电离子的有效迁移速度,改善了电池激活时间,而纳米催化剂金属钯具有增加溶液电导和提高放电电流密度的双重作用,它的加入能使电解液保持最佳的催化活性。
3 硫酰氯电解液高、低、常温放电对比试验
把根据新、原工艺制备好的硫酰氯电解液装配成储备式单元电池,在高温(+50℃)、低温(-40℃)、常温(室温)的情况下,在马谢特锤击机上锤击激活,连接8855型存储示波器,监视电池的放电过程[7]。电池测试结构图和测试线路图如图3、图4所示。
图5、图6、图7和表1为新工艺电解液和原工艺电解液分别装配成储备式锂-硫酰氯电池在高温(+50℃)、低温(-40℃)、常温(室温)条件下,以恒电阻40Ω,大电流放电225s对比数据。

图3 试验电池结构示意图Fig.3 Structure diagram of test battery

图4 测试线路图Fig.4 Test circuit

图5 新、原工艺电解液高温放电对比曲线Fig.5 Discharge curve of new and original process electrolyte in high temperature

图6 新、原工艺电解液低温放电对比曲线Fig.6 Discharge curve of new and original process electrolyte in low temperature
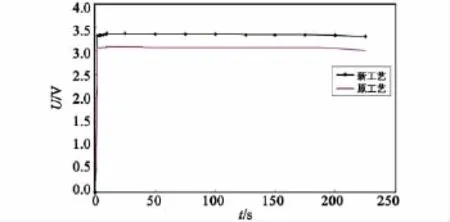
图7 新、原工艺电解液常温放电对比曲线Fig.7 Discharge curve of new and original process electrolyte in normal temperature
从图5—图7和表1可知:在大电流放电情况下,新工艺电解液装配的储备电池比原工艺放电电压高温提高9.68%、低温提高7.23%、常温提高8.74%;在考察时间225s内,放电容量高温提高9.71%、低温提高7.16%、常温提高8.69%;激活时间快50ms以上。
与高温、常温相比,低温放电性能稍差。可能是由于低温条件下,电解液流动性较差,不利于正、负离子的迁移,以后要加强此方面研究,从电化学反应机理上找出影响电池低温反应的最主要因素,采取合理措施以改善电池低温放电性能。在以后的工作中再结合对碳正极和电池结构的改进,改善电池整体放电性能,使其作为储备式化学电源应用于军事领域。

表1 新、原工艺电解液高、低、常温大电流放电对比数据表Tab.1 High-current discharge of new and original process electrolyte in high,low,normal temperature
4 结论
本文提出了锂电池用硫酰氯电解液制备工艺的改进方法。原料硫酰氯溶液经蒸馏提纯,电解质LiAlCl4经高温处理后,硫酰氯溶液中加入1.5mol/L LiAlCl4,纳米催化剂金属钯用量为0.5%LiAlCl4时,电解液放电性能最佳。新、原工艺制备的硫酰氯电解液装配成储备式电池分别进行了高、低、常温大电流放电对比试验,结果表明:在放电电阻相同的情况下,新工艺制备电解液的放电电压、放电容量、激活时间等指标都优于原工艺制备电解液,改善了锂-硫酰氯电池的整体放电性能。
原电池对比实验中,利用三选一优选法确定的最佳浓度仅仅是在该已有经验浓度范围内的最佳,显得过于粗放,今后应加强该方面研究工作。
[1]郭炳焜,李新海,杨松青.化学电源-电池原理及制造技术[M].长沙:中南工业大学出版社,2000.
[2]管从胜,杜爱玲,杨玉国.高能化学电源[M].北京:化学工业出版社,2005.
[3]杨洪波.电池制造技术与质量监控级标准实用手册[M].合肥:安徽文化音像出版社,2003.
[4]张自禄,卢嘉春,杨裕生.锂-硫酰氯电池的性能改进[J].电池,2004,34(3):187-188.ZHANG Zilu,LU Jiachun,YANG Yusheng.Improvement of performence for lithium/sulfuryl chloride cell[J].Battery Bimonthly,2004,34(3):187-188.
[5]Eric R Bixon,Frank A Gagliarid.Accelerated test program for the battery used in the m234self destruct fuze[C]// The 47thAnnual Fuze Conference.US:IEEE,2005:4-9.
[6]庄俊峰,丁晓兵.锂-硫酰氯电池:中国,101079499A[P].2007-11-28.
[7]康峰,李向阳.增减碳正极轧制次数对储备式锂电池性能影响[C]//中国兵工学会2008学术年会论文集.北京:中国兵工学会,2008:343-347.
