银杏内酯A、B对高胆固醇诱导的PC12细胞胆固醇代谢的影响*
2012-11-29张云莎马东明马轶文姜希娟
张云莎,马东明,卢 斌,马轶文,姜希娟
(1.天津中医药大学病理教研室,天津 300193;2.天津中医药大学实验教学部,天津 300193;3.天津市塘沽区妇幼保健院,天津 300451)
近年来,银杏叶有效单体被广泛用于防治阿尔茨海默病(AD),取得了较好的疗效,但其作用机制尚未完全阐明。基于脑胆固醇代谢紊乱在AD发病中发挥着重要作用,或可假定银杏叶有效单体银杏内酯A、B能通过调节脑胆固醇代谢起到保护神经元的作用。
前期工作中,笔者建立体外血脑屏障(BBB)环境下PC12细胞的高胆固醇损伤模型,研究发现高胆固醇环境下,PC12细胞内总胆固醇含量增加,而银杏内酯A(GKA)和银杏内酯B(GKB)可以有效降低上述模型的细胞总胆固醇含量,其中以30 μmol/L GKA和25 μmol/L的GKB效果最佳[1]。基于此结果,本实验进一步来探讨GKA及GKB对PC12细胞内胆固醇代谢关键酶的影响,阐释GKA、GKB防治AD的可能作用机制。
1 材料和方法
1.1 细胞 PC12细胞株(大鼠肾上腺嗜铬细胞瘤),购于中国典型培养物保藏中心(CCTCC)。
1.2 药品及试剂 DMEM培养基(Gibco),胎牛血清(Hyclone),马血清(Gibco),多聚-L-赖氨酸(Sigma),可溶性胆固醇(Sigma Cat NO.P6282),辛伐他汀(Sigma),银杏内酯 A(Ginkgolide A,NO.110862)和银杏内酯 B(Ginkgolide B,NO.110863)标准品购自宝鸡贝斯特植物原料有限公司,反转录聚合酶链式反应(RT-PCR)二步法试剂盒(ABI),TRIZOL Reagent(Invitrogen),Tris、DEPC(Sigma)。其余试剂均为市售分析纯。
1.3 仪器 CO2培养箱(SANYO),超净化工作台(日立),IX-70型倒置显微镜(Olympus),Universal 16R低温高速离心机(Beckman);ABIPrism7000PCR仪(ABI)。
1.4 体外血脑屏障环境下PC12细胞胆固醇损伤模型建立 参照文献[2]利用Transwell装置培养脑微血管内皮细胞和星形胶质细胞,建立BBB体外模型。将BBB置于培养有PC12细胞的6孔板内,然后在Transwell内皮细胞侧加入含40 μmol/L终浓度可溶性胆固醇的培养基继续作用24 h,作为高胆固醇损伤模型[3]。
1.5 实验分组及干预 对照组(C),普通培养基培养;模型组(M),40 μmol/L 胆固醇处理 24 h,更换正常培养基继续培养16 h;GKA组,40 μmol/L胆固醇处理24 h,更换含30 μmol/L GKA的培养基继续培养16 h;GKB组,40 μmol/L胆固醇处理24 h,更换含25 μmol/L GKB的培养基继续培养16 h。
1.6 RT-PCR测定胆固醇代谢相关酶的基因表达采用Trizol试剂盒提取细胞总核糖核酸(RNA)。依试剂盒说明书,采用TaqMan Reverse Transcription Reagents试剂盒和oligod(T)16 引物将总 RNA(0.2μg)反转录为互补脱氧核糖核酸(cDNA)(10 μL体系)。0.5 μL的cDNA产物用作定量PCR扩增的模板。PCR扩增反应采用SYBR Green PCR Master Mix reagent kits试剂盒和特异性引物(见表1)。数据采用 2-ΔΔCT相对定量法分析。

表1 引物种类及引物序列Tab.1 Primer type and primer sequences
1.7 统计学处理 采用SPSS16.0软件分析,计量资料均以均数±标准差(±s)表示。多组间比较采用单因素方差分析,两两比较时若方差齐则选用LSD检验,若方差不齐则选用Tam hane’s T2法。P<0.05为差异有统计学意义。
2 结果
高胆固醇环境下,调节细胞胆固醇摄入的关键物质低密度脂蛋白受体相关蛋白-1(LRP-1)表达降低(P<0.01);细胞内胆固醇酯化关键酶乙酰胆固醇酰基转移酶(ACAT)及胆固醇流出关键通道蛋白ATP结合盒转运子 A1(ABCA1)表达上调(P<0.05);胆固醇羟化酶24S-羟化酶(CYP46)的表达无变化。药物干预后,上调了LRP-1的表达(P<0.05),但对其他酶的表达无明显影响。见表2。
3 讨论
近年来的研究表明,外周高胆固醇血症可以影响BBB的通透性引起脑胆固醇水平升高,而且胆固醇代谢通路中的关键物质可以直接参与到AD的发生发展过程中。
脑内胆固醇主要由星形胶质细胞合成,由载脂蛋白E经LRP转运给神经元。一部分游离胆固醇被神经元内质网中的ACAT酯化,ACAT是调节细胞内胆固醇代谢和分布的关键成分。另外一部分胆固醇经胆固醇流出调节蛋白(CERP)排出细胞外,构成胆固醇逆向转运的第一步,其中ABCA1起主要作用;最后脑胆固醇在CYP46的作用下转化为24S-羟胆固醇,后者能够通过BBB,由低密度脂蛋白(LDL)转运至肝脏代谢。
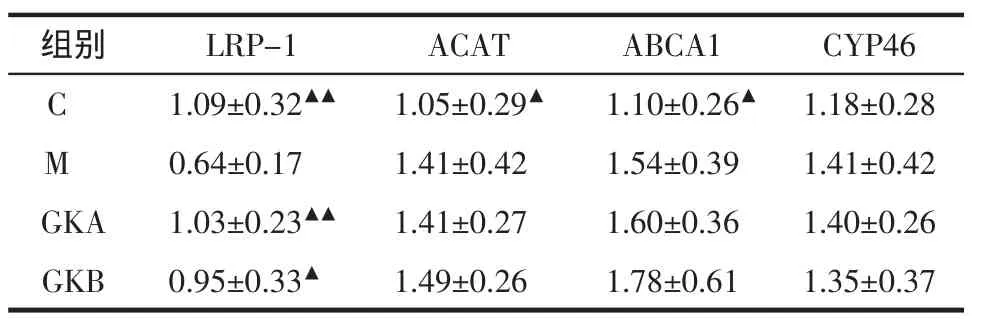
表2 高胆固醇环境下PC12细胞胆固醇代谢关键酶的表达及GKA、GKB的影响(n=8)Tab.2 The effects of GKA and GKB on cholesterol metabolism key enzymes in PC12 cells exposed to high cholesterol(n=8)
β淀粉样蛋白(Aβ)沉积是AD的主要病理学特征。正常脑组织内Aβ的含量取决于合成与清除的速率。Aβ由淀粉样前体蛋白(APP)加工合成,主要经由脑内皮细胞膜表面的LRP介导,经BBB流出到外周[4]。有研究发现脑组织中Aβ明显沉积的AD患者,LRP水平下调;上调LRP的表达后,Aβ的沉积减少[5]。Aβ沉积导致神经元的丢失,因此,持续有效的清除Aβ是避免其在脑内沉积的重要机制。靶向LRP的治疗已成为防治AD的重要策略之一。
目前研究表明神经元内胆固醇的分布形式影响着Aβ的产生。ACAT在细胞内胆固醇分布中起着关键作用,它可能通过调节胆固醇与胆固醇酯的动态平衡而影响Aβ的产生[6]。有研究认为细胞内胆固醇酯含量越高,Aβ的产生越多,反之亦然[7]。Hutter-Paier等[8]在APP转基因AD小鼠模型中给予ACAT抑制剂后,发现小鼠脑中Aβ沉积减少;进一步的研究表明ACAT可能通过影响APP裂解方式促进Aβ合成,ACAT的活性轻度降低就能产生强烈的抑制Aβ生成作用[9]。
ABCA1是一种膜相关蛋白,主要是利用ATP将胆固醇从细胞膜内层转移至外层,使其与载脂蛋白结合,从而介导胆固醇的外流。研究表明,ABCA1在载脂蛋白E结合胆固醇的过程中发挥重要作用。过表达ABCA1的小鼠,可增强脂蛋白的转运,减少Aβ的沉积[10]。而24S-羟胆固醇作为脑胆固醇代谢的最终产物,在脑脊液中的蓄积也发挥着神经毒性作用,引起神经退行性变[11]。24S-羟化酶的活性决定24S-羟胆固醇的浓度,近年来多项研究显示[12-13],CYP46基因的多态性与Aβ沉积密切相关。
本研究发现,高胆固醇环境下,PC12细胞高表达了ACAT及ABCA1,低表达了LRP,提示外周高胆固醇血症可能会影响脑内胆固醇代谢相关酶的表达;给予药物干预后发现,除LRP水平上调外,其余无明显改变,提示GKA、GKB可能通过调控LRP的水平,促进Aβ的清除,达到防治AD的作用。
[1]郭茂娟,范英昌,卢 斌,等.银杏内酯B对高胆固醇诱导的PC12细胞胆固醇含量的影响[J].中国病理生理杂志,2012,28(1):173-176.
[2]胡利民,范 祥,张艳军,等.大鼠脑微血管内皮细胞与星形胶质细胞共培养血脑屏障体外模型的建立[J].天津中医药,2005,22(2):149-151.
[3]Jiang X,Guo M,Su J,et al.Simvaststin Blocks Blood-Brain Barrier Disruption Induced by Elevated Cholesterol Both In Vivo and In Vitro[J].Int J Alzheimers Dis,2012,PMC3296225.
[4]Deane R,Sagare A,Zlokovic B.The Role of the Cell Surface LRP and Soluble LRP in Blood-brain BarrierAβClearance in Alzheimer’s Disease[J].Curr Pharm Des,2008,14:1601-1605.
[5]Herring A,Yasin H,Ambree O,et al.Environmental enrichment counteracts Alzheimer’s neurovascular dysfunction in TgCRND8 mice[J].Brain Pathol,2008,18:486-489.
[6]Raja B,Dora MK.ACAT inhibition and amyloid beta reduction.Biochim Biophys Acta[J].2010,1801:960-965.
[7]Puglielli L,Konopka G,Pack-Chung E,et al.Acyl-coenzyme A:cholesterol acyltransferase modulates the generation of the amyloid beta-peptide[J].Nat Cell Biol,2001,3:905-912.
[8]Hutter-Paier B,Huttunen HJ,Puglielli L,et al.The ACAT inhibitor CP-113,818 markedly reduces amyloid pathology in a mouse model of Alzheimer’s disease[J].Neuron,2004,44:227-238.
[9]Huttunen HJ,Greco C,Kovacs DM.Knockdown of ACAT-1 reduces amyloidogenicprocessingofAPP[J].FEBSLett,2007,581:1688-1692.
[10]Suzanne E,Wahrle L,Hong J,et al.Overexpression of ABCA1 reduces amyloid deposition in the PDAPP mouse model of Alzheimer disease[J].J Clin Invest,2008,118:671-682.
[11]Schonknecht P,Lutjohann D,Pantel J,et al.Cerebrospinal fluid 24 Shydroxycholestrol is increased in patients with Alzheimer’s disease compared to healthy controls[J].Neurosci Lett,2002,324:83-85.
[12]VFernandezDelPozo,MAlvarezAlvarez,MFernandezMartinez,etal.Polymorphism in the cholesterol 24S-hydroxylase gene(CYP46A1)associated with the APOEpsilon3 allele increases the risk of Alzheimer's disease and of mild cognitive impairment progressing to Alzheimer's disease[J].Dement Geriatr Cogn Disord.2006,21:81-87.
[13]Kolsch H,Lutjohann D,Jessen F,et al.CYP46A1 variants influence Alzheimer's disease risk and brain cholesterol metabolism[J].Eur Psychiatry,2009,24:183-190.
