甲状腺素对甲状腺功能减低大鼠子代海马突触素表达的影响*
2012-11-28孙亚婷汪蓓蕾杨丽娜
孙亚婷 汪蓓蕾 杨丽娜 张 瑞 郭 刚
研究表明围生期甲低仔鼠行为学习记忆改变与海马神经元凋亡增加密切相关[1]。胚胎期缺碘、甲状腺激素不足也影响海马神经元分化发育[2]。突触素几乎存在于中枢和外周神经系统的所有神经末梢,在神经内分泌细胞等部位也有突触素存在,突触素蛋白能够作为神经发育的指标蛋白[3]。因此,甲状腺素可能与海马突触素的表达有相关性。本研究通过对孕早、晚期甲状腺功能减低(甲低)孕鼠补充不同剂量的甲状腺素,以期发现甲状腺素对子代大鼠海马区突触素表达的影响。
1 材料与方法
1.1 动物模型制作与分组 选用断乳1个月的雌、雄性SPF/VAF级Wistar大鼠(购自军事医学科学院实验动物中心)各80只,体质量90~110 g。适应性饲养1周后,将雌性大鼠随机分为正常组(10只)和甲低组(70只),甲低组大鼠均饲以重度缺碘地区粮食配制的饲料,成分为玉米∶黄豆∶小麦∶小米=3∶3∶3∶1,另外添加必需氨基酸、维生素和无机盐等,饲料经过食品中碱的灰化-砷铈催化分光光度法测定,含碘量为13.66 ng/g。甲低组均饮去离子水;对照组饮含碘量为200 μg/L的碘酸钾溶液,总碘摄入量相当于大鼠生理碘需要量。饲养3个月后,于大鼠内眦取血,测定血清甲状腺素,当各低碘组大鼠血清总三碘甲状腺原氨酸(TT3)、总甲状腺素(TT4)、游离三碘甲状腺原氨酸(FT3)及游离甲状腺素(FT4)水平与对照组比较差异有统计学意义时,表明甲低模型制造成功。然后将甲低组随机分为7组,每组10只:低碘孕鼠妊娠1~17 d(妊早期甲低)补充甲状腺素高、中、低剂量组,甲低孕鼠妊娠18~20 d(妊晚期甲低)补充甲状腺素高、中、低剂量组和甲低对照组。高、中、低剂量组每天每100 g体质量分别补充甲状腺素3.5、2.0和0.5 μg[4]。将8组雌鼠与正常Wistar雄性大鼠(食用正常饲料)按1∶1进行交配。次日晨检测阴栓,做阴道涂片,发现精子确定为妊娠0 d。8组孕鼠分别取新生当天(0 d)、生后7、14及21 d的子鼠右侧大脑半球。
1.2 突触素的检测 将子鼠右侧大脑半球用4%多聚甲醛固定24 h,石蜡包埋,进行海马区连续冠状切片,片厚4 μm。PBS代替一抗作为阴性对照,免疫组织化学检测采用SABC法,按说明书步骤严格操作,以微波枸橼酸盐进行抗原修复,DAB显色,苏木素复染,中性树胶封片,以细胞内出现黄色颗粒为免疫组化阳性信号。每个组别选取3张切片,每张切片选取5个完整而不重叠的的高倍镜视野(×400),用显微镜观察并照相。
1.3 突触素的定量测定 使用Image-ProÒ Plus(IPP)测定每张照片阳性反应的平均光密度(COD)作为该例的测量值。同时测定同一张照片上胼胝体的COD以作为背景值,用前者减去后者得到矫正的COD。
1.4 统计学分析 采用SPSS 11.0软件包处理数据,各组数据以±s表示,多组间比较采用方差分析,每个时间点不同组的两两比较采用Dunnett-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 突触素免疫组化染色结果 突触素阳性染色呈棕黄色点状或颗粒状沉积,位于胞浆内,胼胝体、血管和胶质细胞不着色,见图1;阴性对照切片未见突触素免疫产物,见图2。
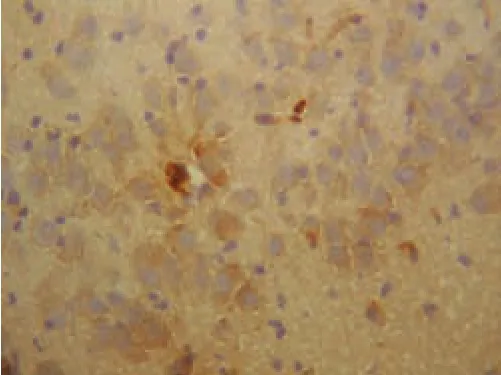
Figure 1 Positive Result of EnvisionTM Staining of hippocampus synaptophysin图1 大鼠海马突触素染色阳性结果(SABC染色×400)
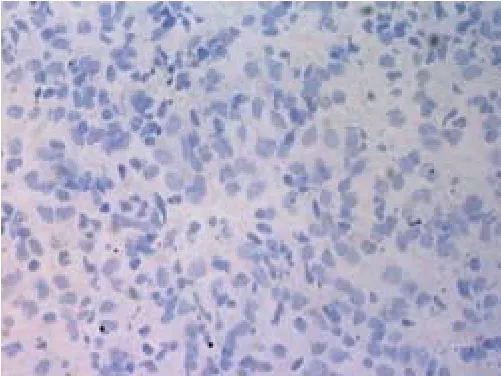
Figure 2 Showing the negative control of rat hippocampus图2 大鼠海马阴性对照(SABC染色×400)
2.2 各组突出素表达量比较 正常组的突触素表达水平均高于同时期甲低对照组(P<0.01)。在新生当天,妊晚期甲低中剂量组与甲低对照组比较差异无统计学意义(P>0.05),妊早、晚期甲低低剂量组突触素表达水平均低于甲低对照组(P<0.01);妊早期甲低中、高剂量组,妊晚期甲低高剂量组突触素表达水平均高于甲低对照组(P<0.01)。生后7、14、21及28 d,妊早、晚期甲低低剂量组与甲低对照组比较差异无统计学意义(P>0.05),其他各组的突触素表达水平均高于甲低对照组(P<0.001),见表1。
Table 1 The Expression of brain tissue synaptophysin in offspring rat of groups表1 不同组别各日龄子鼠脑组织突触素的表达(n=10,COD值,±s)

Table 1 The Expression of brain tissue synaptophysin in offspring rat of groups表1 不同组别各日龄子鼠脑组织突触素的表达(n=10,COD值,±s)
**P<0.01
组别甲低对照组(1)正常组(2)妊早期甲低低剂量组(3)中剂量组(4)高剂量组(5)妊晚期甲低低剂量组(6)中剂量组(7)高剂量组(8)F P(1)∶(2)(1)∶(3)(1)∶(4)(1)∶(5)(1)∶(6)(1)∶(7)(1)∶(8)0 d 0.784±0.020 1.327±0.017 7 d 3.274±0.028 3.698±0.021 14 d 7.311±0.096 7.978±0.082 21 d 7.825±0.016 8.308±0.008 28 d 7.907±0.025 8.584±0.010 0.685±0.046 0.983±0.062 1.260±0.011 3.307±0.073 3.572±0.020 3.621±0.061 7.406±0.039 7.819±0.036 7.862±0.034 7.848±0.027 8.215±0.019 8.236±0.025 7.937±0.031 8.381±0.023 8.416±0.026 0.683±0.039 0.782±0.022 0.975±0.011 170.746**<0.001<0.001<0.001<0.001<0.001 1.000<0.001 3.292±0.080 3.438±0.011 3.569±0.020 35.204**<0.001 0.927<0.001<0.001 0.997<0.001<0.001 7.401±0.049 7.741±0.077 7.812±0.056 49.231**<0.001 0.324<0.001<0.001 0.375<0.001<0.001 7.831±0.093 8.010±0.068 8.198±0.062 28.258**<0.001 0.998<0.001<0.001 1.000 0.018<0.001 7.906±0.024 8.227±0.035 8.359±0.004 359.360**<0.001 0.549<0.001<0.001 1.000<0.001<0.001
3 讨论
婴幼儿在胚胎时期因缺碘而致甲状腺激素合成不足,会导致呆小症(克汀病),语言、认知、行为、听力、运动等脑功能发生不同程度的障碍[5]。早期母体低甲状腺素引起的胎儿神经发育缺陷比先天性的甲减更常见[6]。甲状腺功能低下动物的神经元和神经丛发育不全、神经递质不足,神经元和神经胶质细胞酶谱均不完备[7]。胚胎期与新生期缺碘、甲状腺激素不足所致海马核团体积变小,细胞数目减少,突触发育不良,不仅是缺碘、甲状腺激素不足影响海马神经元分化发育的结果,而且还与缺碘、甲状腺素不足导致海马神经细胞凋亡增加有关[2]。
突触素是一种与突触结构和功能密切相关的膜蛋白,分子质量为38 ku,在神经元胞体合成后主要转运至轴突终末,特异性地分布于突触前囊泡膜上。人类和哺乳动物的突触素基因位于X染色体上,在进化过程中具有高度保守性。正常状态下突触素的量在突触处保持相对恒定,有实验用突触素作为突触前终末的特异性标记物,用来检测突触的密度和分布[8-9]。
本研究发现正常组不同时期的突触素表达水平均高于同时期甲低对照组,说明孕鼠甲低导致子代大鼠海马突触素表达下降。在不同时期给予甲低孕鼠中、高剂量的甲状腺素对海马突触素的表达量有较大的影响,说明甲低孕鼠子代大鼠海马区突触素的表达受补充甲状腺素剂量及孕期的影响。在甲低孕鼠的妊早期给予高剂量的甲状腺素可以使子代各时期海马突触素的表达水平得到明显改善。
综上,笔者认为子代海马突触素表达量的缺乏可能与孕鼠甲状腺功能低下有关,而在妊早期给予高剂量的甲状腺素可以使甲状腺功能低下的孕鼠的子代海马突触素的表达量接近正常,能够起到较好的治疗效果。
[1]黄新文,李筠,季钗,等.围生期甲状腺功能减退仔鼠行为、学习和记忆研究[J].中华内分泌代谢杂志,2007,23(4):358-360.
[2]李远慧,杨勤,粟多顺,等.缺碘子代大鼠海马细胞凋亡的形态学研究[J].中国地方病学杂志,2003,22(6):492-494.
[3]Shen LH,Li Y,Chen J,et al.Intracarotid transplantation of bone marrow stromal cells increases axonmyelin remodeling after stroke[J].Neuroscience,2006,137(2):393-399.
[4]赵金超,张瑞,汪蓓蕾,等.甲状腺素对甲状腺功能减低大鼠子代脑组织中同源盒基因Nkx2.2表达的影响[J].天津医药,2011,39(6):539-541.
[5]Pemberton HN,Franklyn JA,Kilby MD.Thyroid hormones and fetal brain development[J].Minerva Ginecol,2005,57(4):367-378.
[7]Anderson GW,Schoonover CM,Jones SA.Control of thyroid hormone action in the development of rat brain[J].Thyroid,2003,13(11):1039-1056.
[6]Burrow GN,Fisher DA,larsen PR.Maternal and fetal thyroid function[J].N Engl J Med,1994,331(16):1072-1078.
[8]Shen LH,Li Y,Chen J,et al.Intracarotid transplantation of bone marrow stromal cells increases axonmyelin remodeling after stroke[J].Neuroscience,2006,137(2):393-399.
[9]Takaki M,Ujike H,Kodama M,et al.Increased expression ofsynaptophysin and stathmin mRNAs after m ethamphetam ineadministration in rat brain[J].Neuroreport,2001,12(5):1055-1060.
