胰高血糖素样肽1及其受体激动剂研究进展*
2012-11-28徐为人
付 刚 龚 珉 徐为人
糖尿病(diabetes mellitus,DM)是一种慢性高血糖综合征,其中2型糖尿病(T2DM)占糖尿病患者群体的90%以上。世界卫生组织预测,到2030年,全球T2DM患者的数量将超过3亿[1]。目前,常规治疗T2DM的药物包括胰岛素、双胍类、磺酰脲类以及噻唑啉二酮类。然而这些药物很少能长效控制血糖水平,且存在致低血糖、浮肿及体质量增加等不良反映。胰高血糖素样肽(glucagon-like peptide,GLP)-1是一种由肠L细胞分泌的肠促胰岛素,具有促进胰岛素分泌和生物合成、抑制胰高血糖素分泌、促进胰岛细胞增殖等多种生理功能,具有良好的药物应用前景。
1 GLP-1的发现
人进食后会通过神经和激素信号激活一系列生理反应,从而调节消化和吸收过程,其中肠促胰岛素在此过程中起重要作用。肠促胰岛素的概念由Murce于20世纪初提出,1973年分离纯化出第1个肠促胰岛素—葡萄糖依赖性促胰岛素多肽(glucose-dependent insulinotropic polypeptide,GIP)。GIP主要由近端小肠K细胞合成并分泌,由42个氨基酸组成,多集中在十二指肠和上部空肠,能促进胰岛细胞分泌胰岛素。后来人们发现了第2种肠促胰岛素多肽—GLP。GLP-1的发现源于对胰高血糖素原(proglucagon,PG)基因序列的分析,胰高血糖素原基因序列由6个外显子和5个内显子组成,含有3个主要的结构域:胰高血糖素(PG33~61)、GLP-1(PG72~108)和GLP-2(PG126~158)。PG基因在胰岛α细胞、肠L细胞及部分神经细胞中表达,通过组织特异性翻译后修饰,从而在不同组织结构中形成不同的最终产物,见图1。GLP有GLP-1和GLP-2两种亚型,GLP-1是由末端空肠、回肠和结肠的朗格汉斯细胞分泌的一种多肽激素,具有葡萄糖依赖性的促进胰岛素分泌和生物合成、抑制胰高血糖素的分泌及抑制胃排空等多种功能;GLP-2能促进正常小肠的生长和发育,保护和修复各种肠道疾病中损伤的肠黏膜,抑制胃酸的分泌和胃肠的运动,增加肠道的血液供应等。
2 GLP-1的结构及生理功能
GLP-1(1-37)由胰高血糖素基因的转录产物剪切后表达生成,但其并非人体内的活性形式,N端截短的GLP-1(7-36或7-37)是循环中的主要活性形式,其中GLP-1(7-36)约占80%[2],此后绝大多数GLP-1类似物的开发也是基于此种截短序列。GLP-1的N端区域和受体结合能力相关,尤其是 His7、Gly10、Thr13及 Asp15直接与受体结合,His7的丧失会导致GLP-1完全失去生物活性,同样C端氨基酸残基丧失也会导致GLP-1生物活性明显下降。GLP-1的主要生理功能包括葡萄糖依赖性的促进胰岛素分泌和生物合成,抑制胰高血糖素的分泌,促进胰岛β细胞增殖,抑制胰岛β细胞凋亡,保存β细胞对血糖的敏感性,抑制胃肠道蠕动和胃液分泌,延迟胃排空等。GLP-1也能直接作用于中枢神经系统,诱导神经复合体产生饱腹感,从而降低食欲,抑制食物的摄取。相关研究发现GLP-1还能降低心收缩压(SBP),减少血液中三酰甘油、纤维蛋白溶酶原激活抑制子-1(PAI-1)和B型脑钠肽(BNP)的浓度,具有一定保护心血管的功能[3]。另外,动物实验表明GLP-1能够防止心肌细胞缺血,保护内皮细胞功能和利尿等功能[4]。
GLP-1的分泌基于机体对能量的摄入,包括糖类、脂肪酸以及少量氨基酸[5]。有研究显示,GLP-1的分泌与细胞内ATP的生成、KATP通道的阻塞以及细胞内Ca2+浓度的增加有关[6]。另有研究则表明,在小鼠体内一些神经内分泌多肽通过迷走神经参与了GLP-1的分泌[7]。但目前对于人体内GLP-1的快速响应性分泌机制尚不确定。
GLP-1通过与其在β细胞上的特异性受体GLP-1R相结合发挥相应的生理作用,其受体属于7次跨膜的G蛋白偶联受体(GPCR)B家族。GLP-1R包括1个胞外N端结构域(N-terminal domain,NT)、3个胞外环状结构域(EC1-3)、3个胞内环状结构域(IC1-3)、7个跨膜核心结构域(TM1-7)及胞内C末端结构域(CT)。根据多肽结合结构域模型分析结果[8],NT结构域主要负责提供多肽结合所需的能量,而核心结构域TM1-7负责结合配体的N端并将信号传递至细胞内的G蛋白。GLP-1受体与其配体的结合机制不是单一的,根据体外表达GLP-1R全长和NT结构域的配体结合结果,GLP-1R的NT结构域(Ala21-Leu144)与GLP-1的结合能力很差,却能和Exendin-4正常结合,表明2种多肽与GLP-1R的结合机制不同,Exendin-4与GLP-1R的结合更多的依赖于NT结构域,而GLP-1与GLP-1R的结合与TM核心结构域关系紧密。GLP-1R在胰岛细胞中高度表达,通过原位杂交和免疫组化实验证实GLP-1R在胰岛中主要存在于β细胞,在α细胞和δ细胞中表达较少[9]。除胰腺外,GLP-1R在肠、心脏、脑、肺及肾脏等组织中都有广泛分布,用125I标记的GLP-1(7-36)对人组织切片进行的放射自显影实验发现中枢神经中的GLP-1R含量很高,表明这些受体可能通过改变葡萄糖敏感性参与葡萄糖的代谢调节[10]。
GLP-1R激活后会增加细胞内cAMP浓度并激活蛋白激酶A(PKA),通过cAMP/PKA激酶通路增强β细胞内胰岛素基因的转录和翻译,并提高对葡萄糖刺激信号的敏感性,从而增加胰岛素分泌量[11]。Pdx-1基因对胰岛细胞增长和胰岛细胞基因转录具有重要作用,实验证实用GLP-1及其类似物注射大鼠和兔子能够增加Pdx-1基因的表达水平[12]。GLP-1还通过与α细胞上的GLP-1R作用抑制胰高血糖素的分泌[13],或者间接通过促进胰岛素和生长抑素的分泌来抑制胰高血糖素的分泌[14]。GLP-1对于调节胃排空速率和餐后血糖浓度的动态平衡可能是通过迷走神经起作用[15]。研究发现GLP-1及其类似物能够抑制胰岛β细胞的凋亡,用GLP-1与人胰岛细胞共同孵育能够降低细胞内凋亡基因的表达,抑制其死亡,动物实验也证实在Zucker和db/db小鼠体内注射GLP-1后,β细胞的凋亡数量比对照组减少了20%[16]。GLP-1在体内能够迅速地被二肽基肽酶4(DPP4)所降解而失去活性,见图2,这是造成其半衰期缩短(约2 min)的直接原因。DPP4能够识别并特异性切割GLP-1 N端的丙氨酸,造成GLP-1由活性形式GLP-1(7-37)变为失活形式GLP-1(9-37)。而且由于其失活形式在体内的代谢速率较慢,GLP-1与活性形式的GLP-1(7-37)竞争性的与GLP-1R相结合,对胰岛素分泌和释放产生不利作用。另外,一种结合于膜上的锌金属肽酶NEP 24.11也能于6个可能的识别位点上降解GLP-1[17],这种酶在肾脏中高度表达,而肾脏也是GLP-1被快速代谢而失活的重要场所[18]。据此可推断,NEP 24.11也参与了GLP-1的体内代谢。
3 GLP-1受体激动剂
3.1 艾赛那肽(Exenatide) 艾赛那肽是由美国Amylin公司和Lilly公司联合研制的基于Exendin-4的化学合成多肽,商品名为百泌达。Exendin-4是从毒蜥唾液中分离得到的一种多肽类物质,全长39个氨基酸,比GLP-1多9个氨基酸,见图3。艾赛那肽与GLP-1有53%的同源性,N端的同源性更是高达80%。该多肽与GLP-1有同样的促胰岛素分泌的作用,相比原生GLP-1,其与GLP-1R有很强的结合能力(大于1 000倍)。由于Exendin-4 N端的第2个氨基酸为甘氨酸,能够耐受血浆中DPP-IV的分解,C端比GLP-1多9个氨基酸,不易被肽链内切酶降解,所以其稳定性远高于GLP-1。艾赛那肽同样具有葡萄糖依赖性促进胰岛素分泌、抑制胰高血糖素分泌及减慢胃排空等生理功能,其血浆半衰期长达60~90 min。2005年被美国和欧洲批准用于口服二甲双胍等糖尿病药物无效的T2DM患者的辅助治疗,给药方式为每2 d 1次。艾赛那肽能够显著降低患者的糖化血红蛋白(HbA1c),调节餐后及空腹血糖水平,增强胰岛β细胞功能,降低体质量[19],且不会引起血糖过低。临床数据显示,2次/d注射10 mg艾赛那肽患者的HbA1c水平降低了0.8%~0.9%;2次/d注射5 mg艾赛那肽患者的HbA1c水平降低了0.4%~0.6%;安慰剂组患者的HbA1c水平上升了0.1%~0.2%[20]。1项为期3年的跟踪研究结果显示,2次/d注射10μg艾赛那肽的患者,其HbA1c水平一直保有1.0%左右的降低水平,46%患者的HbA1c水平始终保持在7%的降低水平以下,3年内体质量平均降低5.3 kg[21]。艾赛那肽还显示出与胰岛素的协同作用,实验证实注射艾赛那肽的患者降低了对速效胰岛素的需求量[22]。尽管如此,临床实验显示其仍具有一定的不适反应,如恶心(57%)、呕吐(17%)等,降低药量并持续治疗后症状减轻;有极少数患者产生胰腺炎等严重不良反应,但并没有直接证据证明其与艾赛那肽有直接关系[23]。
3.2 艾赛那肽LAR 艾赛那肽LAR是由Amylin,Alkermes和EliLilly公司共同开发的一种由聚合物微球包裹的Exena⁃tide长效释放制剂,目前在美国和加拿大已进入Ⅲ期临床研究阶段,给药方式为每周皮下注射1次。其采用多聚乳酸-羟基乙酸与艾赛那肽混合而成,这种微球颗粒可被人体自然降解,是一种用于缓释药物的成分,见图3。包裹后的艾赛那肽表现出24 h缓释效果,全天都能检测到血液中治疗浓度的药物。根据一项295例患者参与的长达30周的随机对照实验结果,一周注射2 mg艾赛那肽LAR的患者与2次/d注射10 μg艾赛那肽的患者相比,艾赛那肽LAR能够更有效的降低HbA1c(1.9%vs 1.5%)并降低体质量(3.7 kg vs3.6 kg)[24]。然而一项30周的随机对照研究显示[25],艾赛那肽LAR与艾赛那肽相比,恶心(26%vs35%)和呕吐(11%vs19%)等典型不良反应降低,但是抗体产生概率高于艾赛那肽,且注射部位瘙痒现象也更为明显(18%vs1%)。
3.3 利拉鲁肽(Liraglutide) 利拉鲁肽又叫做NN2211,由诺和诺德公司研发,其氨基酸序列与人GLP-1具有97%的同源性,其34位的赖氨酸被精氨酸取代,并在26位赖氨酸上经由γ-谷氨酸连接上了1个16碳脂肪酸,该脂肪酸能在进入血浆后与白蛋白形成非共价结合,见图3,使利拉鲁肽抵抗DPP4的降解作用,同时起到缓释作用,半衰期为10~14 h,给药方式为1次/d。另外利拉鲁肽还能在注射点形成微团样聚集物,从而降低对DPP4降解的分子易感性[26]。一项超过4 000名患者参与的Ⅲ期临床实验表明,单用1.2 mg和1.8 mg利拉鲁肽比格列美脲(8 mg)等口服降糖药能够更明显地降低患者的HbA1c、空腹及餐后血糖,并减轻体质量[27]。另有实验证实利拉鲁肽比GLP-1能够更明显的抑制β细胞的凋亡[28],也能增加人β细胞的功能[29],增加胰岛素的生物合成[30]。此外其还可以控制患者收缩压,调节心血管功能[31]。利拉鲁肽的不良反应包括恶心、呕吐和轻微头痛,三分之二的患者在1~3 d内症状消失。利拉鲁肽与艾赛那肽相比有更低的抗体反应,这可能是由于其与艾赛那肽相比,利拉鲁肽与原生GLP-1有较高的同源性。
3.4 CJC-1131 CJC-1131是由ConjuChem公司利用其专利技术“药物亲和复合体”(drug affinity complex,DAC)开发的一种GLP-1类似物,其C末端具有一个化学合成的连接子,皮下注射后可以与人血清白蛋白34位的赖氨酸共价结合,并能够耐受DPP4的降解,体内半衰期较长(健康人约为8.9~14.7 d;T2DM患者约为9.1~13.8 d),目前处于Ⅲ期临床阶段。临床数据显示其能够降低患者血糖和体质量,体外实验证实其能够增加cAMP水平,不良反应包括恶心、呕吐,多发生在给药后。
3.5 其他GLP-1受体激动剂 除上述GLP-1受体激动剂外,还有一些处于研发及早期临床阶段的GLP-1受体激动剂,这些新的激动剂有望在延长半衰期的同时进一步减轻胃肠不良反应。LY2189265是一种GLP-1类似物与Fc片段的融合蛋白,LY2428757是一种聚乙二醇GLP-1类似物,给药周期都达到了1周1次,二者分别处于Ⅱ期和Ⅲ期临床阶段。CJC-1134-PC是Exendin-4与人血清白蛋白的融合蛋白,半衰期约为8 d;葛兰素史克研发的Albiglutide也是GLP-1与白蛋白的复合物,正处于Ⅲ期临床阶段,二者给药周期都达到了1周1次。Semaglutide(NN9535)是诺和诺德公司研发的另一长效GLP-1类似物,已完成Ⅱ期临床试验,预计给药周期为1周1次[32]。同时诺和诺德公司还在研发口服型GLP-1类似物(NN9924)以增加患者适用度,计划于2011年1月进入Ⅰ期临床试验[33]。另外,关于GLP-1受体的小分子激动剂也在研究之中。2007年Chen等[34]通过高通量筛选方法获得的取代环丁烷Boc5具有较好的降糖作用,其能够促进分离大鼠胰岛中葡萄糖刺激的胰岛素分泌,降低ob/ob小鼠糖化血红蛋白,降低进食量,并且这些作用均能被GLP-1降解产物GLP-1(9-39)竞争性抑制,提示它可能是一种非肽类GLP-1受体激动剂。Murphy等[35]发现另外一种GLP-1R小分子激动剂Cpd1能够与GLP-1R结合,且不被GLP-1类似物竞争性抑制,推测其可能结合于GLP-1R活性中心外并激活受体,同时增加GLP-1与受体的亲和力。Boc5等化合物的出现有可能会对GLP-1受体激动剂的研发开拓新思路。
4 GLP-1受体激动剂的局限性
GLP-1及其类似物的相关研发虽然已经取得了不错的进展,多种类似物也进入了临床试验阶段,然而由于多肽类药物具有一个共同的弊端,即不能口服给药,只能通过皮下注射,因此对于长期用药的T2DM患者来说其依从性仍旧不高。而且由于多肽类药物的特性,其稳定性依赖于时间、温度及pH值,如何保证这些GLP-1类似物的活性将会是个问题(虽然艾赛那肽和利拉鲁肽未出现稳定性相关报道)。另外,由于这些激动剂都为人体引入了外源蛋白,可能会引发机体的免疫反应。
5 展望
GLP-1及其受体激动剂所具有的诸如葡萄糖依赖性的促进胰岛素分泌和生物合成、抑制胰高血糖素的分泌、促进胰岛β细胞增殖、抑制胰岛β细胞凋亡、保存β细胞对血糖的敏感性、抑制胃肠道蠕动和胃液分泌、延迟胃排空等多种生理学特性,以及其较少的不良反应使得其成为治疗T2DM的核心药物,近几年各大药物研发公司都在努力开发新的GLP-1受体激动剂。相信在不久的未来,必将出现更多更好的治疗T2DM的GLP-1受体激动剂药物,造福广大T2DM患者。

Figure1 Pruduct after Translation of Proglucagon Genein Different Tissue图1 胰高血糖素原基因在不同组织中的翻译后产物
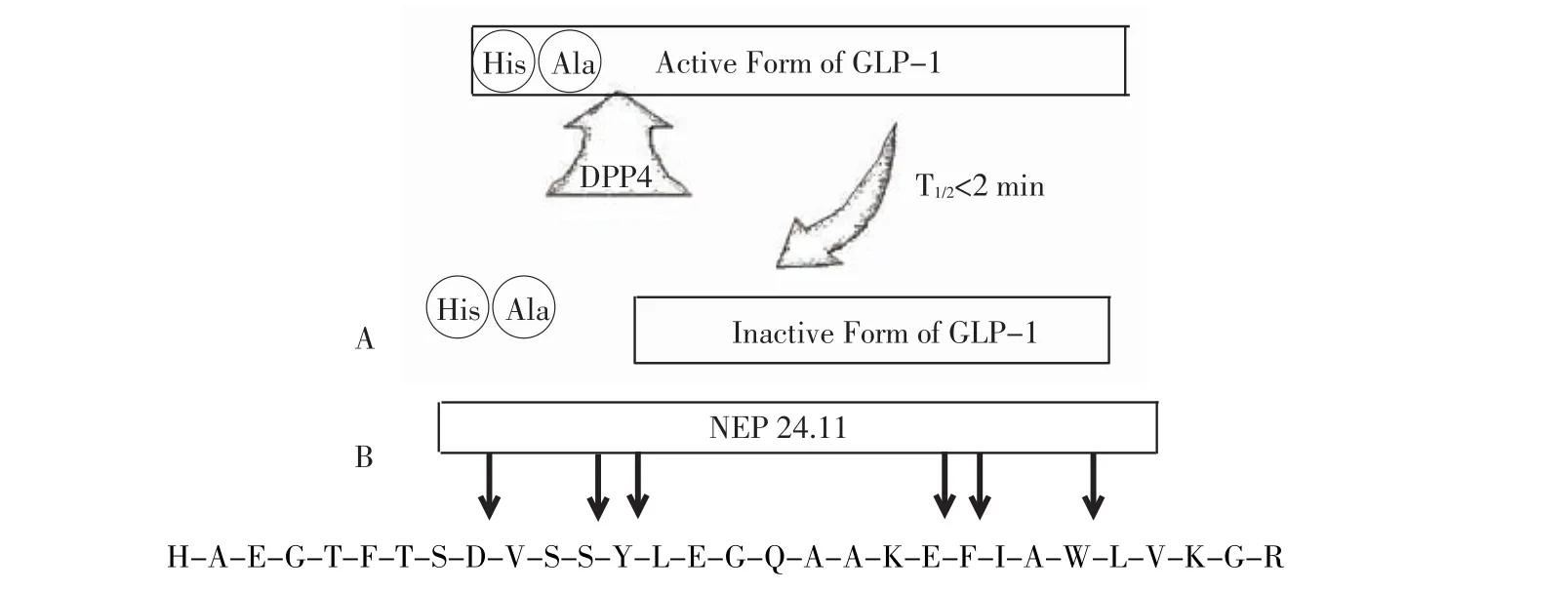
Figure2 Schemeof GLP-1 degradation and inactivation by DPP4(A)and recognition siteof NEP24.11 in GLP-1(7-36)(B)图2 A:GLP-1被DPP4降解而失活;B:NEP24.11对GLP-1(7-36)的识别位点

Figure3 Structuresof human GLP-1,liraglutide,exenatideand exenatide-LAR图3 人GLP-1、利拉鲁肽、艾赛那肽及艾赛那肽LAR的结构
[1]Zimmet P,Alberti KG,Shaw J.Global and societal implications of thediabetesepidemic[J].Nature,2001,414(6865):782-787.
[2]Kieffer TJ,Habener JF.The glucagon like peptides[J].Endocr Rev,1999,20(6):876-913.
[3]Vilsboll T,Zdravkovic M,Le-Thi T,etal.Liraglutide,a long-acting human GLP-1 analog,given asmono therapy significantly improves glycemic control and lowers body weight without risk of hypoglyce⁃mia in patientswith type2 diabetes mellitus[J].Diabetes Care,2007,30(6):1608-1610.
[4]Nikolaidis LA,Doverspike A,Hentosz T,etal.Glucagon-like pep⁃tide-1 limits myocardial stunning following brief coronary occlu⁃sion and reperfusion inconscious canines[J].Pharmacol Exp Ther,2005,312(1):303-308.
[5]Nauck MA,El-Ouaghlidi A,Gabrys B,etal.Secretion of incretin hormones(GIPand GLP-1)and incretin effect after oral glucose in first-degree relatives of patients with type 2 diabetes[J].Regulatory Peptides,2004,122(3):209-217.
[6]Shirazi-Beechey SP,Moran AW,Batchelor DJ,etal.Glucose sens⁃ing and signalling;regulation of intestinal glucose transport[J].Proc Nutr Soc,2011,70(2):185-193.
[7]Anini Y,Hansotia T,Brubaker PL.Muscarinic receptors control postprandial release of glucagon-like peptide-1:in vivo and in vi⁃trostudies in rats[J].Endocrinology,2002,143(6):2420-2426.
[8]Kenakin T,Miller LJ.Seven transmembrane receptors as shapeshift⁃ing proteins:the impact of allosteric modulation and functional se⁃lectivity on new drug discovery[J].Pharmacol Rev,2010,62(2):265-304.
[9]Stoffers DA,Kieffer TJ,Hussain MA,etal. Insulinotropic gluca⁃gon-likepeptide1 agonistsstimulateexpression of homeodomain pro⁃tein IDX-1 and increase islet size inmouse pancreas[J].Diabetes,2000,49(5):741-748.
[10]Heller RS,Kieffer TJ,Habener JF.Insulinotropic glucagon-like peptide 1 receptor expression in glucagon-producing alpha-cells of therat endocrinepancreas[J].Diabete s,1997,46(5):785-791.
[11]Al-Sabah S,Donnelly D.A model for receptor peptide binding at the glucagon like peptide 1(GLP-1)receptor through the analysis of truncated ligands and receptors[J].Br JPharmacol,2003,140(2):339-346.
[12]Tornehave D,Kristensen P,Rømer J,etal.Expression of the GLP-1 Receptor in Mouse,Rat,and Human Pancreas[J].JHistochem Cyto⁃chem,2008,56(9):841-851.
[13]Alvarez E.Martinez MD,Roncero I,etal.The expression of GLP-1 receptor mRNA and protein allows the effect of GLP-1 on glucose metabolism in the human hypothalamus and brainstem[J].Neuro⁃chemistry,2005,92(4):798-806.
[14]Mérida E,Delgado E,Molina LM,etal.Presence of glucagon and glucagon-like peptide-1-(7-36)amide receptors in solubilized membranes of human adipose tissue[J].Clin Endocrinal Me tab,1993,77(6):1654-1657.
[15]Valverde E,Diaz de Rada O,Burrell MA,etal.Immunocytochemical and ultrastructural characterization of endocrine cells and nerves in theintestineof Ranatemporaria[J].Tissue Cell,1993,25(4):505-516.
[16]Toyoda K,Okitsu T,Yamane S,etal.GLP-1 receptor signaling pro⁃tects pancreatic beta cells in intraportal islet transplant by inhibit⁃ing apoptosis[J].Biochem Biophys Res Commun,2008,367(4):793-798.
[17]Plamboeck A,Holst JJ,Carr RD,etal.Neutral endopeptidase 24.11 and dipeptidyl peptidase IV are both mediators of the degradation of glucagon-like peptide 1 in the anaesthetised pig[J].Diabetologia,2005,48(9):1882-1890.
[18]Hupe-Sodmann K,McGregor GP,Bridenbaugh R,etal.Characteri⁃sation of the processing by human neutral endopeptidase 24.11 of GLP-1(7-36)amide and comparison of the substrate specificity of theenzymefor other glucagon-like peptides[J].Regul Pept,1995,58(3):149-156.
[19]Schwartz SL,Ratner RE,Kim DD,etal.Effect of exenatide on 24-hour blood glucose profile compared with placebo in patients with type 2 diabetes:a randomized,double-blind,two-arm,paral⁃lel-group,placebo-controlled,2-week study[J].Clin Ther,2008,30(5):858-867.
[20]Kendall DM,Riddle MC,Rosenstock J,etal.Effects of exenatide(exendin-4)on glycemic control over 30 weeks in patients with type 2 diabetes treated with metformin and a sulfonylurea[J].Diabetes Care,2005,28(5):1083-1091.
[21]Klonoff DC,Buse JB,Nielsen LL,etal.Exenatide effects on diabe⁃tes,obesity,cardiovascular risk factors and hepatic biomarkers in patients with type 2 diabetes treated for at least 3 years[J].Curr Med Res Opin,2008,24(1):275-286.
[22]Viswanathan P,Chaudhuri A,bhatia R,etal.Exenatide therapyin obese patients with type 2 diabetes mellitus treated with insulin[J].Endocr Pract,2007,13(5):444-450.
[23]Amori RE,Lau J,Pittas AG.Efficacy and safety of incretin therapy⁃in type 2 diabetes:systematic review and meta-analysis[J].JAMA,2007,298(2):194-206.
[24]Kim D,MacConell L,Zhuang D,etal.Effects of once-weekly dos⁃ingof a long-actingrelease formulation of exenatide on glucosecon⁃trol and body weight in subjects with type 2 diabetes[J].Diabetes Care,2007,30(6):1487-1493.
[25]Drucker DJ,Buse JB,Taylor K,etal.Exenatide once weekly versus twice daily for the treatment of type 2 diabetes:a randomised,open-label,non-inferiority study[J].Lancet,2008,372(9645):1240-1250.
[26]Knudsen lb,Nielsen PF,Huusfeldt PO,etal.Potent derivatives of glucagon-like peptide-1 with pharmacokinetic properties suit-able for once daily administration[J]. MedChem,2000, 43(9):1664-1669.
[27]Garber A,Henry R,Ratner R,etal.Liraglutide versus glimepiride monotherapy for type 2 diabetes(LEAD-3 Mono):a randomized,52-week,phase III,double-blind,parallel-treatment trial[J].Lan⁃cet,2009,373(9662):473-481.
[28]Bregenholt S,Moldrup A,blume N,etal.The long-acting gluca⁃gon-like peptide-1 analogue,liraglutide,inhibits beta-cell apopto⁃sis in vitro[J].Biochem biophys ResCommun,2005,330(2):577-584.
[29]VilsbolløT,Brock B,Perrild H,etal.Liraglutide,a once-daily hu⁃man GlP-1 analogue,improves pancreatic B-cell function and argi⁃nine-stimulated insulin secretion during hyperglycaemia in pa⁃tients with Type 2 diabetes mellitus[J].Diabet Med,2008,25(2):152-156.
[30]Buse Jb,Rosenstock J,Sesti G,etal.Liraglutide once a day versus exenatide twice a day for type 2 diabetes:a 26-week randomized,parallel-group,multinational,open-label trial(lEAD-6)[J].lancet,2009,374(9683):39-47.
[31]Vilsbll T,Zdravkovic M,Le-thi T,etal.Liraglutide,a long-acting human glucagon-like peptide analog,given as mono-therapy signif⁃icantly improves glycemic control and lowers body weight without risk of hypoglycemica in patients with type 2 diabetes[J].Diabetes Care,2007,30(6):1608-1610.
[32]Baggio LL,Huang Q,Cao X,etal.An albumin-exendin-4 conju⁃gate engages central and peripheral circuits regulating murine ener⁃gy and glucose homeostasis[J].Gastroenterology,2008,134(4):1137-1147.
[33]A Bhansali,D Maji,PV Rao,etal.Historical Overview of Incretin Based Therapies[J].Supplement to JAPI,2010,58:12-13.
[34]Chen D,Liao J,Li N,etal.A nonpeptidic agonist of glucagon-like peptide 1 receptors with efficacy in diabetic db/db mice[J].Proc Natl Acad Sci USA,2007,104(3):943-948.
[35]Murphy KG,Bloom SR.Nonpeptidic glucagon-like peptide 1 recep⁃tor agonists:a magic bullet for diabetes[J]?Proc Natl Acad Sci USA,2007,104(3):689-690.
