喷射蒸煮处理对米糠蛋白功能特性及体外消化性的影响
2012-11-28王金梅周小玲杨晓泉
夏 宁 胡 磊 王金梅 周小玲 杨晓泉
喷射蒸煮处理对米糠蛋白功能特性及体外消化性的影响
夏 宁1,2胡 磊1王金梅1周小玲1杨晓泉1
(华南理工大学轻工与食品学院1,广州 510640)
(广西大学轻工与食品工程学院2,南宁 530004)
研究了喷射蒸煮(HTC)处理对天然米糠蛋白(RBP)与热稳定米糠蛋白(HRBP)提取的影响,并对蛋白的粒度、亚基组成、接枝度、功能性及体外消化性能进行表征。研究表明:HTC处理能显著提高RBP与HRBP的得率(分别从44.9%与14.8%增加到52.2%与44.5%),但对蛋白的纯度没有显著影响。HTC处理后RBP与HRBP的粒度分别从73.6 nm与149.1 nm 降低到46.8 nm与96.6 nm,同时生成接枝度28.0%与9.4%的糖基化产物。SDS-PAGE电泳图谱表明,处理后的米糠蛋白生成高分子质量的蛋白聚集体与糖基化产物。HTC处理更有利于HRBP功能性与消化性的提高,且HRBP具有RBP类似的溶解度曲线、起泡能力、泡沫稳定性与良好的乳化能力与消化能力,尽管该处理降低了天然米糠蛋白的消化性。
热稳定化米糠 天然米糠 米糠蛋白 喷射蒸煮 起泡特性 乳化特性 体外消化
米糠是一种未被充分利用的大米加工的副产物,蛋白占总质量的11.3% ~14.9%[1],尽管含量较低,但米糠产量巨大,仍具有很强的应用潜力。此外米糠蛋白因其良好的营养及功能特性,使其受到越来越多的关注[2-3]。目前,对米糠蛋白的研究主要集中在提取与功能性研究上,但是由于米糠自身的组成复杂,包括大量的淀粉、纤维素、植酸和灰分,复杂的蛋白组成(包括37%清蛋白、36%球蛋白、22%谷蛋白与5%醇溶谷蛋白)[4],以及在加工和贮藏过程中为抑制脂肪酶的活性所进行的热稳定化处理。常见的米糠稳定化处理包括干热、湿热、微波及挤压稳定化处理,均会对米糠中的营养物质造成损失,从而影响到米糠蛋白的提取。
Prakash等[5]利用传统的碱溶酸沉方法,分别从天然米糠和热稳定米糠中提取纯度为71.0%与39.5%的浓缩蛋白,但高的提取率是以高的碱液浓度为代价,容易导致蛋白变性,生成有害的赖胺酰胺。Hamada[6]报道使用碱性蛋白酶获得高提取率的米糠分离蛋白,蛋白提取率随着水解度的增加而增加,当水解度达到10%时,蛋白提取率可达到92%,然而过度的水解使得大部分蛋白产品风味较差,均含苦味肽段。Anderson 等[7]和 Tang 等[8]分别采用不同的物理处理对不同来源的米糠进行处理,研究表明物理处理能够保留蛋白的品质,但很难提高米糠蛋白的提取率,尤其对热稳定米糠的影响更小。上述提到的几种提取方法难以得到得率、纯度、功能性质都相对完备的产品。
喷射蒸煮技术(HTC)作为高温高剪切力作用下的水热技术已经用在对挤出-压榨法制备的变性豆粕上,能有效提高变性豆粕的蛋白溶出率[9],改善蛋白质功能性质。本研究采用喷射蒸煮技术对天然米糠与热稳定米糠进行处理,制备具有一定纯度和得率的米糠蛋白,并对制得的蛋白结构、功能性质和消化特性进行表征与比较,为喷射蒸煮技术在植物难溶蛋白提取工业化应用上提供理论支持。
1 材料与方法
1.1 材料与设备
天然米糠、热稳定化米糠:山东中稻公司提供;胃蛋白酶(效价1∶10000)、胰蛋白酶(效价1∶250):美国Sigma公司;标准分子质量:北京鼎国生物科技公司;其他试剂均为分析纯。
CR22G型冷冻离心机:日本Hitachi公司;Mastersize2000粒度分布仪、Zeta电位、纳米粒度分布仪:英国Malvern公司;喷射蒸煮发生器:广州南联食品机械公司;DYCZ-30型电泳槽、ECP3000三恒电泳仪:北京六一仪器厂。
1.2 试验方法
1.2.1 米糠蛋白的制备
分别称取一定量的天然米糠与热稳定米糠与去离子水按料液比1∶15混合,调pH 9.0,室温搅拌1 h后,8 000×g离心20 min。上清液调pH至等电点4.0沉淀蛋白质,8 000×g离心20 min后,蛋白沉淀水洗、复溶,冷冻干燥后即得米糠蛋白对照样品HRB与RB。
喷射蒸煮处理:将搅拌1 h的料液置于喷射蒸煮器中120℃处理60 s,其余操作同对照样品,分别为HRB-HTC与RB-HTC。蛋白质含量采用微量凯氏定氮法测定,蛋白质转化系数5.95。
1.2.2 蛋白粒度及接枝度
米糠蛋白粒径的测定采用纳米粒度分布仪。蛋白溶于pH 7.2、10 mmol/L的磷酸缓冲液并稀释至0.2%,过0.45μm滤膜,25℃进行测量,取3次测量平均值。米糠蛋白接枝度测定采用OPA方法[10],通过对样品游离氨基酸含量的测定反映在喷射蒸煮前后蛋白发生糖基化反应的程度。
1.2.3 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDSPAGE)
米糠蛋白的SDS-PAGE根据 Laemmli报道的方法[11]。分离胶质量分数为15%,浓缩胶质量分数为5%。称取2.0 mg蛋白,加入200μL电泳缓冲液,混匀,沸水煮5 min。上样量10μL,凝胶电泳于恒流下进行,浓缩胶电流40 mA,进入分离胶后电流调为80 mA。凝胶分别采用0.25%考马斯亮蓝(R-250)溶液与PAS染色电泳来分析普通蛋白与糖基化产物中多糖的存在。
1.2.4 溶解度
取1.000 g米糠蛋白加入100 mL水,室温下搅拌30 min。在搅拌过程中用1 mol/L的NaOH溶液调溶液 pH 为 2.0,3.0,4.0,4.5,5.0,6.0,7.0,8.0,9.0,10.0。10 000 ×g离心30 min 后,测定上清液中的蛋白质含量。上清液的蛋白总含量与样品蛋白总含量的比值即为溶解度。
1.2.5 米糠蛋白制备的乳液性质
米糠蛋白乳液的制备:将一定质量的米糠蛋白分散溶于蒸馏水制备出蛋白质量分数1%的贮备液4℃存放备用。将蛋白和玉米油按1:20的比例混合,将样品于室温下搅拌0.5 h以上,确保充分混合。在均质前将混合液经高速剪切机5 000 r/min混合2 min,得到粗乳浊液,然后经高压均质机40 MPa,均质2次,得到不同的米糠蛋白乳液。
米糠蛋白乳液粒度的测定:采用Mastersizer 2000粒度分布仪测定乳液粒径大小。颗粒折射率:1.520;颗粒吸收率:0.001;分散剂:水;分散剂折射率:1.330;泵的转速:2 500 r/min。试验采用表面积平均粒径(d32)、体积平均粒径(d43)表征液滴粒度的大小。
米糠蛋白乳液 ζ-电位的测定:将乳液用5 mmol/L缓冲液稀释50倍,采用Nanoseries ZS电位测定仪测定乳液的电位大小。
1.2.6 起泡性
配制100 mL 1%米糠蛋白溶液,用高速分散均质机均质5 000×g均质2 min,快速移至100 mL的量筒,记录泡沫所占的体积,记为V0,用以评估蛋白溶液起泡能力大小。
将装有溶液的量筒放在(30±1)℃的水浴锅中静置30 min后,记录泡沫的残留体积Vr。V0与Vr可用于计算泡沫稳定性,泡沫稳定性 =(Vr/V0)×100%
1.2.7 体外消化
米糠蛋白的体外消化试验根据Nunes等[12]报道的体外消化模型进行,氮释放量的测定采用TCA-NSI法。具体操作步骤如下:取适量蛋白样品溶于pH 1.5的HCl溶液形成1%的分散液,置于37℃水浴锅中预热3~5 min,然后加入适量的胃蛋白酶进行酶解。分别在不同消化时间(0、1、5、10、30、60 和120 min)取样待测,所取的样品调至pH 7.0中止反应。待胃蛋白酶消化结束(120 min)后,调节至pH 7.0,加入适量的胰蛋白酶再消化120 min,期间在不同消化时间(0、1、5、10、30、60 和 120 min)取样待测。同时对体外消化过程中的亚基降解情况进行SDSPAGE 的分析,具体方法见1.2.3。
1.3 统计分析
所有数据都是3次测定的平均值,利用一维方差分析的LSD比较样品平均值之间的差异显著性。
2 结果与讨论
2.1 米糠蛋白的提取
HTC处理前后米糠蛋白的提取率与纯度如图1所示。对天然米糠而言,传统的碱溶酸沉方法能提出44.9%,纯度为73.1%的米糠蛋白,而对热稳定米糠而言,只能提出14.8%,纯度68.1%的蛋白。120℃、60 s的HTC处理能显著提高天然米糠与热稳定化米糠的蛋白提取率分别达到52.2%与44.5%,且对热稳定米糠的影响更大,但是该处理对蛋白的纯度的影响并不大,所有蛋白样品的纯度范围为68.1%~73.1%。热稳定米糠蛋白提取率低于天然米糠的原因是由于米糠的热稳定化处理会导致蛋白的变性聚集,从而降低蛋白的提取[8]。HTC处理后提取率提高的原因可能是由于料液中难溶的蛋白在120℃的高温与高剪切力的作用下,蛋白分散性增加,并降低其粒度,从而提高蛋白的溶解度。类似的现象也出现在HTC辅助提取挤压变性的大豆蛋白的研究上[9]。

图1 HTC处理对米糠蛋白提取率与纯度的影响
2.2 米糠蛋白的结构特性
2.2.1 蛋白粒度大小及接枝度分析
不同米糠HTC处理前后蛋白的粒度数据如表1所示。HTC处理后,HRB与RB的粒径分别从149.1 nm 与73.6 nm 降低到96.6 nm 与 46.8 nm,蛋白的粒径显著降低,且来源于热稳定米糠的蛋白粒径明显大于天然米糠蛋白。这主要是由于米糠在热稳定化过程中,天然的米糠蛋白容易变性聚集生成富含二硫键的聚集体,使得蛋白粒径增加[8]。但是HTC处理中的高温高湿条件,又会进一步使这些大的聚集体解离,从而降低蛋白的粒径,这也可能是蛋白提取率提高的主要原因。另外,对HTC处理前后米糠蛋白与米糠中的还原糖的接枝情况的分析表明,热稳定米糠蛋白与天然米糠蛋白的接枝度分别为9.4%与28%。这说明部分蛋白的游离氨基可能在HTC的湿热处理后,与米糠中的还原糖在发生美拉德反应,生成富含糖链的分子质量更大的糖基化产物,从而引起蛋白功能性质的改善与提高。且生成的糖基化产物在米糠蛋白的PSA染色的聚丙烯酰胺凝胶电泳中也可以观察到。

表1 不同米糠蛋白的平均粒径与接枝度
2.2.2 米糠蛋白亚基特性分析
对米糠蛋白的SDS-PAGE图谱分别进行考马斯亮蓝和PSA糖染色来反映HTC处理前后提取的米糠蛋白的亚基结构与糖基化产物的变化。从图2考马斯亮蓝染色的SDS-PAGE图谱反映对照的热稳定米糠蛋白与天然米糠蛋白分子质量范围主要由在43 000~97 400 u,20 100~43 000 u和< 20 100 u的电泳条带组成。HTC处理后,在HRB-HTC的条带2与RB-HTC的条带4的浓缩胶的入口和浓缩胶与分离胶的交界面都出现大的聚集体,且不能被还原剂β-巯基乙醇降解,说明这些高分子质量的聚集体有可能是由生成的糖基化产物组成。对该蛋白的电泳条带进行PSA糖染色来分析发现:HTC处理后,在HRB-HTC的条带2与RB-HTC的条带4浓缩胶的入口和浓缩胶与分离胶的交界面出现高分子质量的糖染色的特征谱带,且条带4的染色强度高于条带2,这与RB-HTC蛋白的接枝度高于HRBHTC蛋白接枝度的数据是一致的(表1),这表明米糠中部分蛋白和还原糖在HTC的热处理过程中以共价键形式结合,生成分子质量较大的糖基化产物。蛋白质肽链上糖链的引入,增加了蛋白的溶解性,从而改善蛋白的结构与性质。

图2 不同米糠蛋白组分的SDS-PAGE蛋白染色与糖染色图谱
2.3 米糠蛋白的功能特性
2.3.1 米糠蛋白溶解度
溶解度直接影响蛋白质的提取、纯化、分离条件与功能性质,与蛋白空间结构有密切关系,此外也受到温度、pH等环境因素的影响。图3为4种米糠蛋白的溶解度-pH曲线。在等电点附近(pH 4.0~5.0),蛋白的溶解度最低;在高 pH条件下(pH>7.0),净的负电荷的增加有利于溶解度的迅速增加,而在低pH条件下(pH<3.0),溶解度的增加取决于正电荷的增加,且在碱性条件的蛋白溶解性明显高于酸性条件。从图3中还可以观察,来源于热稳定米糠的蛋白对照样品的等电点在pH 4.0左右,低于其他3个样品。这种等电点向低pH漂移的原因可能是由于天然米糠蛋白在热稳定化过程中发生的强烈的聚集,形成二硫键交联的蛋白聚集体。但对米糠进行喷射蒸煮处理后,米糠蛋白溶解度的改变,一方面可能与可能热处理中难溶的蛋白聚集体变性展开形成新的可溶性聚集体有关,另一方面可能与在该处理过程中形成的糖基化产物有关,即蛋白上糖链的引入,羟基的亲水特性有助于蛋白的溶解。
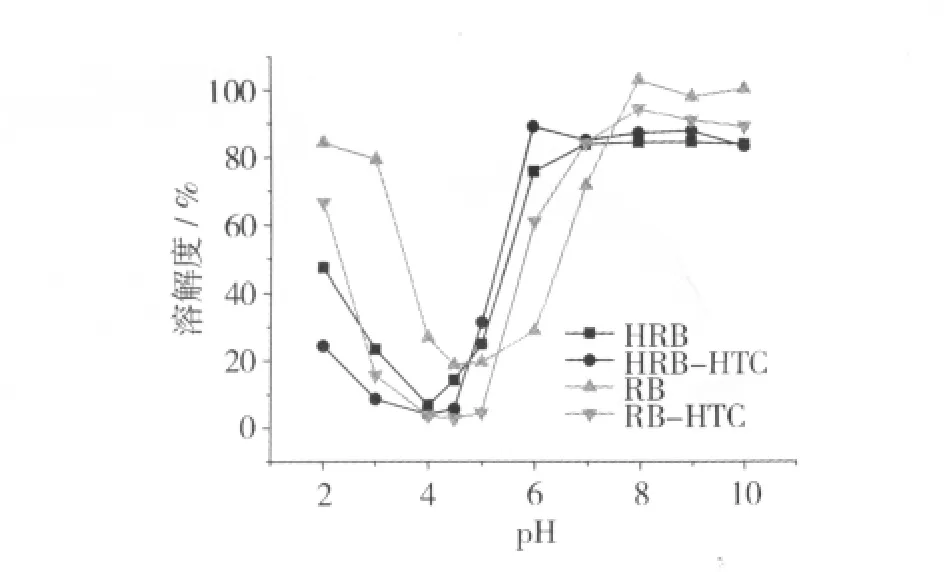
图3 米糠蛋白的溶解度曲线
2.3.2 米糠蛋白起泡性
蛋白质的起泡能力与起泡稳定性反映了蛋白在降低水和空气界面表面张力的能力,与蛋白质分子结构密切相关,应用到食品体系中能增加产品的体积又起到酥松的作用。由表2可知,来源于天然与热稳定化米糠的蛋白呈现出完全不同的起泡容量与起泡稳定性,天然米糠蛋白的起泡容量为41.8 mL,显著高于热稳定米糠蛋白的27.8 mL;当对米糠进行HTC处理后,热稳定米糠蛋白的起泡容量增加到36.1 mL,而天然米糠蛋白的起泡容量没有明显变化。从表2也可以观察,两种蛋白的泡沫稳定性与起泡容量有着类似的变化趋势,即天然米糠蛋白具有较高的起泡稳定性,而HTC处理有利于改善热稳定米糠的稳定性。这种变化的原因一方面可能是由于HTC处理使热稳定米糠蛋白聚集体分子展开,分子柔性增加,容易吸附在气-水界面上;另一方面可能与接枝后的蛋白容易吸附在气-水界面上,形成立体的网络结构,增加了膜的厚度和机械强度,有利于泡沫的稳定性的提高。

表2 米糠蛋白的起泡特性与其稳定的乳液表面积平均粒径(d32)、体积平均粒径(d43)与ζ-电位
2.3.3 米糠蛋白乳液性质
利用4种米糠蛋白稳定的乳液表面积平均粒径(d32)、体积平均粒径(d43)与ζ-电位如表2所示。天然米糠蛋白制备的乳液d32与d43分别为2.83μm与4.15μm,高于热稳定米糠蛋白制备的乳液粒径2.48μm与3.27μm,相应的RB的ζ-电位的绝对值(-40.30 mV)却低于 HRB 样品(-47.00 mV)。HTC处理天然与热稳定化米糠后,蛋白乳液的d32与d43都有显著降低,但是相对应得ζ-电位的绝对值反而增加,反映了HTC处理后的蛋白乳液具有更好的乳化特性。HTC处理导致乳液特性改变的原因一方面可能是由于HTC的热处理导致米糠蛋白结构展开,暴露出更多的疏水基团,聚集在油相的表面,降低蛋白的界面张力,形成油滴表面的保护层,阻止油滴聚集,降低乳液的平均粒径,增加乳液的稳定性;另一方面,糖基化产物的生成,使得蛋白溶解度提高,分子间空间位阻增大,更加有效地阻止了油滴的聚集和乳化状态的破坏,因而提高了蛋白的乳化性。
2.3.4 米糠蛋白体外消化性
胃蛋白酶-胰蛋白酶体外试验模拟人体消化HRB,HRB-HTC,RB和RB-HTC的过程来反映米糠蛋白亚基降解的情况。由于米糠蛋白的组分复杂,由清蛋白、球蛋白、谷蛋白和醇溶蛋白组成,且分子质量跨度很大,在电泳图谱上常表现出连续的条带分布。由图4可以看出,在胃蛋白酶消化阶段,4种蛋白在与胃蛋白酶接触的1 min内,其分子质量大于31 000 u的组分几乎被完全裂解,形成分子质量较低的寡肽(见图4的Lane2与Lane15)。但是被HTC处理后提取的HRB-HTC与RB-HTC在随后的2 h,亚基的降解程度要慢于未被处理的蛋白,反映了HTC处理后蛋白的抗消化性略高于未处理的样品。此外,4种蛋白在胰蛋白酶中的消化情况与在胃蛋白酶中的消化情况有些相似,也是在消化开始的1 min内即几乎全部裂解,生成大量分子质量低于14 400 u寡肽,在随后的消化过程中,产生的小分子质量寡肽被继续裂解成分子质量更小的肽(已经难易染色或跑出分离胶)。这与随后的可溶性氮释放情况是一致的。
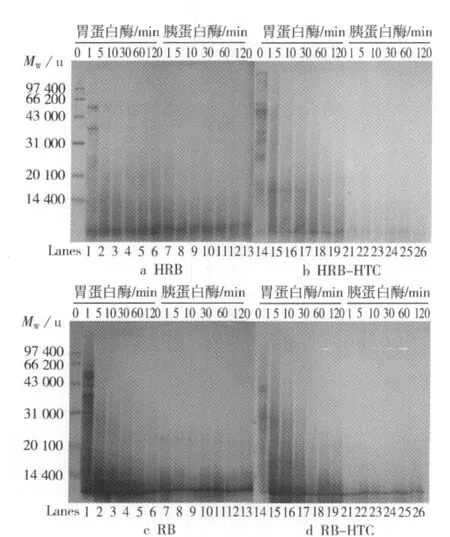
图4 不同米糠蛋白体外消化过程的SDS-PAGE图谱
蛋白体外消化过程中的可溶性氮释放变化情况可以补充SDS-PAGE结果反映蛋白质被消化的情况。如图5所示,在胃蛋白酶消化阶段,4种蛋白质的可溶性氮释放量增加趋势相似,都是在消化的起始阶段(0~30 min)急剧增加,然后增加趋缓,直到胃蛋白酶消化结束而到达最大值。在胃蛋白酶消化的120 min内,HTC处理前后天然米糠蛋白(RB,RBHTC)的可溶性氮释放量分别为50.6%和60.3%,一直高于热稳定米糠蛋白(HRB,HRB-HTC)的36.8%和48.4%,这可能由于热稳定米糠中的蛋白主要以高分子质量的热聚集状态存在,溶解性较低,使得胃蛋白酶作用位点暴露程度不如天然米糠蛋白所致。HTC处理过程中的高温,会导致天然米糠蛋白的热变性与聚集,引起消化性的降低;但HTC对热稳定米糠的处理,相反会引起消化性的增加,原因可能是热稳定化过程中变性的蛋白聚集体会在HTC高温高湿的环境下,聚集的蛋白结构进一步展开,暴露出更多的胃蛋白酶作用位点,有利于酶的作用。在进一步的胰蛋白酶消化阶段,4种蛋白质的可溶性氮释放量的变化趋势基本一样。在最初的1 min内,RB、RB-HTC、HRB与HRB-HTC的可溶性氮释放量分别激增至 69.7%、85.3%、74.9% 与 77.9%,之后则增速降低但趋势一样,至消化结束(120 min)时分别到达 84.4%、93.7%、86.4% 和 86.5% ,这种变化的原因尚不清除。结合SDS-PAGE分析结果,可以认为米糠蛋白容易被消化,非常适合人类食用,且HTC处理有利于热稳定蛋白的消化性能的提高。

图5 不同米糠蛋白体外消化过程中氮释放量的变化
3 结论
本研究以天然米糠与热稳定米糠为原料,采用120℃、60 s的HTC处理提取米糠蛋白,并对蛋白的提取率、纯度、粒度、亚基组成、功能性及消化性能进行表征和比较。HTC处理米糠,尤其是热稳定化米糠,将显著提高蛋白的提取率,但对蛋白的纯度没有显著影响。HTC处理能使难溶的米糠蛋白形成部分可溶性的聚集体或者生成糖基化的产物,这将有助于提高蛋白的溶解度、起泡性、乳化性与消化性。
[1]Juliano B O.Rice:Chemistry and Tech-nology[M].St.Paul,MN:American association of cereal chemists Inc1985:774
[2]Helm RM,Burks A W.Hypoallergenicity of rice bran protein[J].Cereal Foods World ,1996,41:839-843
[3]Kannan A,Hettiarachchy N S.Human colon and liver cancer cell proliferation inhibition by peptide hydrolysates derived from heat- stabilized defatted rice bran[J].Journal of Agricultural and Food Chemistry,2008,56:11643-11647
[4]Betschart A A,Fong RY,Saunders R M.Rice byproducts:Comparative extraction and precipitaiton of nitrogen from U.S.and Spanish bran and germ [J].Journal of Food Science,1977,42:1088-1093
[5]Prakash J,Ramanatham G.Effect of stabilisation treatment of rice bran on nutritional quality of protein concentrates[J].International Journal of Food Sciences and Nutrition,1995,46:177-184
[6]Hamada JS.Characterization and functional properties of rice bran proteins modified by commercial exoproteases and endoproteases[J].Journal of Food Science,2000,65:305- 310
[7]Anderson AK,Guraya H S.Yield of protein in physically processed rice bran[J].Journal of the American Oil Chemists Society,2001,78:969-972
[8]Tang SH,Hettiarachahy N S,Eswaranandam S,et al.Protein Extraction from Heat- stabilized Defatted Rice Bran:II.The Role of Amylase,Celluclast,and Viscozyme [J].Journal of Food Science,2003,68:471-475
[9]Wang H,Wang T,Johnson L A.Effect of alkali on the refunctionalization of soy protein by hydrothermal cooking[J].Journal of the American Oil Chemists’Society,2005,82:451-456
[10]Church F C,Swaisgood H,Porter D H,et al.Spectrophotometric Aaaay Using O-Phtahaldialdehyde for Determination of Proteolysis in Milk and Isolated Milk proteins[J].Journal of Dairy Science,1983,66:1219-1227
[11]Laemmli U K.Cleavage of structural proteins during the assembly of the head of the bacteriophage T4 [J].Nature,1970,227:680- 685
[12]Nunes A,Correia I,Barros A,et al.Sequential in vitro pepsin digestion of uncooked and cooked sorghum and maize samples[J].Journal of Agricultural and Food Chemistry,2004,52(7):2052-2058.
Effect of Hydrothermal Cooking Treatment of Rice Bran on Functional Properties and In Vitro Digestibility of Protein
Xia Ning1,2Hu Lei1 Wang Jingmei1 Zhou Xiaoling1 Yang Xiaoquan1
(College of Light Industry and Food Sciences,South China University of Tech-nology1,Guangzhou 510640)
(Department of Light Industry and Food Engineering,Guangxi University2,Nanning 530004)
Protein concentrates were prepared from un-stabilized and heat-stabilized rice bran by Hydrothermal Teatment Cooking(HTC),and the size,subunit molecular weight distribution,functional property and in vitro digestibility of rice bran protein were also evaluated.HTC evidently improved the protein extraction yield(increased from 44.9%and 14.8%to 52.2%and 44.5%,respectively),but had no significant effect on the protein purity(P <0.05).The size of protein from un- stabilized and heat- stabilized rice bran decreased from 73.6 nm and 149.1 nm to 46.8 nm and 96.6 nm,respectively.SDS- PAGE electrophoresis indicated that HTC resulted in the appearance of high molecular soluble protein aggregates and glycosylation products.The protein from heat- stabilized rice bran by HTCexhibited similar protein solubility,foam capacity and stability,and excellent emulsifying property to the protein from un-stabilized rice bran.Heat-stabilized rice bran protein showed high in vitro digestibility after HTC treatment,but un- stabilized rice bran protein showed lower digestibility than untreated protein.
heat-stabilized rice bran,un- stabilized rice bran,rice bran protein,hydrothermal cooking,foam property,emulsifying property,external digestion
TS201.1
A
1003-0174(2012)05-0044-06
广东省科技厅农业攻关(2009A08029001)
2011-12-27
夏宁,女,1977年出生,讲师,植物蛋白
杨晓泉,男,1965年出生,教授,博导,植物蛋白
