大豆蛋白组分/葡聚糖复合体系相行为及热性质研究
2012-11-28朱建华杨晓泉
朱建华 杨晓泉
大豆蛋白组分/葡聚糖复合体系相行为及热性质研究
朱建华1杨晓泉2
(韶关学院英东食品科学与工程学院1,韶关 512005)
(华南理工大学轻工与食品学院2,广州 510640)
采用浊度、相图及DSC热性质分析研究了中性多糖葡聚糖(DT)对大豆7S蛋白及11S蛋白热稳定性、相行为及热性质的影响。结果表明增加葡聚糖分子质量或浓度可加速大豆7S蛋白热聚集,葡聚糖对大豆11S蛋白热聚集的影响趋势同7S蛋白。相图分析结果表明当葡聚糖分子质量由10 ku逐渐增加到67、100、500 ku,大豆蛋白组分/葡聚糖形成稳定混合物的区域逐渐减小,同时不稳定区域也呈降低趋势,但凝胶区域呈上升趋势,与大豆7S蛋白/葡聚糖相图相比大豆11S蛋白/葡聚糖相图中随葡聚糖分子质量增加凝胶区域进一步加大,相分离区域相对较大。大豆7S、11S蛋白体系中添加葡聚糖提高了7S、11S蛋白的热稳定性同时降低了热焓值,且此趋势随葡聚糖分子质量增加而增加。
大豆蛋白组分 葡聚糖 热稳定性 相行为 热性质
热处理是食品加工过程中最为普遍的方法,蛋白-多糖复合体系的相行为及热性质是影响食品热处理加工及后续产品储存过程的重要因素。蛋白-多糖的相互作用程度对蛋白体系食品的结构及稳定性有重要影响,且此类相互作用受到蛋白、多糖本身化学结构及处理条件的影响(pH、离子强度、温度及剪切力等)[1-5]。热力学不相容导致的相分离是绝大多数蛋白-多糖混合体系最为常见的现象。通过有效控制蛋白-多糖复合体系相分离是获得各种预期结构、质构特性食品的重要手段。目前针对蛋白-多糖混合体系相行为及热性质的研究主要是集中在乳蛋白-多糖复合体系的研究,比如乳清分离蛋白、酪蛋白、β-乳球蛋白及牛血清白蛋白-多糖体系[6-10]。
作为最大宗植物蛋白来源的大豆蛋白因其良好的功能性质而在食品产品中有着广泛的应用,目前已有大量文献报道大豆蛋白的功能特性[11-13],但对大豆蛋白-多糖混合体系的相行为及热性质研究相对较少,Li等[14-15]曾研究过低浓度大豆蛋白聚集体与多糖混合体系的相行为。迄今为止国内外鲜见关于大豆蛋白7S、11S蛋白组分-多糖体系相行为及热性质的研究文献报道,因7S、11S蛋白的热性质差别较大,因此研究大豆蛋白组分-多糖混合体系相行为对拓宽大豆蛋白在新型食品产品开发过程有重要理论和实际意义。
葡聚糖是一种非凝胶性中性多糖,其结构主要由α-1,6-糖苷键连接葡萄糖单位聚合而成,目前主要作为增稠剂被广泛用于食品产品中。本研究的主要目的是通过浊度分析、相图分析及DSC热分析,研究不同分子质量中性多糖葡聚糖(Mw=10、67、100、500 ku)对大豆7S、11S蛋白相行为及热性质的影响,研究结果以期为后续蛋白-多糖复合体系凝胶性质研究提供依据。
1 材料与方法
1.1 材料与试剂
低温脱溶大豆胚片(白豆片):山东禹王蛋白厂,蛋白(干基)质量分数为55%,水分质量分数为7.3%;葡聚糖(Mw=10、67、100、500 ku):美国 sigma公司;其余试剂均为分析纯。
1.2 主要仪器和设备
Alpha-4冷冻干燥机:德国MATRIN CHRIST公司;杜马斯定氮仪:德国Elementar Inc.;电泳凝胶成像扫描仪:美国UVP公司;DSCTAQ100差热分析仪:美国 TA.Instruments.Inc.。
1.3 试验方法
1.3.1 大豆7S、11S蛋白的分离制备
本试验采用Nagano法来提取大豆豆粕中的蛋白质[16],制备出的7S、11S蛋白经冷冻干燥备用。
1.3.2 大豆7S、11S蛋白含量的测定
采用杜马斯燃烧定氮法检测大豆7S和11S样品的蛋白质含量,测定结果为3次测量的平均值。所有样品的蛋白质量分数均为(94.8±1.4)%。
1.3.3 大豆7S、11S蛋白纯度的检测
SDS-PAGE采用12%的分离胶和4%的浓缩胶制备而成。将60 g/L的7S、11S溶液稀释至30倍(V11S溶液∶V缓冲液=1∶29)。在 1mL Laemmli缓冲液(25% 丙三醇,2%SDS,0.01% 考马斯亮蓝)中加入50μLβ-巯基乙醇。电泳前,所有样品均加热至100℃,保持10 min,进样量10μL,电流10~20 mA,考马斯亮蓝染色,乙酸脱色。
1.3.4 大豆7S、11S蛋白的 DSC热性质分析
采用TAQ100-DSC热分析仪对蛋白质进行热性质分析。取2.0 mg蛋白或蛋白与多糖共混溶液样品放入铝盘,并加入10μL标准缓冲液,密封。温度扫描范围是20~120℃,升温速率为5℃/min。采用空密封铝盘作为参照。在DSC分析中蛋白质变性过程的基本参数:初始温度(Ti),峰值温度(Tp),焓变(ΔH)。每个试验重复3次。DSC氮气的速率为20 mL/min,使用铟(Tf=156.6℃)作为温度校正标准。
1.3.5 大豆7S、11S蛋白及多糖储备液的制备
将大豆7S及11S蛋白分别分散于磷酸缓冲液(pH 7.6,0.5 mol/L)中,充分搅拌3 h 并在 4 ℃条件下过夜以确保大豆7S、11S蛋白分子充分水化,制备的7S、11S蛋白储备液质量浓度为150 mg/mL。将分子质量分别为10、67、100、500 ku的葡聚糖溶解于磷酸缓冲液中,于室温下充分搅拌30 min分散溶解后制备得质量浓度为100~300 mg/mL的葡聚糖储备液。
1.3.6 蛋白多糖混合溶液的制备
按不同比例将大豆7S、11S储备液和多糖储备液混合于试管中并在室温下混合均匀,混合溶液配置示意图见图1,图1中每一蛋白浓度网格线和多糖浓度网格线的交点为1个样品的蛋白多糖浓度组合。混合溶液于真空条件下脱气直至可见的气泡去除为止,然后用锡箔纸密封试管口并放入水浴锅中于95℃恒温10 min。恒温阶段结束后迅速取出试管并用冰浴快速冷却至室温并进行大豆7S、11S蛋白-多糖相图的测定。

图1 不同浓度比例大豆蛋白-多糖混合液制备示意图
1.3.7 浊度测定
大豆7S/11S蛋白-葡聚糖混合溶液经过加热后迅速用分光光度计在室温下测得,浊度值以500 nm下的吸光度值(OD500)表示。
1.3.8 相图的测定
葡聚糖/大豆蛋白7S、11S的相图是在离心、化学分析和观察的基础上建立起来。蛋白/多糖混合溶液经热处理后,尽可能在干扰小的情况下将溶液移至离心管中,然后于2 000×g离心力作用下离心15 min以确保混合溶液出现完全相分离。取出上层液并测定其中的蛋白和多糖浓度,进而通过差示法测得离心后所得下层相中的蛋白和多糖浓度。相平衡中节点的蛋白和多糖坐标浓度用于拟合蛋白/多糖的双节线。同样加热和离心方法处理大量不同浓度比例的大豆7S、11S蛋白-葡聚糖混合溶液,更多的节点通过观察获得。凝胶点通过目测法获得,当混合溶液被加热后由液体转变为固体则认为出现凝胶。相图的双节线最后通过Origin 7.5软件优化所得。在相图确定过程中,节点的蛋白浓度用杜马斯定氮法测定[17],葡聚糖浓度通过苯酚硫酸法测定[18]。
1.3.9 数据处理
应用origin7.0软件对试验结果数据进行统计处理,样品组和对照组之间的差异显著性采用one way Anova方法分析。P<0.05表示差异显著。
2 结果与讨论
2.1 大豆7S、11S蛋白原料纯度及热性质的表征
采用SDS-PAGE法检测大豆7S和11S组分样品的纯度。由图2可知大豆7S蛋白条带α',α,β亚基明显分离,且在泳道上不存在大豆11S蛋白的两个亚基染色带,大豆11S蛋白的电泳图谱泳带上的碱性亚基和酸性亚基明显分离,且在泳道上不存在大豆7S蛋白的3个亚基染色带,表明此两组分的纯度非常高。采用凝胶扫描仪对两组分进行光密度扫描,结果显示大豆7S和11S蛋白的纯度分别达95%和90%以上。由图3结果可以看出,大豆7S蛋白整个扫描范围只有一个吸收峰,且吸收峰的峰值温度为84.93℃,吸收峰的起始温度约为78.86℃。大豆11S蛋白整个扫描范围只有一个吸收峰,且吸收峰的峰值温度为94.71℃,吸收峰的起始温度约为88.59℃。这一测定结果说明制备的大豆7S、11S蛋白原料未变性且纯度较高,与SDS-PAGE纯度分析结果相一致。

2.2 葡聚糖对大豆7S、11S蛋白热稳定性的影响
大豆7S、11S蛋白溶液加热至95℃后两蛋白在几分钟后构型会发生变化[19-20],因此本试验选择在的条件为95℃加热10 min以探讨蛋白/多糖复合体系热稳定性的变化。不同多糖蛋白质量浓度比值的大豆蛋白组分-多糖混合溶液的热稳定性通过测定加热后浊度值的变化来表征(图4)。由图4可知,5、10、20 mg/mL 7S蛋白质量浓度下多糖蛋白浓度比值对其浊度影响存在明显差异。5 mg/mL蛋白质质量浓度条件下当多糖蛋白浓度比值小于1.0时,浊度呈缓慢增加趋势(图4a)。而在10 mg/mL(图4b),20 mg/mL(图4c)蛋白质质量浓度下,其浊度在多糖蛋白质量浓度比值分别大于0.75和0.5后随比值增加明显上升,表明高浓度的的葡聚糖更易加速大豆7S蛋白聚集物的形成。

图4 大豆7S蛋白组分/多糖混合物浊度变化
试验中采用的葡聚糖的浓度相对较低,因此其分子间的相互作用非常低或可以认为忽略不计[21]。因此葡聚糖影响大豆7S蛋白聚集的原因可解释如下:增加多糖浓度或分子质量时都可导致空间排阻效应发生,并使空间占位相对较小的小分子球状7S蛋白从多糖网络中挤出,导致加热过程中大豆7S蛋白自身聚集的机会增加。多糖浓度是影响7S蛋白聚集的一个重要因素,由图4a可知存在一临界浓度值,多糖蛋白浓度比值低于此值时,聚集并不明显,但高于此值时,7S蛋白聚集明显加速。从图4a可以观察到,5 mg/mL 7S蛋白质质量浓度条件下蛋白出现聚集时葡聚糖临界浓度值约为7 mg/mL(多糖蛋白质量浓度比值约为1.4)。当7S蛋白质质量浓度增加到20 mg/mL时,蛋白出现聚集时葡聚糖临界浓度值降低到5 mg/mL(多糖蛋白质量浓度比值约为0.25)。同一分子质量葡聚糖体系,临界浓度值随蛋白浓度增加而呈降低趋势。另外可以观察到相同多糖蛋白质量浓度比值下葡聚糖分子质量对大豆7S蛋白溶液浊度值有明显影响,5 mg/mL 7S蛋白质质量浓度样品中蛋白出现聚集时添加10、67、100、500 ku 葡聚糖临界浓度值依次为 7、5.5、5、2.5 mg/mL,表明随葡聚糖分子质量增加,大豆7S蛋白热聚集加剧。葡聚糖对蛋白聚集的影响表明多糖分子质量具重要作用,此结果与前人的研究是一致的,Bourriot等[22]也发现降低多糖分子质量后需增加其浓度在混合系统中才能加速蛋白聚集。
另浊度分析结果表明葡聚糖对大豆11S热聚集的影响趋势同7S蛋白。但添加同浓度蛋白或同分子质量葡聚糖条件下,导致热变性11S蛋白聚集加剧的临界多糖蛋白质量浓度比值明显低于7S对应值。这可能是因为大豆7S的分子空间位阻小于11S分子空间位阻,中性多糖葡聚糖存在时对7S具更好的相容性,相对聚集较慢所致。
2.3 大豆7S、11S蛋白/多糖混合物相分离行为分析
大豆7S蛋白/葡聚糖的相图见图5。图5中黑色的粗连线是双节线,将蛋白/多糖混合物划分为两个区域。位于双节线上面组成混合物的是不稳定区域,位于双节线下面的是稳定区域。从图5中可以看出当混合物体系中大豆7S蛋白和葡聚糖浓度较低时,混合溶液体系位于稳定区域,表明大豆7S蛋白和葡聚糖可以相容。当增加大豆7S蛋白或葡聚糖浓度时,体系逐渐过渡到出现相分离和凝胶现象的不稳定区域。当相分离出现时,体系中出现分相,即上层中富集了葡聚糖,而下层相则富集了大豆7S蛋白。最终上下层相中的体积和大分子浓度差别显著,主要视初始的蛋白和多糖浓度而定。如初始组成中含质量浓度为30 mg/mL的7S蛋白质和质量浓度为100 mg/mL的葡聚糖(Mw67 ku)混合物最终可以分离成蛋白浓度高度浓缩的下层相(蛋白质量浓度高于140 mg/mL)和多糖质量浓度达130 mg/mL的上层相(图5b)。
从试验结果可以观察到7S蛋白/葡聚糖相图的变化趋势,即随葡聚糖分子质量的增加形成稳定混合物的区域逐渐减小,双节线愈靠近葡聚糖及蛋白浓度坐标轴,表明随葡聚糖分子质量增加,7S蛋白对其“容忍“(热力学相容的浓度)愈小。从DT10 ku-7S相图(图5a)上可以看出当7S蛋白质质量浓度为60 mg/mL时,DT10 ku质量浓度为100 mg/mL时出现凝胶点,7S蛋白质量浓度增加到70 mg/mL时,DT10 ku质量浓度为90 mg/mL时出现凝胶点,继续增加7S蛋白质量浓度到90 mg/mL时,DT10 ku质量浓度为30 mg/mL时就出现凝胶点,这一趋势表明增加DT10 ku质量浓度可使7S蛋白的凝胶起始质量浓度降低,这主要是由于增加葡聚糖浓度显著增加了多糖在7S-葡聚糖体系中的空间占位体积进而导致7S蛋白的表观凝胶形成浓度降低所致。当葡聚糖分子质量由10 ku逐渐增加到67、100、500 ku,形成稳定混合物的区域逐渐减小,同时不稳定区域也呈降低趋势,但凝胶区域逐渐由远离浓度坐标轴向靠近浓度坐标轴。表明同等多糖浓度条件下,高分子质量的葡聚糖更容易使蛋白体系形成凝胶,但蛋白浓度存在一临界值,低于50 mg/mL的蛋白质量浓度在所有葡聚糖浓度条件下难以形成凝胶。另外试验过程观察到凝胶相(三角型)存在明显的凝胶形态转变过程,以DT500 ku为例(图5d),在蛋白质量浓度范围为50~110 mg/mL的凝胶形成区域,同一蛋白质量浓度条件下随多糖质量浓度的增加,凝胶形成经历了以下状态转变:溶液(外观清亮)→硬凝胶(清澈、半透明、混浊)→弱凝胶(间有较多量多糖,有宏观相分离存在,呈互穿型网络结构)。pH 7.6,0.5 mol/L条件下大豆7S蛋白单独存在时,在95℃加热10 min的凝胶临界质量浓度值约为75 mg/mL[23]。蛋白-多糖体系状态从去混合到凝胶转变主要是因为多糖和大豆7S蛋白聚集物的相互作用形成的,这种相互作用抑制了相分离的发生并形成蛋白/多糖凝胶网络。此过程实质是相分离和凝胶作用同时存在,其竞争的最终结果决定了不同尺度结构的凝胶形成。当大豆7S蛋白浓度一定而增加葡聚糖的浓度,体系的外观逐渐由清亮向半透明和混浊态转变。当大豆7S蛋白质量浓度高于临界浓度值(5 mg/mL)时,当蛋白浓度一定时,增加葡聚糖浓度凝胶状态将转变如下:清亮→半透明→混浊。另试验结果表明蛋白浓度越高,需更高的葡聚糖浓度才能抑制凝胶形成。

图5 大豆7S蛋白-葡聚糖体系相图
由图6可知大豆11S蛋白和葡聚糖的相图与对应葡聚糖分子质量相同的大豆7S蛋白/葡聚糖的相图变化趋势一致,但存在以下差异:随葡聚糖分子质量的增加,双节线距蛋白和多糖浓度坐标轴更近,表明多糖与大豆11S蛋白的相容性降低。与大豆7S蛋白/葡聚糖相图相比大豆11S蛋白/葡聚糖相图中随葡聚糖分子质量增加凝胶区域进一步加大,相分离区域相对较大,这一结果主要因11S蛋白在混合体系中的立体位阻效应较大所致。
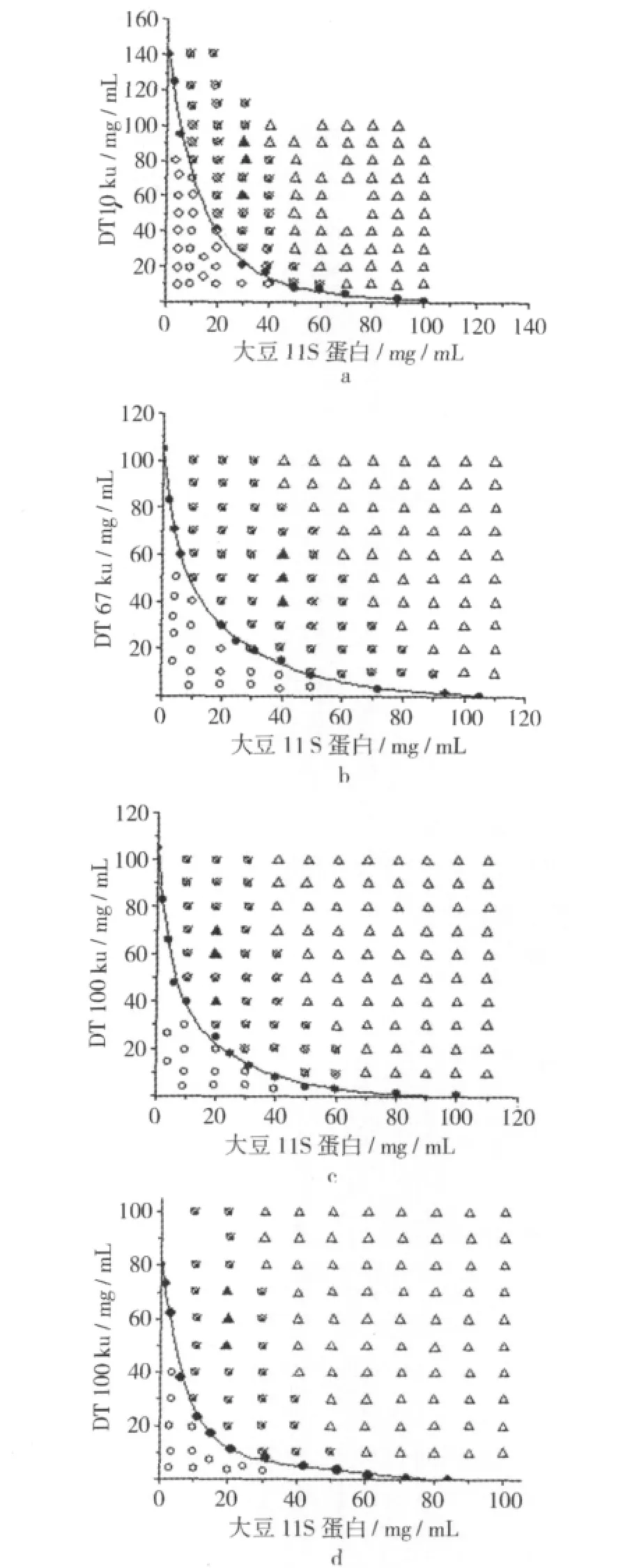
图6 大豆11S蛋白-葡聚糖体系相图
对7S/葡聚糖和11S/葡聚糖体系相图双节线中各节点以二次衰减曲线拟合可得方程(1):

式中:y0,A1,t1,A2,t2为拟合曲线相应参数。由此多糖-蛋白共混体系相容区域的积分面积(S)可由以下方程(2)可进行定量分析:

式中:a,b为积分区域蛋白浓度区间值,a值均为0,b值为多糖浓度趋于零时的极限蛋白浓度值。蛋白浓度趋于零时对应极限多糖浓度cpoly由方程(3)可计算出:

由二次衰减方程(1)、积分方程(2)和极限方程(3)计算所得蛋白多糖体系相图相关参数结果见表1,由表1分析结果可知7S/葡聚糖和11S/葡聚糖体系的相容区域面积及极限蛋白浓度值cprotein均随加入多糖分子质量的增加而呈递减趋势,另加入同一分子质量多糖时7S/葡聚糖的相容区域面积和cprotein比11S/葡聚糖体系对应值大,表明7S/葡聚糖体系相容性较11S/葡聚糖体系好。另两种体系的多糖极限浓度值cpoly均随多糖分子质量增加而递减,主因多糖分子质量的增加提高了空间占位效应所致。
加入同一种多糖时,7S/葡聚糖体系的 cpoly比11S/葡聚糖体系的极限多糖质量分数浓度值大,主因11S分子质量显著大于7S分子质量,给定蛋白浓度条件下7S/葡聚糖体系较11S/葡聚糖体系能相容相对较高浓度多糖所致。
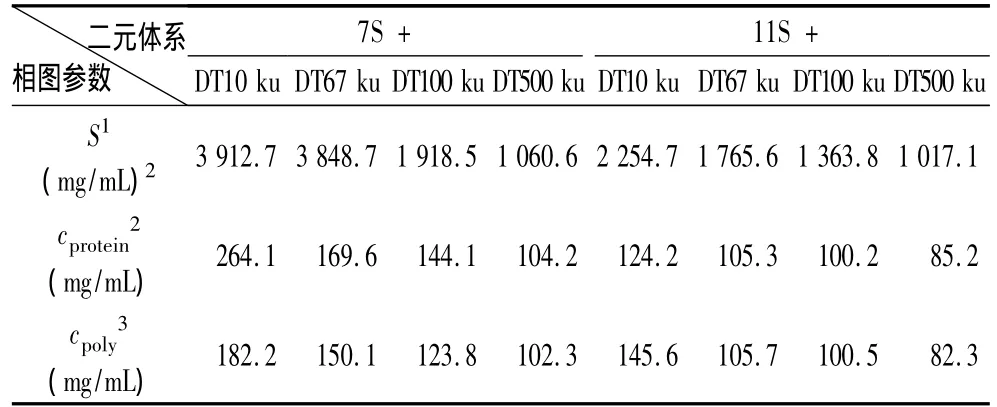
表1 由二次衰减方程(1)及积分方程(2)和极限方程(3)计算所得的7S/葡聚糖和11S/葡聚糖体系相图相关参数
2.4 葡聚糖对大豆7S、11S蛋白热性质的影响
添加多糖质量分数浓度为40 mg/mL时,4种不同分子质量葡聚糖对蛋白质量浓度为100 mg/mL 7S及11S蛋白热性质的影响作用结果见表2。加入DT10 ku后,7S的 Ti从对照的 78.71 上升到 78.86℃,Tp则从对照的84.93上升到85.46℃、而热焓值ΔH则从12.60降低到11.20 J/g。大豆11S蛋白加入DT10 ku后,对热性质几乎没什么影响。随葡聚糖分子质量增加到67 ku时,热变性起始温度及峰值和热焓值相对对照的7S蛋白和11S蛋白而言都有显著变化,其中7S蛋白的热变性温度由对照的84.93提高到 86.88℃,而11S蛋白则从 94.71提高到96.51℃,热焓值7S蛋白降低了约2.10 J/g,而11S蛋白的热焓值则从17.12降低到15.31 J/g。当葡聚糖的分子质量增加到500 ku,对2种大豆蛋白组分的热性质影响最大,热变性峰值显著增加,且同时热焓值明显减小。

表2 葡聚糖对大豆7S、11S热性质的影响
添加葡聚糖提高了大豆7S、11S蛋白热变性温度且随葡聚糖分子质量增加呈增加趋势,可说明葡聚糖提高了7S、11S蛋白的热稳定性,而热焓值的减小似乎说明添加葡聚糖又降低了大豆7S、11S的热稳定性。在浊度测定过程发现随葡聚糖分子质量增加浊度呈上升趋势,此一趋势与热焓值变化是一致的,都是由于葡聚糖的存在加速变性蛋白热聚集所致。此结果可作如下合理解释:热性质测定过程当温度达变性初始温度之前,葡聚糖在溶液中空间占位及热力学不相容效应可以阻碍大豆7S、11S蛋白三级结构展开及内部疏水区域的暴露,当温度足够高及热效应足够强烈到跃过蛋白变性所需的能垒后,变性后的大豆7S蛋白和11S蛋白在葡聚糖的存在下加速聚集,且聚集过程还伴随氢键的变化,整个蛋白聚集过程是一放热过程。热焓差值由吸热和放热反应的净值产生,此过程吸热反应主要有由氢键断裂引起。放热反应主要有蛋白聚集及疏水作用断裂,因此可认为变性蛋白在多糖存在下聚集程度的提高导致了热焓值的降低。Fizsimons等[24]研究另一中性多糖瓜尔胶对乳清分离蛋白(WPI)热性质影响时证实了类似现象,瓜尔胶提高了WPI的热变性温度但降低了总热焓值,原因主要是瓜尔胶的存在加速了变性WPI的热聚集,此过程所释放的能量弥补了WPI热解离展开所需的能量。
3 结论
浊度分析结果显示在大豆7S蛋白/葡聚糖混合体系中,葡聚糖分子质量和浓度对大豆7S蛋白聚集具协同增加效应,葡聚糖对大豆11S热聚集的影响趋势同7S蛋白,同浓度蛋白或同分子质量葡聚糖条件下,导致热变性11S蛋白聚集加剧的临界多糖蛋白质量浓度比值低于7S。相图分析结果表明当葡聚糖分子质量由10 ku逐渐增加到67、100、500 ku,大豆7S蛋白/葡聚糖形成稳定混合物的区域逐渐减小,同时不稳定区域也呈降低趋势,但凝胶区域呈上升趋势。与大豆7S蛋白/葡聚糖相图相比大豆11S蛋白/葡聚糖相图中凝胶区域随葡聚糖分子质量增加而增加。大豆7S、11S蛋白体系中添加葡聚糖提高了7S、11S蛋白的热稳定性同时降低了热焓值,且此趋势随葡聚糖分子质量增加而增加。
[1]Bourriot S,Garnier C,Doublier J L.Phase separation,rheology and microstructure of micellar casein-guar gum mixtures[J].Food Hydrocolloids,1999,13:43-49
[2]齐军茹,杨晓泉,彭志英.蛋白-多糖复合物的制备及乳化性能的研究[J].中国粮油学报,2004,19:75-78
[3]Sanchez C,Schmitt C,Hardy J.Rheology of whey protein isolate- xanthan mixed solutions and gels.Effect of pH and xanthan concentration[J].Nahrung,1997,41:336-343
[4]Turgeon SL,Beaulieu M,Schmitt C,et al.Protein- polysaccharide interactions:Phase - ordering kinetics,thermodynamic and structural aspects[J].Current Opinion in Colloid and Interface Science,2003,8:401-414
[5]Tolstoguzov V B.Functional properties of food proteins and role protein- polysaccharide interaction[J].Food Hydrocolloids,1991,4:429-468
[6]Laneuville ST,Turgeon S L.Effect of preparation conditions on the characteristics of whey protein-xanthan gum complexes[J].Food Hydrocolloids,2002,14:305-314
[7]Guido S,Simeone M.Interfacial tension of aqueous mixtures of Na-caseinate and Na-alginate by drop deformation in shear flow[J].Carbohydrate Polymers,2002,48:143-152
[8]Neiser S,Draget K I,Smidsr O.Interactions in bovine serum albumin- calcium alginate gel systems[J].Food Hydrocolloids,1999,13:445-458
[9]Shim J,Mulvaney S.Effect of heating temperature,pH,concentration and starch/whey protein ratio on the viscoelastic properties of corn starch/whey protein mixed gels[J].Journal of the Science of Food and Agriculture,2001,81:706-717
[10]Croguennoc P,Durand D,Nicolai T.Phase separation and association of globular protein aggregates in the presence of polysaccharide:1.Mixtures of preheated β- lactoglobulin and κ-carrageenan at room temperature[J].Langmuir,2001,17:4372-4379
[11]Maltais A,Remondetto G E,Gonzalez R,et al.Formation of soy protein isolate cold-set gels:Protein and salt effects[J].Journal of Food Science,2005,70:67-73
[12]Renkema J M S,van Vliet T.Concentration dependence of dynamic moduli of heat- induced soy protein gels[J].Food Hydrocolloids,2004,18:483-487
[13]Sorgentini D A,Wagner J R,Ano'n M C.Effects of thermal treatment of soy protein isolate on the characteristics and structure-function relationship of soluble and insoluble fractions[J].Journal of Agricultural and Food Chemistry,1995,43:2471-2479
[14]Li X H,Deng F M,Hua Y F,et al.Effect of molecular weight of dextran on the phase behavior and microstructure of preheated soy protein/dextran mixtures[J].Carbohydrate Polymers,2008,72:160-168
[15]Li X H,Deng F M,Hua Y F,et al.Phase behavior and microstructure of preheated soy proteins andκ-carrageenan mixtures[J].Food Hydrocolloids,2008,22:845- 853
[16]Nagano T,Hirotsuka M,Mori H,et al.Dynamic viscoelastic study on the gelation of 7Sglobulin from soybeans[J].Journal of Agricultural and Food Chemistry,1992,40:941-944
[17]Jung S,Rickert DA,Deak N A,et al.Comparison of Kjeldahl and Dumas Methods for Determining Protein Contents of Soybean Products[J].Journal of American oil chemistry society,2003,12:1169-1173
[18]Dubois M,Gilles K A,Hamilton J K,et al.Colorimetric method for determination of sugars and relatedsubstances[J].Analytical Chemistry,1956,28:350-356
[19]Hirano H,Kagawa H,Kamata Y,et al.Structural homology among the major 7Sglobulin subunits of soybean seed storage proteins[J].Phytochemistry.1987,26:41-45
[20]Peng I C,Quass D W,Dayton WR,et al.The physicochemical and functional properties of soybean 11S globulin-a review[J].Cereal Chemistry.1984,61:480-490
[21]Zhang G Y,Foegeding E A.Heat- induced phase behavior ofβ- lactoglobulin polysaccharide mixtures[J].Food Hydrocolloids,2003,17:785-792
[22]Bourriot S,Garnier C,Doublier JL.Phase separation,rheology and structure of micellar casein-galactomannan mixtures[J].International Dairy Journal,1999,9:353-357
[23]Saio K,Watanabe T.Differences in functional properties of 7Sand 11S soybean proteins[J].Texture Stud,1978,9:135-157
[24]Fitzsimons SM,Mulvihill D M,Morris E R.Large enhancements in thermogelation of whey protein isolate by incorporation of very low concentrations of guar gum[J].Food Hydrocolloids,2008,22:576-586.
Study on Phase Behavior and Thermal Properties of Mixed Soybean Protein Fractions-Dextran System
Zhu Jianhua1Yang Xiaoquan2
(Yingdong Food Science and Tech-nology College,Shaoguan College1,Shaoguan 512005)
(Department of Food Science and Tech-nology,South China University of Tech-nology2,Guangzhou 510640)
The effect of dextran(DT),with different molecular weight on the thermal aggregation,phase behavior,and thermal properties of heat- induced soybean 7S- dextran and soybean 11S-dextran have been studied using turbidity determination,phase diagram,differential scanning calorimeter(DSC).As results showed the increase in molecular weight or the concentration of dextran can accelerate the thermal aggregation of soybean 7S and 11S protein.Phase diagram analysis showed that when the molecular weight dextran increased gradually from 10 ku to 67 ku,100 ku and 500 ku,stable region in soybean protein fractions/dextran mixtures was gradually decreased,while unstable region was also decreased,but the gel region was upward trend.Compared with soybean 7Sprotein/dextran system phase diagram of soybean 11Sprotein-dextran system showed a relatively larger region of gelation and unstable phase separation square,and this trend was enlarged with increasing in molecular weight of dextran.Addition of dextran enhanced the thermal stability of 7S,11Sprotein while the value of enthalpy was reduced,and this trend was increased with the increase in molecular weight of dextran.
soybean protein,dextran,thermal stability,phase behavior,thermal properties
TS201.21
A
1003-0174(2012)05-0010-08
国家自然科学基金(21076087,31101215),广东省自然科学基金(10451200501004341),广东高校优秀青年创新人才培养计划项目资助(LYM10120)
2011-09-01
朱建华,男,1978年出生,博士,副教授,食品材料结构与功能性质
