紫杉醇长循环纳米脂质体的抗肿瘤作用
2012-11-27张阳德
唐 勇,李 坚,张阳德
(中南大学卫生部肝胆肠外科研究中心,湖南 长沙 410008)
紫杉醇是从太平洋紫杉(Tmus brevifolia)的树皮中分离出来的二萜类抗癌成分,是目前最好的抗肿瘤的天然药物之一,对卵巢癌、乳腺癌,肺癌、黑色素瘤、肠癌和白血病等有明显的疗效。它作用于肿瘤细胞分裂过程中纺锤体微管蛋白,具有促微管聚合作用,破坏肿瘤细胞的分裂。明显诱导肿瘤细胞的凋亡。它已被广泛用于治疗卵巢癌、肺癌和乳腺癌等实体肿瘤,也作为多种肿瘤的化疗复方药物之一。紫杉酵的最大缺点是水溶性极低,而且因为肝细胞色素P450代谢酶和消化道p-糖蛋白作用导致口服几乎不吸收。这些缺陷限制了紫杉醇的临床应用,也刺激了紫杉醇新制剂的开发研究。近年来各国科学家都在努力探索紫杉醇新型给药系统(drugdelivery system,DDS),本研究主要观察紫杉醇长循环脂质体的抗肿瘤作用。
1 材料及方法
1.1 药物及试剂
紫杉醇注射液(PAC,海口市制药厂有限公司,国药准字H10980170),紫杉醇长循环纳米脂质体(PAC-LS,国家纳米生物技术实验室采用逆向蒸发法制备,粒径100 nm,质量浓度1000mg/L),用生理盐水将PAC及PAC-LS稀释成500 mg/L备用。DMEM培养基(Life Technologies,Inc),新生牛血清(杭州四季青生物公司),MTT(购自华美生物公司)。另备用制备PAC-LS的脂质(LS,不含化疗药物)5 mg。
1.2 人胰腺癌PANC-1
由本实验室保存,细胞复苏后,用含10%新生牛血清的DMEM培养基培养3代以上。细胞在5%二氧化碳及37℃的潮湿环境中单层生长。取对数生长期细胞用于实验。
1.3 胰腺癌荷瘤鼠模型的准备
实验小鼠为BALB/C近交系雌性小鼠,5周龄,体重20 g左右,由中南大学实验动物学部提供,在SPF级条件下饲养。首先准备肿瘤直径约10mm左右的荷胰腺癌裸鼠8只,引颈处死小鼠,无菌解刨肿瘤,生理盐水洗净,游离肿瘤组织并将其切成1~2 mm3的小块,用套管针直接植入小鼠右侧肋部皮下,待肿瘤生长至最大径约10mm时开始实验。
1.4 脂质的毒性检测
取对数生长期PANC-1细胞,胰酶消化稀释后接种到96孔板,每孔接种90μL含细胞5000个,培养24 h;细胞贴壁后;用生理盐水配成7个不同浓度的脂质(不含化疗药物)依次加到96孔板上,每孔10μL,终浓度为 100、50、10、2、1、0.1 和 0.01mg/L,每个浓度设5个复孔,每块板设一组正常对照组(加10μL生理盐水,不含脂质体)和空白调零孔(只加培养液,不含细胞核脂质体),在培养箱内培养48 h。之后弃去上清液,然后每孔加MTT溶液20μL继续孵育4 h,终止培养。小心弃去孔内上清,每孔再加入100μL溶解液,振荡2min,使结晶物充分溶解,测定570 nm OD值,记录结果,以时间为横坐标,吸光度值为纵坐标绘制细胞生长曲线。根据公式OD实验组/OD对照组计算细胞存活率。
1.5 药物的体外细胞毒性
同上述单纯脂质体毒性检测方法,使用MTT法进行药物对细胞抑制实验,PAC和PAC-LS的终浓度为 10、5、3、1、0.5、0.3 和 0.1mg/L。肿瘤细胞生长抑制率-(1-OD实验组/OD对照组)×100%。
1.6 药物在小鼠体内的抗肿瘤作用
胰腺癌荷瘤小鼠24只,随机分3组,对照组、PAC和PAC-LS组,在肿瘤生长至直径约10 mm时,用药组(PAC和PAC-LS组)小鼠尾静脉分别注入PAC或PAC-LS,用量为6mg/kg,并开始每隔1天测肿瘤最大径(a)及垂直径(b),同时观测小鼠皮毛的改变。测量者对小鼠用药内容不详。观测截止时间60 d。计算指标:①根据公式V=ab2/2计算肿瘤体积,并与对照组相比较求出差值,得出肿瘤生长延迟时间(tumor growth delay,TGD);②小鼠生存时间。
1.7 荷瘤鼠肿瘤细胞用药后细胞周期分布
胰腺癌荷瘤鼠70只,分别尾静脉注入PAC或PAC-LS,剂量仍为 6mg/kg,在用药后 0、1、2、4、6、8和24 h等不同时间点上处死5只小鼠。取肿瘤组织,送流式检测。
1.8 统计学处理
使用SPSS 13.0统计软件包,采用析因设计的方差分析对结果进行统计学处理,P<0.05为差异有显著性。
2 结果
2.1 脂质体的细胞毒性
脂质原料加入PANC-1细胞培养基后,所有培养基中的PANC-1细胞的增殖率要高于对照组,且随着脂质体浓度的增加而上升,实验中最大脂质体质量浓度(100mg/L)的肿瘤细胞增殖率(292%)是最小质量浓度的脂质体(0.01mg/L)的1.7倍(171%)。提示脂质体在体外对细胞无毒性作用。
2.2 PAC和PAC-LS对PANC-1细胞株的毒性比较
以PAC和PAC-LS对人胰腺癌PANC-1细胞株的抑制率为纵坐标,以药物浓度为横坐标,得到药物浓度效应曲线图(图1)。可见,PAC和PAC-LS对PANC-1细胞活性的抑制随浓度的增高出现交叉点。药物质量浓度在4 mg/L以下时,同一浓度PAC-LS对PANC-1细胞活性的抑制大于PAC,两者比较差异有高度显著性(P<0.01);药物质量浓度在4mg/L以上时,同一浓度PAC-LS对PANC-1细胞活性的抑制小于PAC,差异无显著性(P>0.05)。PAC和PAC-LS对胰腺癌PANC-1细胞的半数抑制率(IC50)分别为1.63和3.38mg/L。
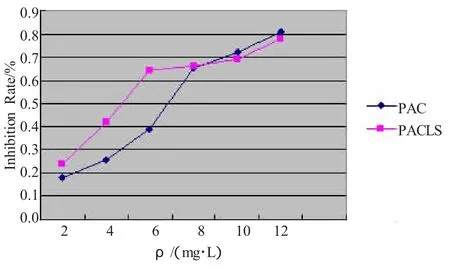
图1 不同药物浓度对PANC-1细胞株的抑制作用
2.3 PAC和PAC-LS对胰腺癌肿瘤生长的影响
胰腺癌荷瘤小鼠尾静脉注射PAC和PAC-LS后,以用药后时间为横坐标,肿瘤体积大小为纵坐标作肿瘤生长曲线图(图2),显示PAC和PAC-LS肿瘤体积生长的速度比对照组缓慢,PAC-LS组又比PAC组肿瘤生长缓慢,对3组的肿瘤生长为原来5倍所需时间进行统计,差异有显著性(P<0.01),见表1。PAC-LS组的TGD明显大于PAC组,2组比较差异有显著性(P<0.01),提示PAC-LS能延缓局部肿瘤的生长。
2.4 PAC和PAC-LS对胰腺癌荷瘤小鼠生存期的影响
尾静脉用药后,PAC-LS组胰腺癌荷瘤鼠生存时间明显长于对照组和PAC组,差异有显著性(P<0.01),见表l及图3;但PAC组荷瘤小鼠的生存时间略短于对照组,2组比较差异无显著性(P>0.05)。实验过程中观察到PAC组小鼠较多出现消瘦和皮毛失去光泽的现象,而PAC-LS组较少发生这种情况。
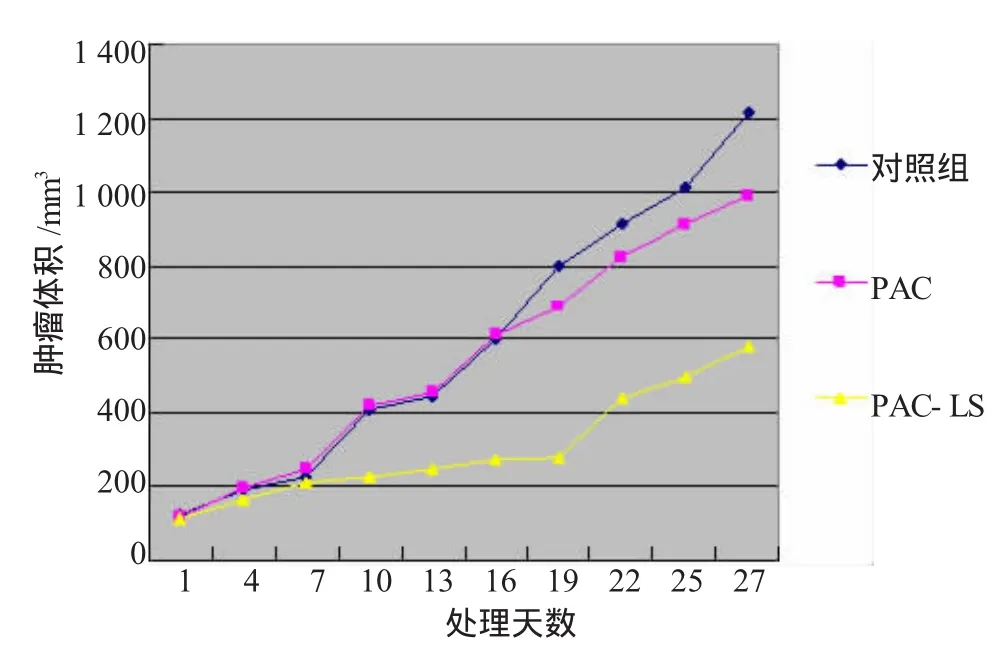
图2 胰腺癌荷瘤鼠肿瘤生长曲线
2.5 用药胰腺癌组织细胞周期分布及凋亡的比较
胰腺癌荷瘤鼠尾静脉用药后不同时间应用流式细胞仪对肿瘤组织进行细胞周期分布及凋亡情况检测,结果显示,PAC-LS组与PAC组G0和G1期肿瘤细胞分布及细胞凋亡占总细胞数的比例在24 h内基本相似,PAC-LS组的G2和M期占细胞周期比例略低于PAC组,但这种差异无显著性(P>0.05),见表2。
表1 胰腺癌荷瘤小鼠用药后肿瘸生长延缓时间对比和小鼠生存时间的比较 ()
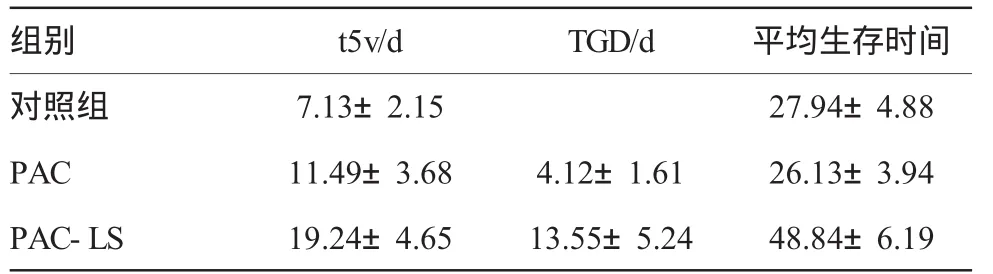
表1 胰腺癌荷瘤小鼠用药后肿瘸生长延缓时间对比和小鼠生存时间的比较 ()
组别 t5v/d TGD/d 平均生存时间对照组 7.13±2.15 27.94±4.88 PAC 11.49±3.68 4.12±1.61 26.13±3.94 PAC-LS 19.24±4.65 13.55±5.24 48.84±6.19
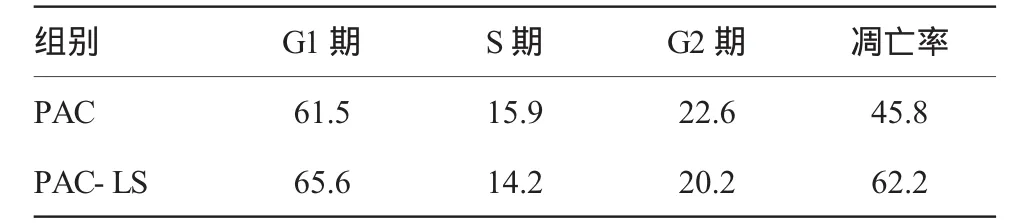
表2 各组药物作用后细胞各期分布及凋亡情况 %

图3 胰腺癌荷瘤小鼠生存曲线图
3 讨论
脂质体(liposomes)是将脂质(如磷脂、胆固醇)等在水中再分散时形成脂质双分子层膜小泡.将药物包封入类脂双分子层形成的超微球体。它通过外层类似细胞的双层磷脂膜与人体细胞发生吸附、融合、脂交换和内吞等相互作用,将脂质体内包封的药物导入细胞中发挥作用. 是继第1代普通丸剂、片剂、胶囊剂等,第2代缓释制剂和前体药物,第3代控释制剂而发展来的第4代靶向制剂。英国BANGHAN等早在1970年就获得了脂质体,但是直到RAHMAN等人将脂质体作为药物载体后,才引起世界各国学者的关注[1-2]。
本研究制备的PAC-LS,希望通过较小的脂质体粒径(100 nm左右)实现对肿瘤组织的促渗滞留作用(enhanced permeability and retantion,EPR),达到被动靶向作用。同时在表面修饰聚乙二醇(PEG),以逃脱网状内皮系统的吞噬作用,延长在体内的循环时间[3-4]。对该剂型的药动实验,已证实本制剂已达到了长循环被动靶向的效果。
由于紫杉醇在吸收过程中存在生物转化[5],多种转化产物进入血液,在血液循环中药物的清除极快,紫杉醇在2 h后就已检测不到,故不宜采用紫杉醇血药浓度法考察其制剂的吸收情况。研究表明,紫杉醇主要经胃肠易化扩散吸收分布于胃肠道[6]。本实验结果表明紫杉醇制备成长循环纳米脂质体后在胃肠组织分布浓度很高,制剂中的紫杉醇长时间黏附于小肠壁(10~12 h),且不易被排入大肠,而紫杉醇原料药在小鼠肠道中迅速通过小肠进入大肠(约6 h),并随大便排出。说明紫杉醇素制备成长循环纳米脂质体有较好的胃肠黏附性,可有效延长药物与胃肠黏膜的接触时间,从而提高药物在肠道中的吸收。
紫杉醇体内实验显示,用药组(PAC和PAC-LS)的肿瘤生长均比对照组缓慢,而PAC组肿瘤生长也较PAC-LS组慢。PAC-LS组与PAC组比较,不仅能使荷瘤鼠肿瘤生长缓慢,还可延长荷瘤鼠的生存时间。提示PAC有抗胰腺癌的作用,而PAC-LS抗肿瘤作用好于PAC,这可能与本制剂的长循环被动靶向的特点有关。然而,本实验中观察到,PAC组的中位生存期小于对照组,但差异无显著性。
另外本实验中还观察到PAC组小鼠较多出现消瘦和皮毛失去光泽的现象,而PAC-LS组较少发生这种情况。紫杉醇脂质体可降低对动物毒性,已被其他实验证实[7-8],故推测荷瘤鼠因普通顺铂的毒性而未获得延长生存时间的益处。本课题下步计划将做对正常组织毒性反应实验,以说明此问题。从细胞周期分布及细胞凋亡占总细胞数比例的数据来看,PAC组的细胞各期和凋亡比例数与PAC-LS组基本一致,提示紫杉醇制成脂质体剂型后,对肿瘤细胞的作用的机制同普通紫杉醇。
综上所述,本研究所采用的脂质体剂型体外无细胞毒性,包裹紫杉醇所制备的紫杉醇纳米脂质体的离体细胞毒性大于普通紫杉醇。与普通紫杉醇相比,可以延缓胰腺癌荷瘤小鼠肿瘤生长及生存时间。总之,本课题应用的紫杉醇长效纳米脂质体在提高抗肿瘤疗效,提高紫杉醇有效生物利用度,可能有潜在的应用前景。
[1]SHUANG CAI,QIUHONG YANG,TARYN R BAGBY,et al.Lymphatic drug delivery using engineered liposomes and solid lipid nanoparticles[J].Advanced Drug Delivery Reviews,2011,63(10-11):901-908.
[2]JANOSSZEBENI,FRANCO MUGGIA,ALBERTO GABIZON,et al.Activation of complementby therapeutic liposomes and other lipid excipient-based therapeutic products:Prediction and prevention[J].Advanced DrugDelivery Reviews,2011,63(12-16):1020-1030.
[3]WANGHJ,ZHAO PQ,LIANG XF,et al.Folate-PEG coated cationic modified chitosan–Cholesterol liposomes for tumor-targeted drug delivery[J].Biomaterials,2010,31(14):4129-4138.
[4]SHEN J,WANG Y,PING Qn,et al.Mucoadhesive effect of thiolated PEG stearateand itsmodified NLC forocular drug delivery[J].Journal ofControlled Release,2009,137(3-4):217-223.
[5]YAOHJ,JURJ,WANGXX,etal.The antitumorefficacy of functional paclitaxel nanomicelles in treating resistantbreast cancers by oral delivery[J].Biomaterials,2011,32(12):3285-3302.
[6]WOLFGANG WRASIDLO,ANDREAS NIETHAMMER,SERDAR DEGER,etal.Pilotstudy ofhydrolytically activated paclitaxelprodrug therapy in patientswith progressivemalignancies[J].Current Therapeutic Research,2002,63(4):247-262.
[7]PAOLA CROSASSO,MAURIZIO CERUTI,PAOLA BRUSA,et al.Preparation,characterization and properties of sterically stabilized paclitaxel-containing liposomes[J].JournalofControlled Release,2000,63(1-2):19-30.
[8]BB LUNDBERG,V RISOVIC,M RAMASWAMY.A lipophilic paclitaxelderivative incorporated in a lipid emulsion for parenteraladministration[J].JournalofControlled Release,2003,86(1):93-100.
