儿茶素抑制肝癌细胞增殖、诱导凋亡作用研究
2012-11-27赵新
赵 新
(新疆医科大学第一附属医院 内科,新疆 乌鲁木齐 830011)
茶是一种由山茶科植物叶片制成的饮料[1]。其中,绿茶在亚洲地区尤其是我国深受人们青睐。近年来,国内外众多研究者对绿茶中的提取物进行了大量的研究,其中的细胞培养等研究提示绿茶对人体大多数肿瘤的发生、发展具有抑制作用[2]。绿茶干重的30%~42%是儿茶素(catechins)包括表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG),表没食子儿茶素(epigallocatechin,EGC),表儿茶素没食子酸酯(Epicatechin gallate,ECG),表儿茶素(Epicatechin,EC)[3]。其中,表没食子儿茶素没食子酸酯的抗癌作用尤为显著。一系列动物实验的结果证明EGCG对多种肿瘤均存在抑制作用[4]。EGCG可能通过干扰癌细胞生存所需的信号传导而发挥其抗肿瘤作用[5-6]。该实验旨在通过MTT法检测EGCG对HepG2细胞增殖的影响,同时通过免疫细胞化学检测及Western blot法观察EGCG作用后HepG2细胞中Cyclin D1、Bcl-2的表达,探讨EGCG发挥抗肿瘤作用的可能机制是否与其在体外引起细胞周期阻滞及细胞凋亡,但却不引起明显的细胞毒性有关,从而为肝癌化疗新药的开发提供可靠的实验室依据。
1 材料与方法
1.1 材料与试剂
HepG2购于武汉细胞库。RPMI 1640购自Gibco BRL。FBS购自杭州四季青公司。EGCG购于ALEXIS BIOCHEMICALS(纯度>95%,高效液相色谱法),DMS0 购自 Sigma。MTT,鼠抗人 Cyclin D1,Bcl-2,Beta-actin单抗,SP 试剂盒,96孔板,6孔板购自武汉荟萃生物公司。
1.2 仪器与设备
二氧化碳培养箱(2406-2),美国SHELLAB公司;倒置相差显微镜(DM3000),德国Leica公司;全自动酶标仪(ELX800),奥地利DIALAB公司;凝胶分析仪(GelDoc2000),美国BIO-RAD公司。
1.3 主要方法
HepG2常规培养、增殖、传代、扩增以备用。细胞呈上皮样贴壁生长,当生长至70%~80%融合时胰酶消化传代,以培养液吹打制成细胞悬液,按不同实验所需浓度接种。
1.3.1 MTT法检测药物对细胞增殖的影响 取对数生长期的HepG2按每孔1×105个接种于96孔板,每孔终体积为100μL。待12 h细胞完全贴壁后加入不同浓度(1、5、25 和 125mg/L)并设不接种细胞的空白对照。每一浓度做6个复孔,继续培养48 h。每孔加入MTT 20μL,37℃孵育4 h 3000 r/min离心10 min后小心吸弃上清。每孔加入DMSO 150μL轻轻震荡10min,在490 nm波长酶联免疫检测仪上测定各孔OD值,求平均值。细胞抑制率=(对照组-实验组)/对照组×100%。
1.3.2 免疫细胞化学检测Cyclin D1,Bcl-2的表达对数生长期HepG2消化制成细胞悬液后,调密度为5×104个/mL,每孔1mL细胞悬液接种于事先放置好盖玻片的6孔板中,继续培养12 h后分别加入5、25mg/L的EGCG,设不加药的对照组。培养24 h后取出玻片,PBS洗后4%多聚甲醛固定10min,正常羊血清室温封闭30min,滴加一抗(1∶50)4℃冰箱中过夜,滴加生物素化二抗室温孵育30min,滴加SP复合物室温孵育30min,DAB显色,苏木素复染,脱水,透明,封片,观察照像。
1.3.3 W estern blot法检测 Cyclin D1,Bcl-2 的表达 收集药物作用后的HepG2各组细胞,提取总蛋白,用超微量紫外分光光度仪定量蛋白。取40μg总蛋白进行电泳后,蛋白转移至0.22μm PVDF膜。然后一抗4℃孵育过夜,二抗室温孵育1.5 h。ECL化学发光试剂发光,X线胶片进行显影、定影、图像分析。
1.4 统计学分析
2 结果
2.1 EGCG对HepG2细胞增殖的影响
不同浓度的EGCG作用HepG2细胞48 h后,MTT法测定吸光度(OD)值,结果显示细胞生长受到不同程度的抑制,这种抑制作用呈浓度依赖性,随着浓度的增大,OD值明显减少,增殖抑制率明显升高且与对照组相比差异有显著性(P<0.05)。见附表。
附表 EGCG对HepG2细胞增殖的影响 (n=6,)
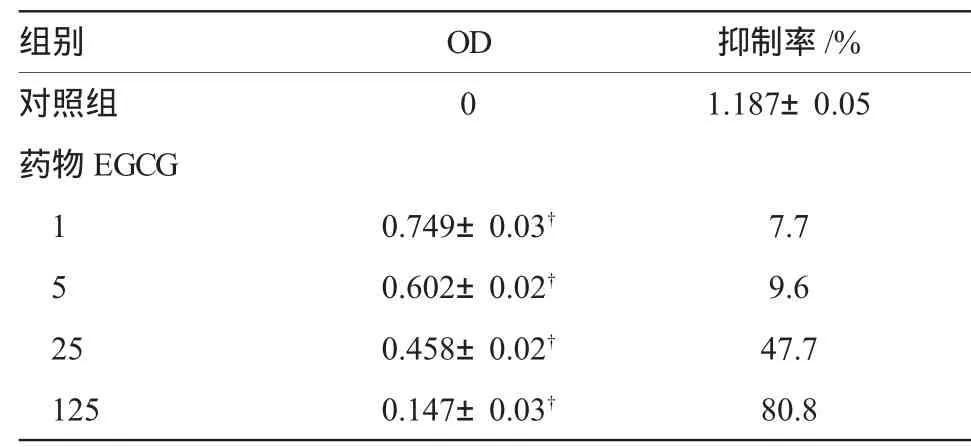
附表 EGCG对HepG2细胞增殖的影响 (n=6,)
注:†与对照组相比,差异有显著性,P<0.05
组别 OD 抑制率/%对照组 0 1.187±0.05药物EGCG 10.749±0.03† 7.750.602±0.02† 9.625 0.458±0.02† 47.7125 0.147±0.03† 80.8
2.2 免疫组化SP方法测定Cyclin D1和Bcl-2的表达
分别用5和25mg/L的EGCG处理HepG2细胞24 h后,免疫细胞化学染色发现对照组细胞染色强,Cyclin D1位于胞核,Bcl-2位于胞浆,染色后可见均匀的棕黄色颗粒;而处理组细胞Cyclin D1(图1),Bcl-2(图2)的表达水平与对照组的比较则有明显下降。
2.3 Western blot法检测Cyclin D1,Bcl-2的表达
EGCG处理HepG2细胞24 h后,提取蛋白,用Western Blot法检测Cyclin D1和Bcl-2的表达情况。结果显示,与空白对照组相比,EGCG处理组Cyclin D1和Bcl-2的表达明显降低(图3)。

图1 不同实验组HepG2细胞中Cyclin D1的表达(×400)
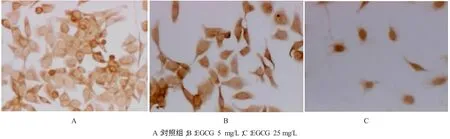
图2 不同实验组HepG2细胞中Bcl-2的表达(×400)

图3 Cyclin D1及Bcl-2表达的变化
3 讨论
肝细胞癌是世界五大恶性肿瘤之一,具有高死亡率、早期症状隐匿、预后差等特点[7]。其分子发病机制以及临床治疗的特异性靶点已成为当前人们普遍关注和迫切需要解决的问题。对肿瘤发病机制的深入研究显示,细胞增殖和细胞凋亡平衡的破坏可导致肿瘤发生。研究细胞周期蛋白以及凋亡抑制蛋白在肝癌组织中的表达情况对研究肝癌的发生和发展具有重要意义,对肝癌的治疗有潜在的价值。
近年来,关于EGCG的抗瘤作用,已经成为人们研究的热点。YU等[8]研究发现含有儿茶素成分的非成熟李子提取物可以明显诱导HepG2凋亡。该研究证实在体外EGCG可以通过抑制细胞增殖、诱导细胞凋亡发挥抗肿瘤作用。MTT比色法显示EGCG呈浓度依赖性抑制肝癌HepG2细胞的增殖。为了进一步探讨EGCG抗肿瘤的作用机制,通过免疫细胞化学以及Western blot法分析EGCG对Cyclin D1,Bcl-2表达的影响,用EGCG处理肝癌HepG2细胞后,各处理组分别出现Cyclin D1、Bcl-2的表达下调。细胞周期调控异常导致细胞的异常增殖是肿瘤发生的基础。在细胞周期的进程中,关系到整个细胞周期启动的G1→S转换即真核细胞中的检查点,是保证基因组复制和分离忠实性的重要调控点。细胞是否能无限增殖,在一定程度上是基于其是否能顺利通过检查点。细胞周期蛋白D家族(Cyclin D)是一种重要的G1/S期正性调控分子,包括3个亚型:Cyclin D1、Cyclin D2与Cyclin D3,能促进细胞增殖,加快细胞周期进程,当Cyclin D由于基因结构或功能异常而表达失调,G1期缩短,细胞周期加快,使发生突变的基因组DNA得不到修复、细胞亦不发生凋亡,则有可能导致细胞无限增殖而诱发肿瘤。Cyclin D1是细胞周期启动因子,作用于G1/S期转换过程,促使细胞从G1期进入S期。Cyclin D1的超表达可使细胞发生难于控制的持续性增殖。近年来,有不少研究表明Cyclin D1基因参与肿瘤的发生、发展,并被认为是一种原癌基因[9-10]。Cyclin D1过表达可见于乳腺癌、食管癌、胃癌、肺癌、头颈部肿瘤、子宫癌、膀胱癌等多种肿瘤组织中。
EGCG可能通过下调Cyclin D1的表达,即检查点重要正性调控分子Cyclin D1减少,从而使细胞无法从G1期顺利的进入到S期,细胞周期的进程受到阻止。
正常细胞的增殖和凋亡是受到极其精细调控的基本生命现象。然而,恶性肿瘤细胞却具有以下基本特征:一是细胞增殖失控,二是细胞凋亡紊乱。细胞凋亡(Apoptosis)是由于细胞内外环境变化或死亡信号触发以及在基因调控下所引起细胞主动死亡的过程,这一过程对于消除机体内老化细胞或具有潜在性异常生长的细胞,以至于保持机体处于稳定状态起着至关重要的作用。体内细胞凋亡调控机制发生紊乱将引起人体发生多种肿瘤的形成。细胞凋亡主要通过两种途径进行:一种是通过激活细胞表面的凋亡受体,进一步活化Caspase8,最终激活Caspase3而引起凋亡;另一种途径则是各种刺激因子作用于线粒体时,线粒体膜释放细胞色素C并激活Caspase9从而引起凋亡。bcl-2是细胞凋亡研究中最受重视的癌基因之一。Bcl-2能促进细胞存活,抑制细胞凋亡。Bcl-2是阻断细胞凋亡最后共同通路的关键蛋白,在其表面的疏水性沟能与促凋亡BH3域结合,该二聚体对凋亡的调节至关重要[11]。Bcl-2抑制细胞凋亡亦可通过抑制细胞色素C的释放和抑制Caspase的活化而实现[12-13]。
EGCG可能通过多种机制诱导凋亡,HAYAKAWA等[14]研究表明EGCG能与Fas结合,启动Fas介导的凋亡过程,活化Caspase8,从而诱导人单核细胞白血病U937凋亡。吴育晶等[15]发现EGCG诱导凋亡机制可能与其下调HepG2细胞内Bcl-2蛋白的表达,上调Bax蛋白的表达,从而促进Caspase3活化有关。LEONE等[11]研究发现EGCG因具有独特的gallate基团而能与Bcl-2、Bcl-xL的疏水域紧密结合,故可直接有效抑制抗凋亡Bcl-2家族成员,从而促进肿瘤细胞的凋亡。
EGCG还可能一方面通过下调抗凋亡基因bcl-2的表达,使凋亡基因的表达相对而言占优势,最终发挥其抗癌作用;另一方面如同白藜芦醇诱导凋亡与细胞周期调控系统破坏相关[16],EGCG对凋亡的诱导亦可能与其阻止细胞周期进程,破坏细胞周期调控系统有关,故EGCG诱导细胞凋亡是否存在途径选择性,目前仍有待进一步的研究。
该实验采用不同浓度的EGCG对肝癌HepG2细胞进行干预。实验结果发现,EGCG不仅抑制肝癌HepG2细胞的增殖,同时还明显下调肝癌HepG2细胞中Cyclin D1和Bcl-2的表达。因此,可以推测EGCG可能通过对细胞增殖和细胞凋亡的调节而发挥其抗肿瘤的作用。
目前,关于EGCG如何影响细胞增殖的机制仍不十分清楚。HASTAK等[17]通过对前列腺癌LNCaP细胞的研究发现EGCG通过使p53蛋白的稳定性增强并且上调p53表达,从而使其下游蛋白p21WAF1和Bax活性增强,使Bax/Bcl-2朝有利于肿瘤细胞凋亡的比例改变,从而诱导肿瘤细胞凋亡发挥其抗瘤作用。GUPTA等[18]认为EGCG的抗癌作用主要在于干扰细胞周期的进程导致肿瘤细胞周期阻滞,与此同时朱宝和等[19]指出EGCG可以抑制VEGF诱导的血管生成,从而抑制肿瘤生长和血管生成。
综上所述,近几年EGCG已成为抗癌药物研发的又一热点,该实验初步探讨了EGCG可能的抗癌机制,然而关于EGCG抗癌的确切机制仍有待更多实验室依据的证明和进一步的阐明。
[1]YANG CS,LANDAU JM.Effects of tea consumption on nutrition and health[J].J Nutr,2000,130(10):2409-2412.
[2]陈志鸿,罗招阳.表没食子儿茶素没食子酸酯(EGCG)抗肿瘤研究进展[J].中国肿瘤,2006,5(7):453-456.
[2]CHEN ZH,LUO ZY.Research progress on anticancer effect of epigallocatechin gallate (EGCG)[J].Chinese Cancer,2006,15(7):453-456.Chinese
[3]BALENTINE DA,WISEMAN SA,BOUNWENS LCM.The chemistry of tea flavonoids[J].Crit Rev Food Sci Nutr,1997,37(8):693-704.
[4]YANG C,WANG X,LU G,et al.Cancer prevention by tea:animal studies,molecular mechanisms and human relevance[J].Nat Reviews Cancer,2009,9(6):429-439.
[5]DEVIKA PT,STANELY MPP.Epigallocatechin gallate(EGCG)prevents mitochondrial damage in isoproterenol induced cardiac toxicity in albino Wistar rats:a transmission electron microscopic and in vitro study[J].Pharmacol Res,2008,57(5):351-357.
[6]ERMAKOVA SP,KANG BS,CHOI BY,et al.Epigallocatechin gallate overcomes resistance to etoposide induced cell death by targeting the molecular chaperone glucose regulated protein 78[J].Cancer Res,2006,66(18):9260-9269.
[7]ELSERAG HB,RUDOLPH KL.Hepatocellular carcinoma:epidemiology and molecular carcinogenesis[J].Gastroen Terology,2007,132(7):2557-2576.
[8]YU MH,IM HG,KIM HI,et al.Induction of apoptosis by immature plum in human hepatocellular carcinoma[J].J Med Food,2009,12(3):518-527.
[9]李 锋,陈临溪.细胞周期蛋白D与细胞周期调控研究进展[J].国际病理科学与临床杂志,2005,25(3):270-273.
[9]LI F,CHEN LX.Research progress on Cyclin D and cell cycle regulation[J].Foreign Medical Sciences:Section of Pathophysiology and Clinical Medicine,2005,25(3):270-273.Chinese
[10]张 伟,杜成友,徐尔侃.肝癌临床发展与cyclin D1表达DNA含量及细胞凋亡发生的关系 [J].第三军医大学学报,2005,27(5):467-468.
[10]ZHANG W,DU CY,XU EK.Relationship of clinical typing of hepatocellular carcinomas and cyclin D1 expression,DNA content,the occurrence of cell apoptosis[J].Acta Academiae Medicinae Militaris Tertiae,2005,27(5):467-468.Chinese
[11]LEONE M,ZHAI D,SARETH S,et al.Cancer prevention by tea polyphenols is linked to their direct inhibition of antiapoptotic Bcl-2 family proteins[J].Cancer Res,2003,63(12):8118-8121.
[12]BURLACU A.Regulation of apoptosis by Bcl-2 family proteins[J].J Cell Mol Med,2003,7(3):249-257.
[13]CORY S,HUANG DC,ADAMS JM.The Bcl-2 family:roles in cell survival and oncogenesis[J].Oncogene,2003,22(53):8590-8607.
[14]HAYAKAWA S,SAEKI K,SAZUKA M,et al.Apoptosis induction by epigallocatechin gallate involves its binding to Fas[J].Biochem Biophys Res Commun,2001,285(5):1102-1106.
[15]吴育晶,金 娟,胡姗姗,等.儿茶素对人肝癌细胞HepG2的影响[J].中国药理学通报,2010,26(12):1598-1602.
[15]WU YJ,JIN J,HU SS,et al.Effects of catechin on human hepatocellular carcinoma cell line HepG2[J].Chinese Pharmaco logical Bulletin,2010,26(12):1598-1602.Chinese
[16]AHMAD N,ADHAMI VM,AFAQ F,et al.Resveratrol causes WAF-1/p21 mediated G1 phase arrest of cell cycle and induction of apoptosis in human epidermoid carcinoma A431 cells[J].Clinical Cancer Research,2001,7(3):1466-1473.
[17]HASTAK K,GUPTA S,AHMAD N,et al.Role of p53 and NfkappaB in epigallocatechin-3-gallate induced apoptosis of LNCaP cells[J].Oncogene,2003,22(31):4851-4859.
[18]GUPTA S,HUSSAIN T,MUKHTAR H.Molecular pathway for epigallocatechin-3-gallate induced cell cycle arrest and apoptosis of human prostate carcinoma cells[J].Arch Biochem Biophys,2003,410(1):177-185.
[19]朱宝和,詹文华,贺 德,等.EGCG对肿瘤生物抑制机制影响的探讨[J].中华肿瘤防治杂志,2008,15(20):37-41.
[19]ZHU BH,ZAN WH,HE D,et al.Effect of EGCG on inhibition mechanism of tumor growth[J].Chinese Journal of Cancer Prevention and Treatment,2008,15(20):37-41.Chinese
