槲皮素对人内皮祖细胞增殖和凋亡的影响及机制研究
2012-11-27胥光热彭永权刘应才
胥光热,彭永权,林 静,刘应才
(1.遂宁市中心医院 心血管内科,四川 遂宁 629000;2.泸州医学院附属医院 心血管内科,四川 泸州 646000;3.四川大学华西医院 心血管内科,四川 成都 610041)
槲皮素(quercetin,Que)是醋柳总黄酮的主要单体之一,广泛存在于蔬菜、水果及植物药中,在心血管保护方面起重要作用。近年来发现Que具有抗氧化的生物学活性。研究表明其抗氧化主要表现在促进电子转移,清除自由基(活性氧/活性氮);螯合过度金属离子;维持和再生α-生育酚等。Que对冠心病(CHD)具有防治作用已得到研究的充分证实。EPCs对冠状动脉疾病的内皮修复过程起着重要的作用,其数量和功能受损可导致内皮损伤与修复之间的动态平衡破坏。因此,外周血EPCs数量和功能与冠状动脉的血管损伤密切相关,是冠心病的危险因素[1]。氧化应激引起EPCs数量减少和功能减弱,促进冠心病的发生发展[2]。但对于Que如何防治冠状动脉粥样硬化的进展,目前尚无定论。因此,我们通过体外培养脐血内皮祖细胞,观察Que在氧化应激条件下对EPCs的影响,以探讨Que治疗冠心病可能的机制。
1 材料与方法
1.1 试剂
槲皮素、成纤维细胞生长因子(b-FGF)、DiI标记的乙酰化低密度脂蛋白(DiI-ac-LDL)、FITC标记的荆豆凝集素-1(FITC-UEA-1)、Annexin V-FITC/PI双染细胞凋亡检测试剂盒、Anisomycin购自美国Sigma,人纤连蛋白购自Milipure,血管内皮生长因子(VEGF)购自Pepro Tech,优质胎牛血清购自Hyclone公司,鼠抗人p-JNK抗体、小鼠SP检测试剂盒、DAB显色试剂盒购自中山金桥,鼠抗人CD133单克隆抗体购自北京博奥森,FITC-兔抗鼠IgG购自武汉博士德,WST-1检测试剂盒购自碧云天。
1.2 方法
1.2.1 EPCs的分离、诱导、培养 脐血(每份60 mL)取自泸州医学院附属医院妇产科足月健康分娩的新生儿,告知产妇用于科学研究并得到其认可。按1∶3的比例加入明胶,常温下静置30min,收集上清液,离心1000 r/min,10min,弃上清液,用无血清DMEM培养基稀释混匀后按3∶2加入人淋巴细胞分离液上,离心2000 r/min,20 min,小心吸取中间白膜层单个核细胞,用DMEM培养基离心洗涤2遍,再用M199培养基调整密度为4×106/mL接种于纤连蛋白包被培养瓶中,另加10%胎牛血清,1%青链霉素,VEGF 50 ng/mL,b-FGF 1 ng/mL饱和湿度、5%二氧化碳的37℃孵箱中培养,每3~4 d换夜;继续培养至7~8 d,PBS洗涤掉非贴壁细胞,收集贴壁细胞供进一步实验用。
1.2.2 EPCs鉴定 ①细胞形态学鉴定:倒置相差显微镜下观察细胞形态学变化。②免疫荧光检测表面标志CD133:培养7 d的贴壁细胞行细胞爬片,40 g/L多聚甲醛固定30min后,3%H2O2孵育10 min,用Triton-100打孔,血清封闭后,加鼠抗人CD133抗体(1∶300稀释),4℃冰箱过夜,滴加FITC标记的兔抗鼠IgG,37℃孵育60min,荧光显微镜下观察拍照。③细胞免疫荧光双染色鉴定:细胞培养至9 d后行细胞爬片。待细胞贴壁完全后进行Dil-ac-LDL荧光染色鉴定。细胞在含Dil-ac-LDL(2.4μg/mL)的培养液中37℃孵育1 h,然后2%的多聚甲醛固定10min,均匀滴加浓度为10μg/mL FITC-UEA-1于上述标本上,继续在孵箱培养1 h。PBS漂洗后在荧光显微镜下观察显示红色荧光为ac-LDL阳性细胞,显示绿色荧光为UEA-1阳性,染色双阳性为正在分化的EPCs。
1.3 实验分组
细胞培养至第7天后用不含EDTA的0.25%胰酶消化贴壁细胞,调整细胞密度为2×106/mL,按照每孔2mL接种于6孔板,随机分为空白对照组、H2O2(500μmol/L)氧化应激模型组、Que(60、90和120μmol/L)预处理30min后H2O2再处理8 h共同干预组,继续培养24 h后施加上述不同的干预因素。
1.4 细胞增殖
将培养7 d的细胞以2×103个均匀接种于96孔板,待细胞完全贴壁后用不含血清的M199培养液培养24 h,使细胞生长同步化。同时再加入各种干预因素继续培养24和48 h后,每孔加入10μL WST-1溶液,继续孵育2 h,置酶标仪450 nm波长测定OD值。每个实验组均设6个复孔同时进行实验。
1.5 EPCs凋亡的检测
双染免疫荧光法EPCs凋亡的观察:培养待检测细胞,PBS洗涤2次后,加入Binding Buffer悬浮细胞,再分别加入5μL的FITC-Annexin-v、PI混匀,室温避光反应10min,将盖玻片倒置于载玻片上,于荧光显微镜双色滤光片(FITC和罗丹明)下观察,FITC-Annexin-v荧光信号呈绿色,PI荧光信号红色。在1 h内上机检测,同时收集细胞悬浮液,流式细胞仪检测并计算各组细胞的凋亡率。
1.6 EPCs凋亡机制研究
1.6.1 免疫细胞化学法检测EPCs p-JNK蛋白表达 取出培养7 d的细胞在6孔板中爬片,40 g/L多聚甲醛固定30 min钟后,3%H2O2孵育10 min,用Triton-100打孔,血清封闭后,滴加1∶100稀释的鼠抗人p-JNK一抗,用PBS缓冲液(0.01 mol/L,pH 7.4)代替一抗作为阴性对照,4℃冰箱过夜,滴加二抗,37℃孵育30min,PBS液代替一抗作阴性对照,DAB显色,苏木精复染。梯度乙醇脱水,二甲苯透明,中性树胶封固,光镜观察阳性信号。
1.6.2 JNK激动剂对EPCs凋亡的影响 将上述细胞随机分为空白对照组、JNK激动剂Anisomycin 10μmol/L+H2O2(500μmol/L)组、JNK 激动剂 Anisomycin 10μmol/L+Que (60、90 和 120μmol/L)+H2O2(500μmol/L) 组,JNK 激动剂组先加入10μmol/L Anisomycin预处理1 h后再施加其他干预因素,流式细胞仪检测各组的凋亡率。
1.7 统计学处理
2 结果
2.1 EPCs的鉴定
①刚分离的单个核细胞倒置相差显微镜下呈圆形,胞体透亮,折光性好,散在分布于培养液中。3~4 d后,圆形细胞逐渐拉长,呈梭形贴壁生长,并有少量细胞突起(见图1A)。培养7 d后梭形细胞较前明显增多,细胞体积增大,部分视野可呈集落样生长,有一定的方向性(见图1B)。
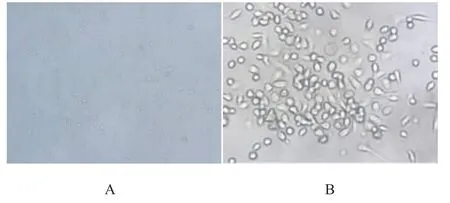
图1 内皮祖细胞的形态学特征(×200)
②早期EPCs以表达CD133、CD34为主,晚期可表达KDR。其中CD133在EPCs向成熟内皮细胞分化过程中其数量迅速减少。因此,可作为EPCs区别成熟内皮细胞的分子标志[3]。细胞免疫荧光检测CD133阳性细胞呈绿色,阳性率达95%以上。见图2。
③DiI-ac-LDL染色呈红色(见图3),FITC-UEA-1染色呈绿色(见图4),DiI-ac-LDL和FITC-UEA-1免疫荧光双染色阳性的细胞呈黄色,定义为内皮祖细胞[4],阳性率>90%。见图5。
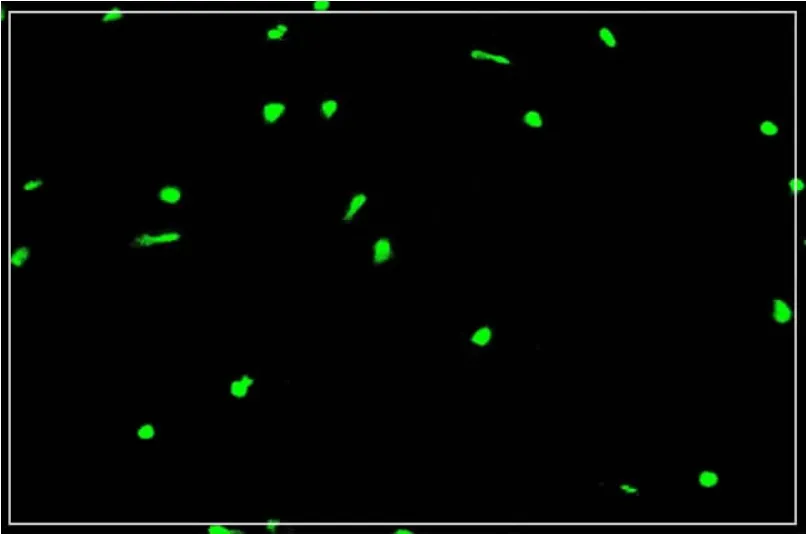
图2 CD133阳性细胞的免疫荧光检测

图3 DiI-ac-LDL染色

图4 FITC-UEA-1染色
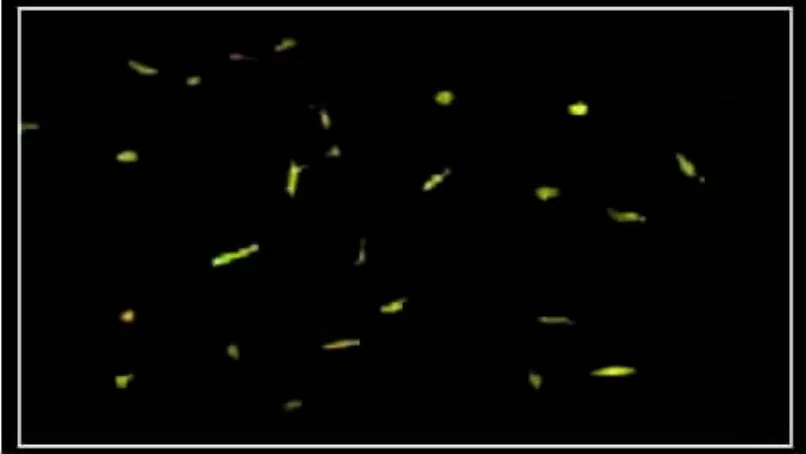
图5 内皮祖细胞
2.2 Que对EPCs增殖的影响
在正常培养条件下,与空白对照组比较,60~90μmol/L的 Que可以促进 EPCs的增殖,120μmol/L的Que则表现出抑制EPCs增殖的作用,与培养24 h比,在48 h对EPCs的抑制作用较为明显,差异有显著性(P <0.05)(见表 1);在氧化应激条件下,与空白对照组比较,H2O2组EPCs增殖能力明显降低,差异有显著性(P<0.01),加入60~120 μmol/L的Que处理后,H2O2诱导的EPCs损伤后的细胞增殖能力得到明显改善,且具有明显的时间和浓度依赖性,与H2O2组比较,差异有显著统计学意义(P <0.01)(见表 2)。
表1 在生理条件下Que对EPCs增殖的影响(,n=6)
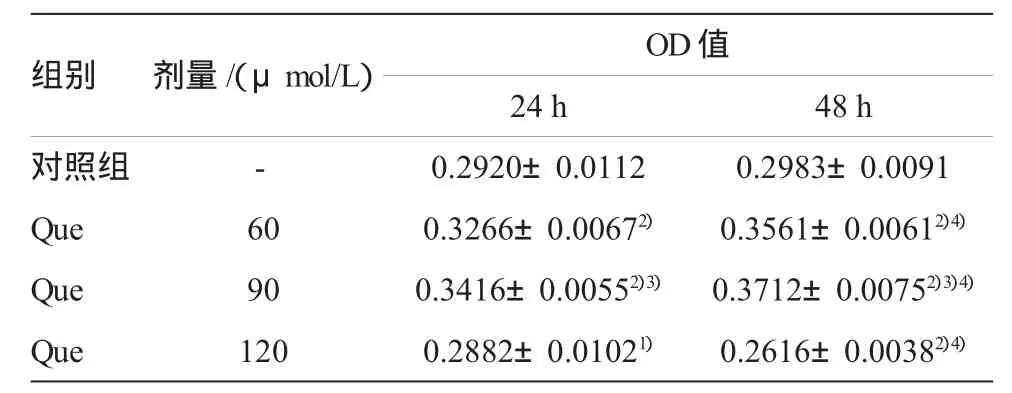
表1 在生理条件下Que对EPCs增殖的影响(,n=6)
注:1) 与对照组比较,P <0.05;2) 与对照组比较,P <0.01;3)与60μM Que组比较,P <0.05;4)48 h与 24 h相比,P <0.05
OD值24 h 48 h对照组 - 0.2920±0.0112 0.2983±0.0091 Que 60 0.3266±0.00672) 0.3561±0.00612)4)Que 90 0.3416±0.00552)3) 0.3712±0.00752)3)4)Que 120 0.2882±0.01021) 0.2616±0.00382)4)组别剂量/(μmol/L)
2.3 Que对H2O2诱导的EPCs凋亡的影响
免疫荧光观察结果显示绿色的为凋亡早期细胞,红色为死亡细胞,核桔黄色而膜绿色为凋亡晚期细胞。流式细胞仪检测结果发现Que在60~120μmol/L范围内随着浓度的增加,且抗EPCs凋亡作用逐渐增强。在60、90、120μmol/L浓度的Que作用下,凋亡率依次为(27.43±0.37)%、(23.12±0.45)%和(22.43±0.16)%,与 H2O2诱导组(36.58±0.45)%的凋亡率比较,差异有显著性(P<0.01);与 90μmol/L Que+H2O2组比较,120μmol/L Que+H2O2组的凋亡率无明显差异(P<0.05)(见表3,图6)。免疫细胞化学p-JNK阳性表达细胞胞浆和胞核出现棕黄色颗粒,随着槲皮素浓度的增加,p-JNK阳性表达产物逐渐减少,染色变得浅淡(见图7)。Que能够抑制加入JNK激动剂后EPCs凋亡率的 增 加 ,Anisomycin+Que(60μmol/L、90μmol/L、120μmol/L)+H2O2组的凋亡率依次为 (42.36±0.53)%、(38.32±0.15)%和(35.78±0.27)%,与 Anisomycin+H2O2组(47.35±0.64)%比较,差异有显著性(P<0.05)。见表 4,图8。
表2 在氧化应激条件下Que对EPCs增殖的影响(,n=6)

表2 在氧化应激条件下Que对EPCs增殖的影响(,n=6)
注:1) 与对照组比较,P <0.01;2) 与 H2O2组比较,P <0.01;3)与60μM Que组比较,P <0.05;4)与 90μM Que组比较,P <0.05;5)48 h与24 h比较,P<0.05
OD值24 h 48 h对照组 - 0.2920±0.0112 0.2983±0.0091 H2O2 500 0.1175±0.00441) 0.1033±0.00551)Que+H2O2 60 0.1336±0.00372) 0.1526±0.00482)5)Que+H2O2 90 0.1568±0.00492)3) 0.1743±0.00492)3)5)Que+H2O2 120 0.1838±0.00512)4) 0.2039±0.00672)4)5)组别 剂量/(μmol/L)
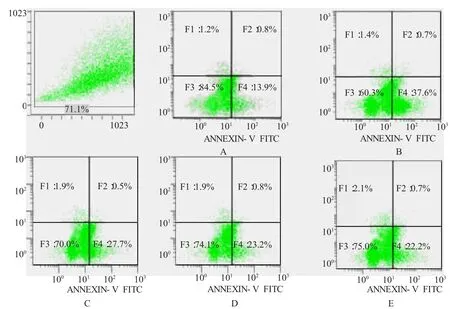
图6 H2O2诱导的EPCs凋亡的流式细胞仪检测
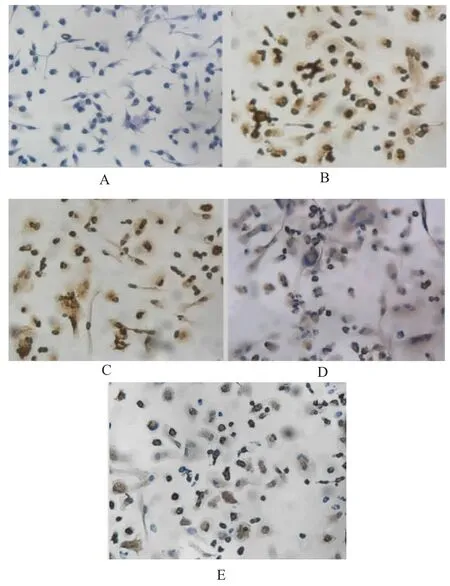
图7 免疫细胞化学法p-JNK蛋白表达
表3 Que对H2O2诱导的EPCs凋亡的影响(,n=6)

表3 Que对H2O2诱导的EPCs凋亡的影响(,n=6)
注:1) 与对照组比较,P <0.01;2) 与 H2O2组比较,P <0.01;3)与90μM Que+H2O2组比较,P<0.05
组别剂量/(μmol/L)凋亡率/%对照组 - 13.52±0.36 H2O2 500 36.58±0.451)Que+H2O2 60 27.43±0.582)3)Que+H2O2 90 23.12±0.372)Que+H2O2 120 22.43±0.162)
表4 JNK激动剂对H2O2诱导的EPCs凋亡的影响(,n=6)
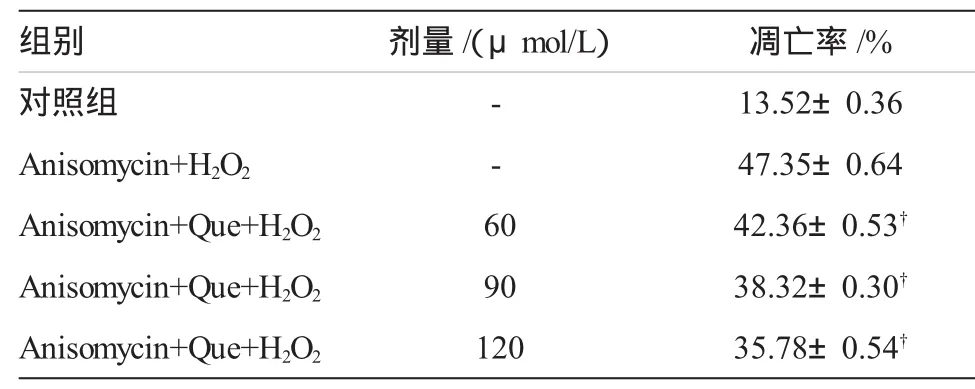
表4 JNK激动剂对H2O2诱导的EPCs凋亡的影响(,n=6)
注:†与 Anisomycin+H2O2组比较,P<0.05
组别剂量/(μmol/L)凋亡率/%对照组 - 13.52±0.36 Anisomycin+H2O2 - 47.35±0.64 Anisomycin+Que+H2O2 60 42.36±0.53†Anisomycin+Que+H2O2 90 38.32±0.30†Anisomycin+Que+H2O2 120 35.78±0.54†
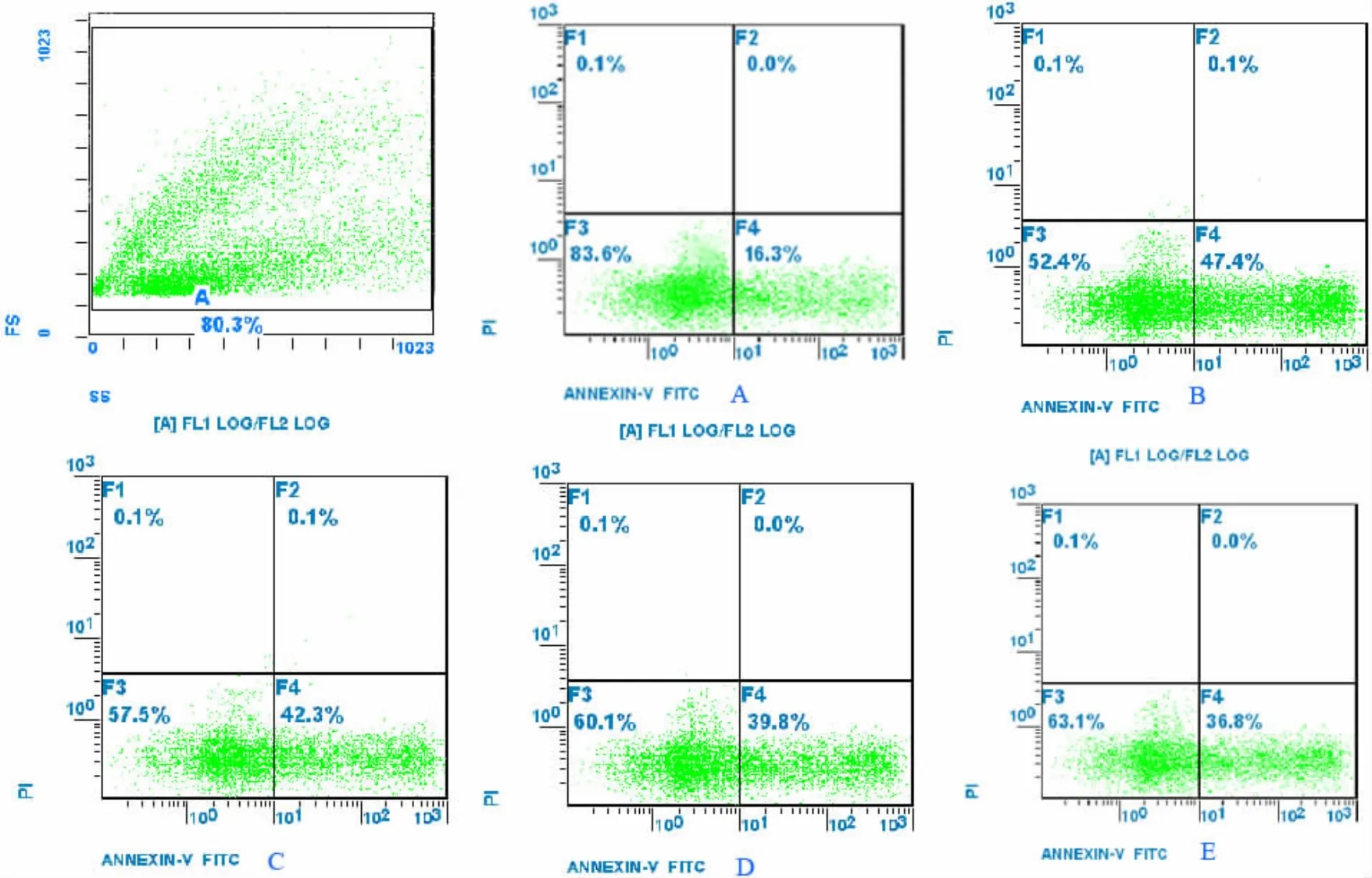
图8 JNK激动剂对H2O2诱导的EPCs凋亡的影响
3 讨论
内皮祖细胞(EPCs)最早由ASAHARA[5]分选出来,随后的研究发现,EPCs在周围血管病变所致的缺血组织和心肌梗死区的血管新生和血管形成中发挥着重要的作用。CAROLINE博士的小组对43名正常受试者、44名稳定性心绞痛患者以及33名急性冠脉综合症患者进行10个月的随访后指出冠心病患者外周血内皮祖细胞数量,形成集落数,细胞增殖能力明显降低。EPCs数量和功能受损可导致内皮损伤与修复之间的动态平衡破坏,其数量减少是预示动脉粥样硬化疾病进展的独立因素[6]。
目前,Que类药物正在成为预防和治疗冠心病的手段之一。研究表明,Que的摄入量与冠心病的发病率和死亡率呈负相关[7],Que的内皮保护作用可能与抗氧化及抑制炎症介质的作用有关,Que可以作用于NF-κB和激活蛋白-1(AP-1)而起抗炎作用,保护内皮的完整性;Que可以抑制COX-2而起抗炎作用;Que通过抑制单核细胞对血管壁的黏附而起到抗炎保护内皮的作用。此外,还有研究表明Que能抑制血管平滑肌细胞的增生肥大。Que具有内皮保护作用,但Que对EPCs功能的影响目前尚无相关研究。以往研究发现,Que可抑制肿瘤细胞增殖,诱导肿瘤细胞凋亡,而对遭受H2O2等氧化刺激因子的正常细胞来说,Que可通过阻断JNK及ERK两条途径达到抑制凋亡的发生[8]。H2O2诱导EPCs凋亡与氧化还原信号调节机制有关[9],200μmol/L H2O2可使凋亡信号调节激酶1(ASK1)活化,P38和JNK表达增加,EPCs凋亡增多[10],而 500μmol/L H2O2可造成EPCs的氧化应激损伤模型[11]。Que可通过JNK信号通路抑制细胞凋亡,而H2O2诱导EPCs氧化损伤使JNK活化增加,EPCs凋亡增多。但目前国内外尚无有关Que能否直接影响EPCs数量和功能的研究。
在本研究中,WST-1结果示:H2O2组EPCs较正常对照组增殖能力明显降低,加入60~120μmol/L的Que处理后,H2O2诱导的EPCs损伤后的细胞增殖能力得到明显改善,且具有明显的时间和浓度依赖性。而在基础状态下,60~90μmol/L的Que处理的EPCs较正常对照组增殖,而120μmol/L的Que则表现出抑制EPCs增殖的作用。可见Que对不同状态的EPCs作用是不同的,对于不同状态的EPCs需要寻找最佳的Que浓度。具体机制尚不清楚,可能与高浓度(通常在100μmol/L以上)的Que产生的细胞毒性有关。H2O2作为活性氧可促进大量氧自由基产生和脂质过氧化反应而诱发氧化应激损伤,抑制细胞功能、促进细胞衰老和凋亡,Que(60~120μmol/L)和H2O2共同干预组与 H2O2组比较能显著改善氧化应激条件下EPCs增殖功能的抑制,减少EPCs的凋亡,且具有浓度依赖性,这与之前报道的Que呈剂量依赖性的促进H2O2诱导血管内皮细胞增殖的结果较一致[12]。但更高浓度的槲皮素对氧化应激条件下EPCs增殖和凋亡的影响还有待进一步研究。
此外,本研究还显示Que在60~120μmol/L范围内随着浓度的增加,抗H2O2诱导损伤的EPCs凋亡作用均逐渐增强。有学者认为H2O2可使凋亡信号调节激酶1(ASK1)活化,P38和JNK表达增加,H2O2是诱导者,JNK是氧化损伤的维持因子。本研究中通过免疫细胞化学检测H2O2组p-JNK蛋白表达明显高于其它实验组,这可能与H2O2使EPCs的ASK1活化增加,导致JNK的持续激活从而使EPCs凋亡增多有关。Que能够抑制加入JNK激动剂后EPCs凋亡率的增加,且免疫组化显示加入Que后p-JNK阳性表达产物减少,推测Que对EPCs氧化应激损伤的保护作用除了与其抗炎、抗氧化、清除氧自由基有关外,还可能通过JNK信号通路抑制EPCs凋亡。MA[13]等报道氧化型低密度脂蛋白(oxLDL)可通过Akt/eNOS途径引起EPCs的凋亡,oxLDL通过下调Akt的磷酸化水平来抑制其下游eNOS的活性并使其表达水平降低,导致NO产量减少,从而引起EPCs的凋亡。而他汀类药物促进EPCs动员和改善其功能的分子机制与PI3K-Akt依赖的eNOS活化有关。研究表明Que可保护H2O2诱导血管内皮细胞的损伤及修复,其作用可能与NO水平有关[14],而NO由NO合酶(NOS)催化而形成,Que的抗EPCs凋亡的作用机制是否与Akt/eNOS信号通路是是下一步研究探讨的重点。
[1]VOLKER ADAMS,KARSTEN LENK,AXEL LINKE,et al.Increase of circulating endothelial progenitor cells in patients with coronary artery disease after exercise-induced ischemia[J].Arteriosclerosis, Thrombosis, and Vascular Biology, 2004, 24:684-690.
[2]LIU L,WEN T,ZHENG XY.Remnant-like particles accelerate endothelial progenitor cells senescence and induce cellular dys-function via an oxidative mechanism[J].Atherosclerosis,2009,202(2):405-414.
[3]PEICHEV M,NAIYER AJ,PEREIRA D,et al.Expression of VEGFR-2 and CD133 by circulating human CD34 (+)cells identifies a population of functional endothelial precursors[J].Blood,2000,95:952-958.
[4]VASA M,FICHTLSCHERER S,AICHER A,et al.Number and migratory activity of circulating endothelial progenitor cells inversely correlate with risk factors for coronary artery disease[J].Cir Res,2001,89(1):E1-7.
[5]ASAHARA T,MUROHARA T,SULLIVAN A,et al.Isolation of putative progenitor endothelial cells for angiogenesis[J].Science,1997,275(5):964-967.
[6]CAROLINE SCHMIDT-LUCKE,LOTHAR R?SSIG,STEPHAN FICHTLSCHERER,et al.Reduced number of circulating endothelial progenitor cells predicts future cardiovascular events[J].Circulation,2005,111:2981-2987.
[7]PERE-VIZCAINO F,DUARTE J,ANDRIANTSITOHAINA R.Endothelial function and cardiovascular disease:effects of quercetin and wine polypheonls[J].Free Radic Res,2006,40(10):1054-1065.
[8]ISHIKAWA Y,KITAMURA M.Anti-apoptotic effect of quercetin:intervention in the JNK-and ERK-mediated apoptotic pathways[J].Kidney Int,2000,58(3):1078-1087.
[9]CASE J,INGRAM DA,HANELINE LS.Oxidative stress impairs endothelial progenitor cell function[J].Antioxid Redox Signal,2008,10(11):1895-1907.
[10]INGRAM DA,KRIER TR,MEAD LE.Clonogenic endothelial progenitor cells are sensitive to oxidative stress[J].Stem Cells,2007,25(2):305-312.
[11]GENSCH C,CLEVER Y,WERNER C,et al.The PPAR-?agonist pioglitazone increases neoangiogenesis and prevents apoptosis of endothelial progenitor cells[J].Atherosclerosis,2007,192(1):67-74.
[12]LIN R,LI X,CHEN W,YANG YC,et al.Effect of quercetin on cell cycle and nitroxide in hydrogenperoxide-induced of endothelial cells[J].Chinese Pharmacological Bulletin,2001,17(2):211-213.
[13]MA FX,ZHOU B,CHEN Z,et al.Oxidized low density lipoprotein impairs endothelial progenitor cells by regulation of endothelial nitric oxide synthase[J].J Lipid Res,2006,47(6):1227-1237.
[14]URBICH C,DIMMELER S.Risk factors for coronary artery disease,circulating endothelial progenitor cells,and the role of HUMG-COA reductase inhibitors[J].Kidney Int,2005,67:1672-1676.
