异氟烷麻醉后低体温对大鼠海马的影响*
2012-11-27谭文斐田阿勇王俊科曹学照
谭文斐,田阿勇,王俊科,曹学照,马 虹
(中国医科大学第一医院 麻醉科,辽宁 沈阳 110001)
Tau蛋白是一种具有生理功能的可溶性蛋白,能够与微管蛋白结合,在神经元及轴突的生长过程中起着重要作用[1]。在正常海马记忆神经元形成过程中,tau蛋白至关重要,而在病理改变中,高度磷酸化的tau蛋白起到决定性的作用[2]。当大鼠暴露于应激反应,能够诱发外周和中枢炎性因子例如,白细胞介素-1β(IL-1β)、白细胞介素-6和肿瘤坏死因子-α(TNF-α)的释放[3]。但是,有关围术期低体温引起的海马的tau蛋白和炎性因子的影响却知之甚少。全身麻醉药能够明显地损害正常的体温调节,导致围术期低体温[4]。围术期由麻醉带来的低体温对大多数病人是有害的[5]。低体温虽然没有引起明显的神经损害,但是可能带来认知功能障碍。因此,本研究旨在探讨暴露于临床相关浓度的异氟烷是否导致tau蛋白高度磷酸化以及炎性因子表达的增加。
1 材料和方法
1.1 动物及麻醉方法
135只雄性成年SD大鼠购于中国医科大学动物实验中心,6月龄,体重 350~400 g,动物在22~23℃环境中自由活动,12:12 h日夜循环,自由进食水。大鼠吸入异氟烷(百特,美国)麻醉诱导后气管插管,机械通气维持异氟烷浓度为1.5%,潮气量2.5mL,呼吸频率65~70次/min,混合50%氧气通气2 h,麻醉期间暴露于室温或给予体温保护。期间监测大鼠心电图及直肠温。预实验结果显示本实验方法对心肺功能影响甚微(反映于正常的血气分析)。大鼠随机分为3组:健康对照组(group A;n=15)无任何干预措施。麻醉保温组(group B;n=60),大鼠异氟烷麻醉后利用加温垫保持体温在36.0~37.0℃。麻醉低体温组(group C;n=60),大鼠麻醉后暴露于22℃室温。麻醉后大鼠自然苏醒分笼饲养。B,C组大鼠分别于麻醉后2 h即刻、麻醉后1、3、7 d(15只/时点)处死,迅速取出海马置于-70°C液氮保存,标记为 B0、B1、B3、B7、C0、C1、C3 和 C7。
1.2 蛋白印迹分析
海马组织用溶解液(5 mM Tris-HCl,1mM phenylmethylsulfonyl fluoride,150mM NaCl,1%NP-40,0.5%Na deoxycholate,0.1%SDS,and protease and phosphatase inhibitors;pH 7.5) 匀浆处理后,以12000 g、4℃条件离心15min。蛋白提取物置入加样缓冲液(10%SDS,0.1M Tris pH 8.0,50 mM DTT,3 mM EDTA,0.001%bromphenol blue),100℃煮沸5min,聚丙烯酰胺凝胶电泳分离,转膜。硝酸纤维滤膜 5%脱脂奶粉的TBST(0.1%Tween 20,20mM Tris-HCl,137 mM NaCl,pH 7.6) 中封闭 2 h 后,分别与一抗兔抗鼠 Tau(phosphor-Thr205)(1∶500,Signalway Antibody,美国),兔抗鼠Tau[(phosphor-Ser396)(1∶500,Signalway Antibody,美国)]及兔抗鼠 Total tau(1∶500,Signalway Antibody,美国)4℃过夜。其后,膜与辣根过氧化物酶结合二抗室温孵育2 h。最后膜与ECL系统曝光,成像。以每条带的光密度值(IDV,Integrated Density Value)做为条带的强度指标,以β-actin的IDV值做为内参照,采用目标条带IDV与相应的β-actin IDV比值做为指标进行统计学分析[6]。
1.3 磷酸酶活性分析
利用丝氨酸-苏氨酸磷酸酶测定系统进行蛋白磷酸酶2A(PP2A)活性测定[6]。大鼠断颈处死后迅速取海马,置入磷酸酶样本缓冲液匀浆,去除颗粒物及内源性磷酸盐。取2.0μL样本溶液,在PP2A缓冲液中孵育10min,可以测定化学合成硫酸肽的释放。磷酸盐释放量可以通过630 nm时样本吸光率测定。通过比较各组与对照组吸光率比值判断PP2A活性变化。
1.4 实时定量PCR分析IL-1β m RNA和TNF-αmRNA
利用Trizol试剂将总RNA从海马匀浆液中分离。参照逆转录试剂盒(TaRaKa,中国)说明合成cDNA。RNA样品与gDNA混合42℃孵育2min。逆转录缓冲液和引物混合后加入样品42℃孵育15 min,然后95℃孵育3min。利用Applied Biosystems(Foster,美国)系统进行实时定量PCR。大鼠IL-1β引物:5'-ATCCCAAACAATACCCA-3',和 5'-CAACTATGTCCCGACCA-3';TNF-α 引物:5'-CCACGCTC TTCTGTCTACTG-3'和5'-GCTACGGGCTTGTCACT C-3';3- 磷酸甘油醛脱氢酶(GAPDH)引物:5'-GCA AGTTCAACGGCACA-3'和5'-CATTTGATGTTAGCG GGAT-3'。ABI PRISM 7500HT检测系统进行荧光测定,以GAPDH为内参照,对循环数(threshold cycle)Ct值计算后进行比较[6]。
1.5 统计学分析
2 结果
2.1 麻醉诱发低体温
麻醉后可以诱发低体温,大鼠直肠温度分别为麻醉即刻,(37.0±1.2)℃;麻醉后 30min,(34.0±1.3)℃;麻醉后 60min,(30.0±1.1)℃;麻醉后 120 min,(27.0±1.2)℃。麻醉复苏后所有动物体温均恢复正常。
2.2 低体温调节麻醉诱导的tau蛋白高度磷酸化
为了检测室温下暴露于异氟烷对大鼠脑内tau蛋白磷酸化的影响,本组测试了海马内tau蛋白两个位点的磷酸化程度。Thr205位点和Ser396位点与对照组比较分别增加了10倍和2.9倍,但total tau没有显著变化(表1)。当麻醉鼠进行保温处理时,体温持续在37℃,磷酸化位点恢复到对照组相似水平,total tau仍然没有变化。这些结果提示,麻醉对于tau蛋白磷酸化的影响并非麻醉本身的作用,而是受低体温调节。
2.3 麻醉引起的低体温抑制PP2A
基于先前研究的结果[6],麻醉期间的tau蛋白磷酸化可以归结为低体温对于丝/苏氨酸蛋白磷酸酶活性的直接抑制作用。本组利用PP2A测试试剂系统对于这一内源性脱磷酸化作用进行测试。麻醉保温组和对照组PP2A活性差异无显著性;麻醉低体温组和对照组比较,PP2A活性抑制约45%(表2)。这些数据说明,麻醉期间的tau蛋白磷酸化是低体温对于磷酸酶活性直接抑制的结果,因为麻醉低体温组与对照组改变仅仅是因为体温发生了改变。
2.4 麻醉引起的低体温诱发炎性反应
与对照组比较,麻醉期间保温并不增加IL-1β mRNA和TNF-α mRNA的表达。但是,麻醉低体温组在麻醉后2 h,麻醉后1,3 d,IL-1βmRNA表达分别增加 12.7倍(P<0.01),17.9倍(P<0.01)和 2.3倍(P<0.05)。麻醉期间低体温组在麻醉后1、3 d,TNF-αmRNA表达同样增加2.0倍和1.6倍(P<0.05)。见表 2。
表1 麻醉后低体温诱导的tau蛋白高度磷酸化(%,,n=5)

表1 麻醉后低体温诱导的tau蛋白高度磷酸化(%,,n=5)
注:1)与对照组比较,差异有显著性,P<0.05;2)与对照组比较,差异无显著性,P<0.01
组别 Total tau phosphor-Thr205 phosphor-Ser396 A 1.08±0.20 1.10±0.20 0.92±0.20 B0 1.08±0.20 0.96±0.10 1.06±0.20 C0 1.14±0.10 12.26±0.802) 4.16±0.201)B1 0.94±0.20 1.18±0.20 0.98±0.20 B3 1.16±0.10 1.00±0.30 0.84±0.10 B7 0.96±0.30 1.14±0.20 1.18±0.10 C1 1.14±0.10 1.08±0.10 1.02±0.20 C3 1.07±0.10 1.04±0.20 0.84±0.10 C7 1.2±0.10 1.10±0.30 0.86±0.10

图1 麻醉后低体温诱导的tau蛋白高度磷酸化(%,,n=5)
图2 Real-time PCR反应溶解曲线及扩增曲线
表2 麻醉后低体温对蛋白磷酸酶活性和炎性因子的影响(%,,n=5)
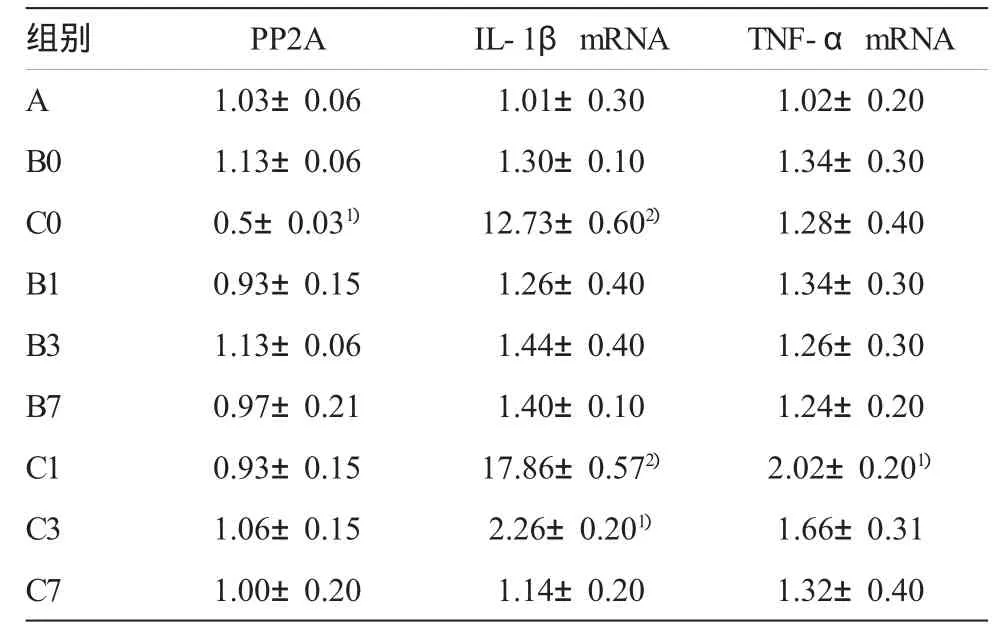
表2 麻醉后低体温对蛋白磷酸酶活性和炎性因子的影响(%,,n=5)
注:1)与对照组比较,差异有显著性,P<0.05;2)与对照组比较,差异无显著性,P<0.01
组别 PP2A IL-1βmRNA TNF-αmRNA A 1.03±0.06 1.01±0.30 1.02±0.20 B0 1.13±0.06 1.30±0.10 1.34±0.30 C0 0.5±0.031) 12.73±0.602) 1.28±0.40 B1 0.93±0.15 1.26±0.40 1.34±0.30 B3 1.13±0.06 1.44±0.40 1.26±0.30 B7 0.97±0.21 1.40±0.10 1.24±0.20 C1 0.93±0.15 17.86±0.572) 2.02±0.201)C3 1.06±0.15 2.26±0.201) 1.66±0.31 C7 1.00±0.20 1.14±0.20 1.32±0.40
3 讨论
本研究探讨了异氟烷麻醉大鼠体温的变化,海马内tau蛋白的磷酸化以及炎性因子的变化。结果提示1.5%的异氟烷麻醉后可以导致持久的低体温,抑制PP2A,诱发tau蛋白高度磷酸化。麻醉期间进行体温保护可以保持磷酸化tau蛋白在正常水平。麻醉期间低体温可以增加炎性因子IL-1βmRNA和TNF-αmRNA的表达。
已有研究表明异氟烷对于心脏的保护作用[7-8],还有研究提示,异氟烷麻醉鼠比对照组学习能力更强,体外测试长时程电位提高,海马神经元NMDA受体NR2B亚单位选择性上调[9]。异氟烷能够提高生后60 d鼠空间参考记忆,但在生后7 d的鼠面对恐惧环境和空间参考记忆,会引起海马相关性的持久损害[10]。最近的几项研究更加关注异氟烷麻醉对于神经元改变,尤其是对于细胞增殖的影响。新生鼠异氟烷麻醉后立即引起脑细胞的退行性变,但是,对于成年鼠并未观察到自主运动、,空间记忆学习能力的改变,以及神经元密度的变化[11]。对于幼鼠,异氟烷麻醉后并未观察到海马细胞的增殖,麻醉药物对于细胞抑制的机制并不明确[12]。本研究的重点也并非异氟烷对于海马功能的直接影响,而是关注异氟烷麻醉后诱发的低体温引起的海马内蛋白和炎性因子的变化,而这些变化有可能为寻找麻醉后认知功能变化提供线索。
针对于创伤、危重病人的恢复以及外科操作,低体温是保护大脑的常用手段。当伴随有低氧,缺血,炎症及外伤时,低体温治疗有其特异的效果。尤其在心血管手术中,深低体温对大脑确有独特的保护作用。但是,麻醉后诱发的低体温对于大脑皮层功能潜在的损害一直是有争议的[13]。
总之,本研究提示,临床相关剂量的异氟烷麻醉后引起tau蛋白磷酸化水平增加。这种尽管是可逆性的磷酸化的tau蛋白,能够增加tau不溶性,诱发其聚集,导致tau蛋白从微管解离。而且,神经纤维网及神经元细胞内磷酸化tau蛋白水平增加。所有这些tau病变是海马内学习记忆改变的病理学基础。而且,IL-1在皮层神经元的培养液中可以加速神经纤维缠结,说明其在tau病理中至关重要[14]。这些发现提示实验动物进行体温保护,可避免海马内蛋白磷酸化和炎性因子表达增加。而且,麻醉诱发低体温对于术后认知功能障碍的影响值得深入研究。
[1]WEINGARTEN MD,LOCKWOOD AH,HWO SY,et al.A protein factor essential for microtubule assembly[J].Proc Natl Acad Sci USA,1975,72(5):1858-1862.
[2]BOEKHOOM K,TERWEL D,BIEMANS B,et al.Improved long-term potentiation and memory in young tau-P301L transgenic mice before onset of hyperphosphorylation and tauopathy[J].J Neurosci,2006,26(13):3514-3523.
[3]CHEN J,BUCHANAN JB,SPARKMAN NL,et al.Neuroinflammation and disruption in working memory in aged mice after acute stimulation of the peripheral innate immune system[J].Brain Behav Immun,2008,22(3):301-311.
[4]TAGUCHI A,KURZ A.Thermal management of the patient:where does the patient lose and/or gain temperature[J].Curr Opin Anaesthesiol,2005,18(6):632-639.
[5]SESSLER DI.Perioperative heat balance[J].Anesthesiology,2000,92(2):578-596.
[6]PLANEL E,RICHTER KE,NOLAN CE,et al.Anesthesia leads to tau hyperphosphorylation through inhibition of phosphatase activity by hypothermia[J].J Neurosci,2007,27(12):3090-3097.
[7]覃 军,徐道妙,郭曲练,等.异氟醚预处理对猪心肺联合移植术后肺循环的影响[J].中国现代医学杂志,2005,15(3):385-387.
[7]QIN J,XU DM,GUO QL,et al.Effect of isoflurane preconditioning on pulmonary circulation of swine after combined transplantation of heart and lung [J].China Journal of Modern Medicine,2005,15(3):385-387.Chinese
[8]沈 洁,陈卫民.一氧化氮在异氟烷预处理脑保护中的作用[J].中国现代医学杂志,2007,17(21):2593-2596.
[8]SHEN J,CHEN WM.Effect of nitric oxide on isoflurane preconditioning against brain ischemia-reperfusion[J].China Journal of Modern Medicine,2007,17(21):2593-2596.Chinese
[9]RAMMES G,STARKER LK,HASENEDER R,et al.Isoflurane anaesthesia reversibly improves cognitive function and long-term potentiation (LTP)via an up-regulation in NMDA receptor 2B subunit expression[J].Neuropharmacology,2009,56(3):626-636.
[10]STRATMANN G,SALL JW,MAY LD,et al.Isoflurane differentially affects neurogenesis and long-term neurocognitive function in 60-day-old and 7-day-old rats[J].Anesthesiology,2009,110(4):834-848.
[11]LOEPKE AW,ISTAPHANOUS GK,3rd MJJ,et al.The effects of neonatal isoflurane exposure in mice on brain cell viability,adult behavior,learning,and memory[J].Anesth Analg,2009,108(1):90-104.
[12]TUNG A,HERRERA S,FORMAL CA,et al.The effect of prolonged anesthesia with isoflurane,propofol,dexmedetomidine,or ketamine on neural cell proliferation in the adult rat[J].Anesth Analg,2008,106(6):1772-1777.
[13]DELEON SY,THOMAS C,ROUGHNEEN PT,et al.Experimental evidence of cerebral injury from profound hypothermia during cardiopulmonary bypass[J].Pediatr Cardiol,1998,19(5):398-403.
[14]LI Y,LIU L,BARGER SW,et al.Interleukin-1 mediates pathological effects of microglia on tau phosphorylation and on synaptophysin synthesis in cortical neurons through a p38-MAPK pathway[J].J Neurosci,2003,23(5):1605-1611.
