玉米芯纤维素基金属螯合亲和吸附剂对牛血清白蛋白的吸附研究
2012-11-26李步海张永红
李步海,张永红
(中南民族大学化学与材料科学学院分析化学国家民委重点实验室,武汉430074)
固定化金属螯合亲和色谱法(IMAC)是近年发展起来的蛋白质分离技术,它最初由Porath 1975年引入[1],与普通的亲和层析相比,它价廉、合成方便、稳定、可选择金属离子多、可在高盐浓度下操作,容易再生等,主要适用于具有金属离子亲和能力的蛋白质吸附和分离纯化.目前商品化的IMAC亲和介质制备一般是在软基质Sepharose上用化学偶联法引入螯合剂,再通过螯合剂固定金属配基.由于软基质易被压缩,分离操作只能在低流速下进行[2],对色谱操作压力有一定的限制,限制了其在实际应用中的规模和工作效率,故载体的选择成为关键.现有研究结合亲和色谱特异性高、膜技术分离快、处理量大,成功研制了亲和膜,使生物工程产品的大规模分离纯化成为可能.纤维素不仅作为一种优良的膜材料,还是良好的亲和载体,是亲和膜介质的首选材料,而制备价廉易得的产品成为研究者的首要任务.
玉米在我国产量丰富,玉米芯的主要成分是纤维素、半纤维素和木质素,纤维素和半纤维素都是可再生资源,目前在工业生产中仅利用了玉米芯的半纤维素,故将玉米芯纤维素用于蛋白质分离纯化和酶固定化基质材料具有很好的应用前景.
研究表明,以纤维素滤纸为材料制备固定化金属亲和膜用于Cu/Zn-SOD的分离、人血清白蛋白除杂及其他生化制剂的纯化等,都取得良好的效果[3-4].本研究以玉米芯纤维素为基质制得螯合有不同金属离子的IDA型亲和吸附剂,应用该吸附剂进行牛血清白蛋白(BSA)的吸附.通过考察溶液的pH值、离子强度等不同条件下BSA在吸附剂上的保留行为,探讨了固定金属与蛋白质间的相互作用机理,为蛋白质的分离纯化提供理论依据.
1 实验部分
1.1 材料与仪器
实验用玉米芯由山西农户提供,粉碎后过200目筛,与去离子水充分混匀,浸泡24 h,去除悬浮细小物质和可溶性物质,室温下风干备用.环氧氯丙烷(EPI)、亚氨基二乙酸(IDA)、BSA购于上海试剂公司,乙二胺四乙酸二钠(EDTA)、CuSO4·5H2O等均为国产分析纯试剂.
酸度计(PHS-4型,上海大普仪器有限公司),集热式恒温加热磁力搅拌器(DF-101S,上海卫凯制冷仪器设备有限公司),恒温水浴摇床(SHZ-03,上海堪鑫仪器设备有限公司),X射线光电子能谱仪(VGMultilab 2000),傅立叶红外光谱仪(NEXUS 470智能型,美国珀金一埃尔默公司),荧光/磷光/发光光度计(LS-55型,美国PE公司).
1.2 Me(金属离子)亲和吸附剂的制备
将玉米芯与 NaOH(0.04 g/mL)-H2O2(5×10-3g/mL)水溶液按固液比为1∶8混均后于95~100℃水浴4 h,取出真空抽滤,低温干燥剩余固体备用[5-7].将制得的玉米芯纤维素放入4 mol/L NaOH溶液溶胀45min后,再加入20mL的环氧氯丙烷(EPI)、二甲基亚砜(DMSO)混合液(1∶1,V/V),放入70℃水浴中活化45min,将活化后的玉米芯纤维素用大量去离子水洗至中性.称取适量的亚氨基二乙酸(IDA),用10mL 1.5 mol/L Na2CO3溶液溶解,放入活化好的玉米芯纤维素,60℃偶联反应15~16 h,去离子水洗至中性.取4份分别浸入到浓度为0.05 mol/L的 CuSO4、FeSO4、ZnSO4、NiSO4溶液中,3 h后取出,并用去离子水洗至无残余的金属离子,制得4种金属离子螯合的玉米芯纤维素亲和吸附剂备用.
1.3 Me(金属离子)亲和吸附剂的表征
1.3.1 红外光谱(FIIR)
将修饰前后的吸附剂用KBr粉末压片后,在红外光谱仪上观察4000~400cm-1各峰的变化,研究修饰前后吸附剂表面官能团的变化.
1.3.2 X射线光电子能谱分析(XPS)
用XPS分析修饰前后纤维素表面的各元素成分的变化,干燥的样品表面在10-8托真空度条件下,用Mg X-ray分析,谱图用284.6 eV的C1s基碳峰校正,Avantage 3.22软件拟合.
1.3.3 金属离子螯合量的测定
准确称取一定量的金属螯合吸附剂,加入同体积同浓度(0.05mol/L)的EDTA溶液于恒温振荡器振荡3 h,离心后,原子吸收分光光度法测定上清液中金属离子的量即为金属离子螯合量.
1.3.4 BSA 的吸附
分别称取20.0 mg干燥的吸附剂各2份,置于2个25 mL锥形瓶中,设为1、2号.l号加入10 mL磷酸盐缓冲溶液,2号加人10 mL 0.4 g/L BSA缓冲溶液,25℃摇床,130 r/min振荡吸附10 h,取上清液.以l号为参比,2号加入初始浓度的BSA液为对照,用荧光分光光度计在激发波长为280nm,发射波长为350 nm下测定其荧光强度值,计算亲和吸附剂的吸附量.
1.3.5 BSA 的洗脱
用不同浓度的NaCl和NaSCN溶液对吸附了BSA的吸附剂洗脱.在1号、2号移去上清液的2个锥形瓶中各加入10 mL洗脱剂,25℃摇床振荡10 h后,取上清液,测定BSA含量,计算洗脱率.
2 结果与讨论
2.1 玉米芯纤维素金属螯合吸附剂的表征
2.1.1 红外光谱(FIIR)
IDA成功修饰到吸附剂表面,反应历程见图1.在结合环氧氯丙烷(EPI)和亚氨基二乙酸(IDA)这2个步骤中,使用红外光谱检测,结果见图2.由图2可见,曲线a中于1250、866 cm-1出现环氧基的特征谱带.曲线b中环氧基的特征谱带消失,于1784cm-1出现吸收带.这是由于环氧基与螯合物(IDA)发生偶联反应后产生的特征谱带.

图1 反应历程Fig.1 Reaction process

图2 交联纤维素和修饰纤维素红外光谱图Fig.2 FTIR spectra of the cellulose before and after modification
2.1.2 X射线光电子能谱分析(XPS)
交联纤维素及修饰纤维素表面C、O、N、Cl 4种元素所占比例如表1所示.由表1可见,由于在纤维素表面连接了亚氨基二乙酸(IDA),修饰纤维素表面各元素的比例变化较大,尤其是N和O的比例提高很大.说明IDA成功地修饰到了纤维素表面,XPS结果和红外解析结果一致.

表1 交联纤维素和修饰纤维素各元素比例比较Tab.1 Comparison of element proportions of the cellulose before and after modification
2.1.3 金属螯合量的测定
分别称取2份同等质量的交联纤维素和修饰纤维素,加入同体积同浓度(0.05 mol/L)的金属离子溶液进行螯合反应,随后加EDTA解析,通过原子吸收分光光度法(AAS)测定螯合反应后的上清液和解析液中金属离子的浓度,发现交联纤维素未结合金属离子,而修饰纤维素螯合了金属离子 Cu、Zn、Fe、Ni,具体含量见表2.

表2 不同金属离子螯合量Tab.2 Chelate quantity of different metal
由表2可知,修饰纤维素螯合Zn最高,Cu次之,而 Fe、Ni较少.
2.2 BSA吸附行为的影响因素
2.2.1 溶液 pH
溶液pH对牛血清白蛋白吸附率的影响结果见图3.由图3 可见,在 pH 3.0~8.0,Cu(Ⅱ)螯合吸附剂的吸附率无显著变化;而 Fe(Ⅱ)、Zn(Ⅱ)、Ni(Ⅱ)螯合吸附剂的吸附率则变化很大.说明BSA在Cu(Ⅱ)螯合吸附剂上的保留几乎不受酸度的影响,而在Fe(Ⅱ)、Zn(Ⅱ)、Ni(Ⅱ)螯合吸附剂上的吸附受 pH 影响较大.

图3 溶液pH对牛血清白蛋白吸附率的影响Fig.3 Effect of pH on BSA adsorption ratio
在 pH 5.0~8.0,BSA 在 Fe(Ⅱ)、Zn(Ⅱ)、Ni(Ⅱ)螯合吸附剂上吸附率很小,而在Cu(Ⅱ)螯合吸附剂上吸附率近20%.说明BSA在吸附剂上的保留是静电与配位协同作用的结果.静电作用的大小主要取决于金属螯合配体和蛋白质所带电荷,两者电荷差异越大,静电作用越强[8].而金属螯合配体和蛋白质所带电荷与溶液pH有关,实验所用BSA 的 pI为4.7.因在 pH 5.0~8.0 时配位水分子的去质子化作用,金属螯合配体带负电荷,而BSA也带负电荷,静电排斥作用使BSA在除Cu螯合吸附剂(以配位作用为主)外的Fe、Zn、Ni螯合吸附剂上均不保留.
2.2.2 BSA 初始浓度
BSA的初始浓度与4种吸附剂吸附量的关系见图4.

图4 牛血清白蛋白初始浓度对吸附容量的影响Fig.4 Effect of BSA initial concentration on the adsorption capacity
由图4可见,随着BSA初始浓度的增加,4种吸附剂的吸附量逐渐增加,吸附饱和后吸附量基本不变.螯合了Cu(Ⅱ)、Ni(Ⅱ)亲和吸附剂的吸附容量较低,在BSA初始浓度分别为0.8,1.0 mg/mL时,达到最大值71.03,69.01 mg/g;Fe(Ⅱ)、Zn(Ⅱ)螯合吸附剂的吸附容量较高,在初始浓度分别为1.0,0.6 mg/mL 时,吸附容量分别达最大值99.38,121.3 mg/g.
分别用Langmuir和Freundlich吸附模型模拟各吸附等温线,结果见图5,模拟参数见表3.由表3可知,Langmuir模型模拟 Cu(Ⅱ)、Zn(Ⅱ)、Fe(Ⅱ)、Ni(Ⅱ)螯合亲和吸附剂吸附BSA的相关系数分别为0.9568,0.9998,0.9979,0.9973.算得4 种吸附剂对BSA最大理论吸附容量分别为61.94,121.58,99.34,70.32 mg/g,均和实验值 71.03,121.3,99.38,69.01mg/g 接 近.比 较 Langmuir和Freundlich吸附模型的相关系数,可见4种吸附剂的吸附模式更符合Langmuir模型.说明吸附过程是以单分子层吸附为主,被吸附的分子在吸附剂表面没有转移,且被吸附的分子间的相互作用可忽略不计.

图5 Langmuir和Freundlich等温线吸附模拟图Fig.5 Langmuir and Freundlich isotherms for BSA adsorption
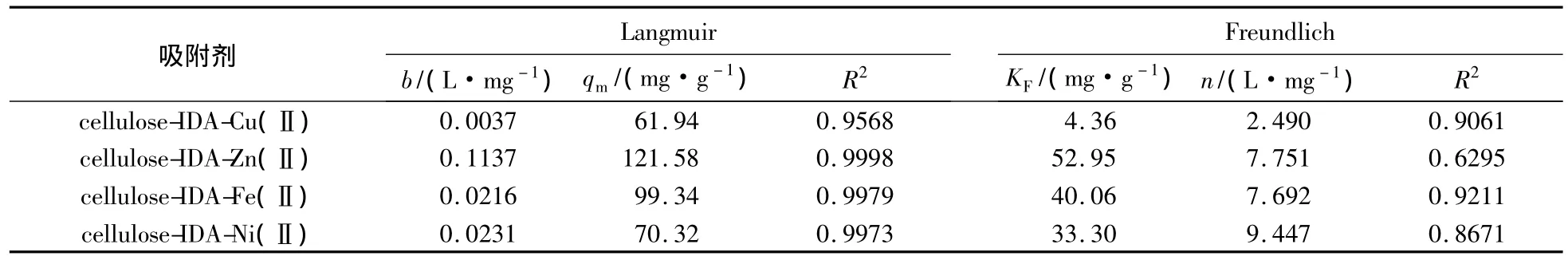
表3 吸附剂对牛血清白蛋白吸附等温线Langmuir和Freundlich模拟参数Tab.3 Langmuir and Freundlich parameters for the absorption of BSA on the adsorbent
2.2.3 介质中离子强度
介质中离子强度对BSA吸附率的影响结果见图6.由图6可见,Cu(Ⅱ)螯合吸附剂,随着离子强度的增加,BSA的吸附率几乎没有变化,而Fe(Ⅱ)、Zn(Ⅱ)、Ni(Ⅱ)螯合吸附剂,随着离子强度的增加,BSA的吸附率迅速降低.说明Cu(Ⅱ)螯合吸附剂吸附BSA基本不受离子强度的影响,以配位作用为主.而其他金属离子螯合吸附剂对蛋白质的吸附受离子强度影响较大,以静电作用为主.此外,Fe、Zn、Ni螯合吸附剂对BSA的吸附,在盐浓度增大到一定值后,吸附率会随着盐浓度的增大而升高,是由于盐浓度较高时,盐析作用提高了蛋白质的吸附率.

图6 离子强度对吸附率的影响Fig.6 Effect of NaCl concentration on the adsorption ratio
2.2.4 温度
在15~35℃ 随着温度的升高,吸附率增大.这是因为溶液中分子热运动加剧,吸附量增加.当温度达到25℃后,吸附率变化不大,表明吸附可在较宽的温度范围内进行.
2.3 BSA 的洗脱
为选择适宜的洗脱液,在保证固定金属离子不严重流失的情况下,将吸附有BSA的亲和吸附剂分别用NaCl、NaSCN进行洗脱.结果表明,金属Cu螯合亲和吸附剂吸附的蛋白质由于亲和力强,通过改变离子强度的方法进行洗脱几乎无效,加入竞争洗脱剂如NaSCN[9]后,其洗脱率可提高到75%.因为竞争洗脱剂可与金属离子竞争结合蛋白质表面配体如—NH2、—S或—COO-,降低配体与金属离子的结合能力.部分竞争洗脱剂(如EDTA)与固定金属离子间的配位作用较强,易造成固定金属离子泄露,故选用竞争洗脱剂的种类要适当.而对于弱结合力的 Fe(Ⅱ)、Zn(Ⅱ)、Ni(Ⅱ)[10]螯合亲和吸附剂吸附的BSA,则可通过改变离子强度(1 mol/L的NaCl或NaSCN)洗脱,洗脱效果几乎相同,进一步说明这些金属离子螯合亲和吸附剂对BSA的吸附主要是受到静电作用影响.
3 结论
(1)用玉米芯纤维素做基质,通过预处理、修饰等步骤研制成了亲和吸附剂,可用于吸附BSA,该法利用了农作物废弃物,成本低,制备和吸附操作简便.
(2)固定金属离子的种类、溶液pH、离子强度等是影响BSA与金属螯合亲和吸附剂作用及吸附量的主要因素.
(3)BSA与亲和吸附剂之间的作用力与固定金属离子的种类有关.对强亲和性的Cu(Ⅱ)螯合吸附剂,以配位作用为主,静电作用为辅;对于弱结合力的Fe(Ⅱ)、Zn(Ⅱ)、Ni(Ⅱ)螯合吸附剂,静电作用为主,配位作用为辅.
(4)可通过改变洗脱液pH、盐浓度或加入竞争洗脱剂吸附在亲和吸附剂上的BSA.
[1]Porath J,Carlsson J,Olsson I,et al.Metal chelate affinity chromatography,a new approach to protein fractionation[J].Nature,1975,258(5536):598-599.
[2]魏 琪,姚汝华,鲍时翔.固定化金属螫合亲和膜色谱柱的制备及纯化铜锌超氧化物歧化酶的研究[J].色谱,2000,28(4):353-361.
[3]商振华,郭 为,于亿年,等.化学改性纤维素亲和膜色谱用作人血清白蛋白中杂质的去除[J].分析测试学报,1995,14(4):28-32.
[4]魏 琪,姚汝华.固定化金属螯合亲和膜纯化重组抗菌肽研究[J].生物化学与生物物理进展,2000,27(4):401-403.
[5]魏 琪,姚汝华,鲍时翔.固定化金属螯合亲和膜色谱柱制备及纯化铜锌超氧化物歧化酶的研究[J].色谱,2000,18(4):361-363.
[6]吕晓霞,李海燕.不同预处理方法对玉米芯成分的影响[J].林产化工通讯,2004,38(2):11-13.
[7]Wu C Y,Suen S Y,Chen S C,et al.Analysis of protein adsorption on regenerated cellulose-based immobilized copper ion affinity membranes[J].J Chromatogr A,2003,996(1/2):53-70.
[8]Anspach F B.Silica-based metal chelate affinity sorbents I.Preparation and characterization of iminodiacetic acid affinity sorbents prepared via different immobilization techniques[J].J Chromatogr,1994,672(1/2):35-49.
[9]Odabasi M,Uzun L,Adil Denizli A.Porous magnetic chelator support for albumin adsorption by immobilized metal affinity separation[J].J Appl Polym Sci,2004,93(5):2501-2510.
[10]李 蓉,陈国亮.金属螯合亲和色谱中固定金属与蛋白质的作用[J].分析化学,2002,30(5):552-555.
