含羧酸的环金属化钌配合物的合成与表征
2012-11-26李襄宏史正建陈伟爱
李襄宏,史正建,陈伟爱
(中南民族大学化学与材料科学学院,武汉430074)
钌(Ⅱ)联吡啶配合物因其丰富的光物理和光化学性质受到关注,在光化学传感器[1]、生物化学[2]、及染料敏化电池[3]等领域应用广泛.与传统的钌联吡啶配合物相比,环金属化钌配合物采取的是C,N-配位形式,结构更稳定,光物理性质更丰富[4-6].鉴于目前国内对环金属化配合物研究较少[7-9],故以合成为目标,期望通过其光物理性质研究开发新型材料.本文以2-(2,4-二氟苯基)-4-吡啶甲酸乙酯为 C,N-配体,1,10-菲罗啉为 N,N-配体,合成和表征了一个新的含羧酸结构的环金属化钌配合物Ru-1(图1),可利用该配合物羧基键合到纳米二氧化钛上制备染料敏化电池[3],为设计合成具有优良性能的光染料敏化剂提供新思路.
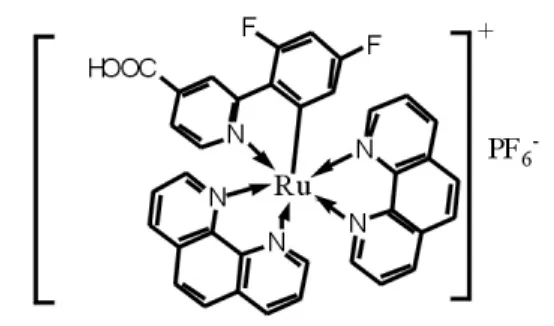
图1 环金属化钌(Ⅱ)配合物Ru-1的结构图Fig.1 Structure of cyclometalated ruthenium(Ⅱ)complex Ru-1
1 实验部分
1.1 试剂与仪器
[(η6-i-pr-C6H6)RuCl]2(Aldrich 公司),其他试剂(上海中国医药集团化学试剂公司).
紫外-可见光谱仪(LambdaBio 35型,德国Perkin Elmer公司),核磁共振仪(Bruker 400 MHz,瑞士Bruker公司),傅里叶红外光谱仪(Nexus 470 FT-IR型,KBr压片,美国 Nicolet公司).
1.2 钌配合物Ru-1的合成
2-溴-4-吡啶甲酸乙酯按文献[10]方法合成并通过1HNMR表征,钌配合物参考文献[11]方法合成,如图2所示.

图2 配合物Ru-1的合成Fig.2 Synthesis of complex Ru-1
1.2.1 中间体1的合成
氩气保护下,三颈瓶中加入20 mL无水乙腈,再依次加入钌络合物 (0.1224g,4 ×10-4mol)、2-(2,4-二氟)苯基-4-吡啶甲酸乙酯 (0.1035g,2 ×10-4mol)、KPF6(0.1472g,2 ×10-4mol)和 NaOH(0.016g,4 ×10-4mol),45℃搅拌24 h,旋蒸除去溶剂.用少量水快速洗涤产物2~3次,再用少量乙醇、乙醚分批洗涤2~3次,减压抽干后直接将该产物(0.1035 g,2×10-4mol)溶解在15 mL无水甲醇中,并加入1,10-邻菲罗啉 (0.063g,0.35mol)回流24 h后停止反应,将溶剂旋干后柱层析分离,得到红黑色固体0.1172g,产率为 68%.1HNMR(CD3CN,400MHz):8.75(s,1H),8.54~8.53(d,1H),8.48~8.47(d,2H),8.42~8.39(m,2H),8.18(d,4H),8.06(s,1H),7.88(s,1H),7.83(s,1H),7.67~7.65(m,3H),7.48~7.47(d,1H),7.28(s,1H),6.48~6.43(t,1H),5.91(d,1H),4.37、3.95、1.35 为酯基上乙基及甲基的H信号.
1.2.3 配合物Ru-1的合成
将中间体1(41 mg,4.7×10-5moL)置于锥形瓶中,加入0.3 g/mL KOH/乙醇(体积比1︰5)溶液10 mL后,微热搅拌12 h.反应完毕后,将溶剂旋蒸干,加入少量水溶解后,减压抽滤.将母液用HNO3酸化至pH=3后,离心分离沉淀,并于烘箱中烘干,再加入1~2滴KOH溶解沉淀于少量CH3OH中,用中性Al2O3柱层析分离,得红色组分.旋蒸干溶剂,少量清水洗至中性后,离心分离,得红黑色粉末18.8mg,产率为51%.1HNMR(d6-DMSO,400MHz):8.70~8.65(m,4H),8.56~8.55(d,1H),8.31~8.27(m,5H),8.17(s,1H),8.05(s,1H),7.83(s,5H),7.63~7.62(d,1H),7.36(s,1H),6.62~6.59(t,1H),5.76(s,1H).
2 结果与讨论
2.1 配合物的合成
含有羧基的配体在乙腈中溶解度很差,使用含酯基的配体合成相似结构的配合物后再水解即得Ru-1.在配合物合成过程中,NaOH使C,N-配体上的碳脱氢形成碳阴离子与钌配位.因配体中含有酯基,NaOH也有脱酯作用,故与甲醇回流后,无法得到单一的含乙酯的中间体1,混杂了部分甲酯的产品.为获得含羧基的配合物Ru-1,直接将含有甲酯和乙酯的中间体1在KOH-醇体系进行水解得到目标产物,产率达到51%,比文献[12]报道的DMF/H2O/三乙胺体系的产率(16%)有较大提高.
2.2 IR光谱
将所得红黑色固体粉末用KBr压片,在红外光谱仪上得到其IR光谱,如图3所示.由图3可见,水解前后中间体1及Ru-1的吸收峰显著不同,一些特征的吸收峰均发生位移.Ru-1中归属于羧基中羰基的伸缩振动吸收峰出现在1712.7cm-1;中间体1的酯羰中羰基的伸缩振动吸收峰出现在1724.9cm-1.与Ru-1相比,中间体1在3000 cm-1以下出现的归属于酯基上甲基和乙基中C-H伸缩振动吸收峰在水解后消失.这两组主要的特征吸收峰的区别证实中间体1水解成了Ru-1,并能通过1HNMR数据进一步证实.

图3 中间体1和Ru-1的FT-IR图谱Fig.3 FT-IR spectra of intermediate 1 and Ru-1
2.3 中间体1和配合物Ru-1的1HNMR谱
将中间体1溶解在氘代乙腈中获得的1HNMR谱,结果见图4.由图4可见,第一步配体合成反应中加入了NaOH和CH3CN,导致大部分—COOC2H5水解;第二步配合物合成的反应是在甲醇中回流,使水解的部分又转变为—COOCH3.故导致中间体1存在—COOCH3和—COOC2H5.化学位移在1.35的信号峰与4.37的信号峰积分比例为3︰2,应归属于配合物上—COOC2H5的甲基及亚甲基上的氢;而在3.95左右的峰则是—COOCH3的甲基[12].由于与金属钌配位,所有位于芳环区域的氢信号峰均宽化,其裂分及耦合情况难辨,但从低场范围的信号比例和所含氢的个数来看,与中间体1吻合.
由于Ru-1含有羧酸,在常用溶剂中的溶解度很差,只能使用DMSO.通过二者氢谱对比可见,中间体1在KOH-乙醇体系中已经完全水解,可从中间体1酯基上的H信号消失得证.8.70~5.72均为苯环和吡啶环上H的信号峰[4-6],积分结果与目标产物一致.

图4 中间体1和Ru-1的1HNMR图谱Fig.4 1HNMR specta of intermediate 1 and Ru-1
2.4 UV-Vis光谱
配合物Ru-1和中间体1在乙醇溶液中的紫外-可见吸收光谱结果见图5.由图5可见,该配合物呈现典型的钌联吡啶配合物的特征吸收[3-12].350 nm以下的吸收峰属于π-π*跃迁,其中230 nm左右的吸收峰是配体2-(2,4-二氟)苯基-4-吡啶衍生物的π-π*跃迁吸收,而260 nm左右的吸收峰则属于配体1,10-菲啰啉的π-π*跃迁.360 nm以上的吸收峰是金属↔配体间电荷转移跃迁吸收,即MLCT态跃迁吸收.Ru-1的最大MLCT态吸收峰(524nm)比水解前中间体1的最大MLCT吸收峰(475 nm)红移了近50 nm.由此可见,配体结构上的微调能影响到配合物的能级,从而改变其光谱性质.

图5 中间体1和Ru-1在乙醇溶液中的UV-Vis图谱(c=2.0 ×10-5mol/L)Fig.5 UV-Vis spectra of intermediate 1 and Ru-1 in ethanol(c=2.0 ×10-5mol/L)
3 结语
以2-(2,4-二氟)苯基-4-吡啶甲酸乙酯为 C,N-配体,1,10-菲啰啉为N,N-配体合成了一个新的含羧酸结构的环金属化钌配合物.并通过红外光谱、核磁共振氢谱和紫外-可见光谱表征了配合物的结构.紫外-可见吸收光谱表明:该配合物的金属到配体的电荷转移跃迁(MLCT)最大吸收值位于524 nm,比水解前的配合物红移近50 nm.由于酯基水解后,羧基与酯基供电子性能不同,改变了配合物的能级,使配合物的光吸收发生变化.
[1]Sun Y,Hudson Z M,Rao Y,et al.Tuning and switching MLCT phosphorescence of[Ru(bpy)3]2+complexes with triarylboranes and anions[J].Inorg Chem,2011,50(8):3373-3378.
[2]张小年,刘亚楠,杨晓新,等.钌配合物诱导肿瘤细胞凋亡的信号通路及其作用机制[J].化学进展,2011,23(5):983-990.
[3]凡素华,王科志.钌配合物基太阳能电池光敏剂分子设计的最新研究进展[J].无机化学学报,2008,24(8):1206-1212.
[4]Wadman S H,Kroon J M,Bakker K,et al.Cyclometalated organoruthenium complexes for application in dye-sensitized solar cells[J].Organometallics,2010,29(7):1569-1579.
[5]Bomben P G,Robson K C D,Sedach P A,et al.On the viability of cyclometalated Ru(Ⅱ)complexes for lightharvesting applications[J].Inorg Chem,2009,48(20):9631-9643.
[6]Koivisto B D,Robson K C D,Berlinguette C P.Systematic manipulation of the light-harvesting properties for tridentate cyclometalated ruthenium(Ⅱ)complexes[J].Inorg Chem,2009,48(20):9644-9652.
[7]Zhong Y W,Wu S H,Burkhardt S E,et al.Mononuclear and dinuclear ruthenium complexes of 2,3-Di-2-pyridyl-5,6-diphenylpyrazine:synthesis and spectroscopic and electrochemical studies[J].Inorg Chem,2011,50(2):517-524.
[8]Yao C J,Zhong Y-W,Yao J.Charge delocalization in a cyclometalated bisruthenium complex bridged by a noninnocent 1,2,4,5-tetra(2-pyridyl)benzene ligand[J].J Am Chem Soc,2011,133(39):15697-15706.
[9]李襄宏,史正建,程新建.一种新的环金属化钌配合物的合成和表征[J].中南民族大学学报:自然科学版,2011,30(4):16-19.
[10]Li X,Chen Z,Zhao Q,et al.Nonconjugated dendritic iridium(Ⅲ)complexes with tunable pyridine-based ligands:synthesis,photophysical,electrochemical,and electroluminescent properties[J].Inorg Chem,2007,46(14):5518-5527.
[11]Lagadec L R,Estevez H,Cerón-Camacho R,et al.Cyclometalated ruthenium(Ⅱ)complexes of benzo[h]quinoline(bzqH)[Ru(bzq)(NCMe)4]+,[Ru(bzq)(LL)(NCMe)2]+and[Ru(bzq)(LL)2]+(LL=bpy,phen)[J].Inorg Chim Acta,2010,363(3):567-573.
[12]Bomben P G,Thériault K D,Berlinguette C P.Strategies for optimizing the performance of cyclometalated ruthenium sensitizers for dye-sensitized solar cells[J].Eur J Inorg Chem,2011,2011(11):1806-1814.
