附子化学成分含量测定方法研究进展
2012-11-24雷崎方斯建勇
雷崎方,斯建勇
中国医学科学院北京协和医学院药用植物研究所,北京100193
附子化学成分含量测定方法研究进展
雷崎方,斯建勇*
中国医学科学院北京协和医学院药用植物研究所,北京100193
附子是中药中“回阳救逆第一品药”,具有强心、抗休克、抗心律失常、抗炎镇痛等功效。本文在分析附子相关文献的基础上,概括了附子中化学成分的含量测定方法的研究现状,对其主要活性成分生物碱类、嘧啶类、多糖类及微量元素的含量测定方法进行了介绍和讨论,涉及的方法包括滴定法、分光光度法、薄层扫描法、高效液相色谱法、色谱质谱联用、高效毛细管电泳法等,为进一步全面有效控制附子的质量以及附子活性物质的基础研究与开发提供参考。附子;化学成分;生物碱;含量测定;综述
附子为常用中药,始载于《神农本草经》。《中国药典》2010版一部收载的附子为毛茛科植物乌头Aconitum carmichaeli debx.的子根的加工品,产于四川、湖北、湖南等地[1]。附子属温里药,是中药中“回阳救逆第一品”,具有回阳救逆,补火助阳,散寒止痛的功效。附子所含化学成分主要是生物碱,此外还含有苷类、甾醇类、无机盐类等,附子的有效成分尚未完全阐明,生物碱类既是其毒效成分,也是附子的有效成分之一。随着化学和药理研究的不断深入,附子中的其他成分,如尿嘧啶、多糖及微量元素也被分离得到并被证明具有一定的药理活性。2010版药典中共收载处方中含有附子的中成药制剂共27种,其中有16种要求检查乌头碱的含量,由此可见要有效控制附子的质量,主要是控制附子中的毒效和有效成分。本文在整理附子相关文献的基础上,就近十年来有关附子化学成分的分析方法进展情况做一归纳和评述,为附子乃至乌头中有效与毒效成分的质量控制提供参考。
1 生物碱的含量测定
1.1 总生物碱的含量测定
1.1.1 酸碱中和法
可以用酸直接滴定,也可以先加定量酸液及指示剂再用氢氧化钠回滴定。由于直接滴定法终点突破不明显,难以判断,报道中多采用回滴定法,一般以甲基红为指示剂,氢氧化钠滴至黄色,可用于检测不同炮制方法对附子总生物碱含量影响的动态影响情况[2],以及不同煎煮时间对附子总生物碱的影响[3]。此法简单易行,准确性稳定性较理想,但灵敏度低,所需要的样品量大。
1.1.2 分光光度法
主要采用以下两种方法:一、酸性染料比色法,即利用生物碱与酸性染料如溴甲酚绿、溴麝香草酚蓝等在一定pH条件下络和生成离子对化合物后再进行比色测定的方法。由于该离子对化合物是疏水性的,一般用氯仿为溶剂,若以氯仿进行萃取,此法又可称为“离子对萃取-分光光度法”。目前,已采用此法对附子及其制剂的总碱含量进行了测定,测定条件见表1。此法虽然其实验结果受溶液pH影响大,在操作过程中应使用好缓冲盐维持溶液pH的稳定性,另外指示剂配制、处理均影响呈色稳定性,颜色稳定时间较短,需用对照品绘制标准曲线,但在控制好实验条件的情况下,此法准确可靠、简便易行、专属性好,易于推广。二、一阶导数UV光谱法,龙沛霞等[4]采用一阶导数光谱法测定制川乌、制草乌及附子中乌头生物碱含量。测得结果与中国药典(1995年版)方法的测定结果比较无显著差异,而该方法操作起来更简便。

表1 酸性染料比色法测定附子及其制剂总生物碱含量的条件Table 1 Determination of total alkaloids in Fuzi and preparations by acid dye colorimetry
1.1.3 非水滴定法
又称碱量法[14],取粉末用氨水碱化后,在索氏提取器中用乙醚提取,醚液再用0.1 mo1/L硫酸溶液提取,酸液经碱化后用氯仿提取,氯仿提取液用无水硫酸钠干燥后,蒸去氯仿,用乙醚溶解,再蒸去乙醚,残渣溶于醋酐中,用0.01 mol/L高氯酸标准溶液滴定,以甲基紫为指示剂,所得总生物碱以乌头碱计算。此法现在使用较少。
1.2 酯型生物碱的含量测定
附子中生物碱包含双酯型生物碱、单酯型生物碱、醇胺型生物碱和其他类生物碱,这几种生物碱的毒性差异极大,单酯型生物碱为双酯型生物碱的1/ 100~1/200,醇胺型生物碱为双酯型生物碱的1/ 2000~1/4000,因此要衡量附子的毒性应以附子中的酯型生物碱,尤其是双酯型生物碱为指标。
1.2.1 改良的异羟戊酸反应-高氯酸铁分光光度法
生附片及附子蒸制品和煮制品[2]、参附注射液、附子注射液、金匮肾气丸、附子理中丸、三生针等[15]经处理后,加入碱性盐酸羟胺,60℃水浴10 min,再加高氯酸铁试液及pH=0.5的高氯酸显色,于525 nm处测定,可得到酯型生物碱的总量。此法实用、操作简单、不需要高精仪器设备,但该法灵敏度低,干扰因素较多,重现性不够理想。
1.2.2 离子选择电极法
该法是利用四苯硼-乌头类生物碱活性物质研制的电化学检测器,其电极电位在乌头类生物碱一定的浓度范围内符合Nernst方程,可建立起相对标准工作曲线,从而直接对乌头类生物碱进行定量测定。徐红雨[16]报道了四苯硼-乌头类生物碱活性物质的方法,所制的石墨涂抹电极对乌头类生物碱响应良好,并运用此法测定了不同产地的附子及不同的附子炮制品中乌头类生物碱的含量,认为此法选择性高,不另需要内参比电极和内参比溶液,成本低廉,制作简单,使用方便,利于推广。
1.2.3 复合缓冲纸层析-UV比色法[17]
此法可以测定附子中双酯型生物碱的总量。方法是在滤纸上涂布不同pH的磷酸氢二钠-柠檬酸缓冲液,以苯-石油醚(5∶1)上行展开后,层析纸于254 nm下观测荧光,剪下pH=3蓝色荧光带,用95%乙醇洗脱后进行比色测定。此法的原理是单酯型生物碱及醇胺型生物碱中含的羟醇类成分是其在复合缓冲纸层析上的位置都集中在pH=7区段以下,此法较为简单易行。
1.2.4 气相色谱法
戴忠等[18]采用气相色谱法测定了风湿骨痛酒中的酯型乌头碱含量。色谱柱为2 m×3 mm玻璃柱填充102酸洗白色担体(80~100目);固体相10%DEGS+1%H3PO4;检测器FID(230℃);载气为氮气;柱温195℃,平均回收率为98.4%。此法检测灵敏度高,样品用量少,可作为附子及其复方制剂中酯型生物碱的含量测定提供参考。
1.3 单个生物碱的含量测定
1.3.1 薄层扫描法
该法灵敏度高,操作简便,能快速准确的进行定性定量检查,多用于毒性成分乌头碱的含量测定与限量检查,现将从文献中收集的用薄层扫描法测定药材或制剂中乌头碱含量的色谱条件及实验结果列于表2中,以供参考。

表2 薄层扫描法测定附子及其制剂乌头碱含量的条件及结果Table 2 Determination of aconitine in Fuzi and its prepatation bu TLCS
1.3.2 高效液相色谱法
高效液相色谱法既具有高温、高速、高灵敏度、高分辨度等优点,因其测定成分多,结果准确而极受欢迎[25]。附子中的生物碱极性较强,比较适合用高效液相色谱分析[26]。可通过控制流动相的组成和配比使被分析生物碱达到基线分离而被分析,常用的流动相有甲醇-水-氯仿-三乙胺系统、甲醇-水-氯仿-二乙胺系统、甲醇-水-乙腈系统、无水乙醇-醋酸铵系统、乙腈-醋酸铵系统等。
1.3.2.1 紫外检测器 紫外检测器是高效液相色谱最常用的检测器,具有灵敏度高,稳定性好,线形范围广等特点,但只适用于具有紫外吸收的乌头类生物碱的含量测定。已可同时测定六种乌头类生物碱的含量,现将文献报道中常用的色谱条件列于表3。
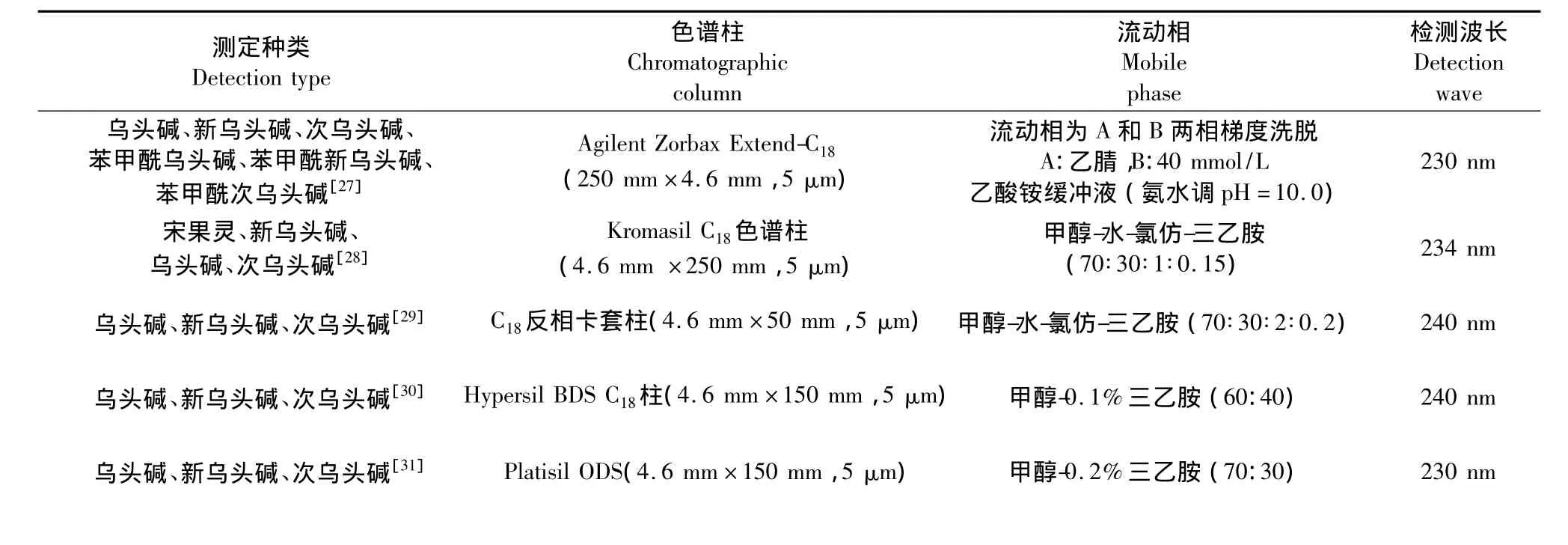
表3 高效液相色谱法测定附子中生物碱常用色谱条件Table 3 Determination of alkaloids content from Fuzi by HPLC

乌头碱、新乌头碱、次乌头碱[32] Ulti-mateTM XB-C18柱(4.6 mm×250 mm,5 μm) 乙腈-0.2%冰醋酸(浓氨水调节pH=7.29) 230 nm乌头碱、新乌头碱、次乌头碱[33] Hypersil ODS2色谱柱(250 mm×4.6 mm,5 μm) 40 mmol/L乙酸铵溶液-乙腈(梯度洗脱) 235 nm乌头碱、新乌头碱、次乌头碱、北乌碱、苯甲酰乌头碱、苯甲酰新乌头碱[34]AichromBond-C18柱(250 mm×4.6 mm,5 μm)乙腈-5mmol/L NaH2PO4溶液,磷酸调至pH=4.5,内含7mmol/L十二烷基硫酸钠(SDS) 235 nm
1.3.2.2 液质联用 集合了液相色谱的高分离能力与质谱的高灵敏度和极强的定性专属性于一体,不仅能测定附子及其制剂中无紫外吸收生物碱的含量,还能对乌头碱水解产物及代谢产物进行检测,帮助确定生物碱的结构类型等。Koji Wada等[35]采用大气压化学电离技术(APCI-MS),对 kobusine、pseudokobusine、dehydrolu-cidusculine等6种不含苯甲酰基的生物碱进行测定。Hikoto等[36]利用固相提取技术,提取人血液及尿中的微量双酯型乌头碱及其代谢产物后,用HPLC色谱柱分离,SIM-FABMS检测器检测,可分析14种乌头碱的含量。高瞰等[37]用Venusil Mp-C18柱对生物验材进行分离,采用ESI多反应监测(MRM)扫描方式,建立了快速测定生物验材中乌头碱的含量,测定的线性范围为3~5000 ng/mL,RSD<1.8%,日间和日内精密度分别为2.5%和4.6%,提取回收率为85.61% ~89.04%。Wei Wu等[38]利用场解吸飞行时间质谱(MALDI-TOF-MS)建立了能够同时检测32种附子及其炮制品中生物碱含量的方法,此法比ESI-MS法所用时间更短,重现性更好。随着技术的不断发展与成熟,液质联用将成为分析方法新的方向。
1.3.2.3 超高效液相色谱法 该测定方法具有灵敏度高、专属性强、快速的优点,是正在兴起的一种分离方法,适用于中药及其复方体内代谢化学的研究。王瑞等[39]采用UPLC/ESI/MS/MS联用技术,多反应监测(MRM)扫描方式,在体外血浆温孵试验和急性毒性试验的基础上,建立了同时测定大鼠血浆中附子总生物碱主要成分(乌头碱、中乌头碱、次乌头碱)浓度的方法;同时测定了大鼠血浆中附子总碱各主要成分的浓度;优化的色谱条件为Acquity UPLCTMBEH C18柱,乙腈-0.05%氨水溶液为流动相进行梯度洗脱,3种生物碱类成分在3min内即可完全分离,内源性物质不干扰样品的测定;血浆样品提取回收率均高于85%,日内和日间精密度的RSD均小于6%。
1.3.3 高效毛细管电泳法
刘春海等[40]在色谱条件为:缓冲液:0.3 mol/L磷酸缓冲液(pH=6.8);毛细管柱:内径50 μm,有效长度56 cm;检测波长:230 nm;温度:25℃;电压: 20 Kv;进样量:100 mbar·s时,以乌头碱为对照品绘制标准曲线,从而测得温脾汤中乌头碱的含量;虞巧英[41]用未涂层石英毛细管(75 μm×50 μm,有效长度42.5 cm),以1.0 mmol/L的14-羟基-乙酰苯标准溶液为内标溶液,0.3 mol/L磷酸液(pH=6.8)为电泳缓冲液,检测波长:230 nm;温度:25℃;电压: 20 Kv;进样量100 mbar·s的电泳条件下测定了附子与甘草配伍前后乌头碱的含量变化。Zhao等[42]建立了新的纪录模式,运用非水毛细管电泳法,即以20 mM硼酸钠-70%(v/v)甲醇(pH=8.5)为电泳缓冲液,未涂层石英毛细管(50 cm×75 μm),检测波长214 nm,电压20 Kv的色谱条件下对附子等五种中药中的乌头碱、次乌头碱、新乌头碱的含量进行了测定,整个过程可在13分钟内完成,且大大改善了实验重现性;Song等[43]以pH=7.8的200 mMTis、150 mM高氯酸、40%1,4-二氧己烷的混合液为缓冲溶液(25℃)同时测定了附子中六种生物碱的含量。与HPLC相比,HPCE具有分离时间短,杂质干扰少,使用有机溶剂少,操作方便等优点,是一种很有应用前景的分析方法。
2 尿嘧啶的含量测定
从附子中分离得到的尿嘧啶经药理实验证实具有一定的正性肌力作用,被认为是附子强心活性的有效成分之一[44]。
洪波[45]以0.2%无水碳酸钠溶液超声提取生附子,色谱条件为:Hypersile C18(4.60 mm×250 mm,5 μm)分析柱,流动相为0.05 mol/L磷酸氢二铵溶液,流速为0.8 mL/min,检测波长为254 nm,柱温20℃,测得尿嘧啶的含量,平均回收率为100.04%,RSD为1.84%,还采用同样的方法测定了黑附片、白顺片、盐附子中尿嘧啶的含量。
3 多糖的含量测定
中草药多糖在增强机体免疫功能及抗肿瘤、抗肝炎、抗溃疡、调血脂、降血糖、抗衰老等方面都有作用[46]。附子多糖以其高效低毒的生物学特性,近年来逐渐受到人们的关注,是新药研发和食品保健方向之一。
赵祥生等[47]用蒽酮-硫酸比色法,以葡萄糖为对照品,测定了道地产区江油附子的多糖含量,供试液在6 h内显色稳定,重现性好,平均回收率为90.4%,RSD=1.58%(n=5),测得江油附子多糖含量为3.34%,RSD=2.31%。舒晓燕等[6]用蒽酮-硫酸法测定了不同品种附子多糖的含量,为附子的品种选育提供了一定的科学依据。此法方便简单,可作为附子多糖测定的优选方法。
4 微量元素的含量测定
微量元素是中药归经和药性物质基础的重要组成部分,其含量与中药的功效有着密切的关系[48]。对附子中的微量元素进行分析,可对阐明其药性理论与功能主治提供参考。
该法的原理[49]是将待测元素的分析溶液在高温下进行原子化,使其离解为基态原子,空心阴极灯发射出待测元素特征波长的光辐射,并穿过原子化器中一定厚度的原子蒸气,此时光的一部分被原子蒸气中待测元素的基态原子吸收,根据朗伯比尔定律,吸光度的大小与待测元素的原子浓度成正比关系,即可求得待测元素的含量。张彩霞等[49]采用空气—乙炔火焰原子吸收分光光度法(FAAS)对附子的常见炮制品中五种微量元素(Ca、Cu、Mg、Zn、Fe)的含量进行了测定,发现黑顺片中以Mg元素为主,白附片中以Ca元素为主,盐附子中以Mg元素为主。此法操作简便,准确,线性相关系数良好。
5 结束语
5.1 随着对附子研究的深入,对其化学成分的含量测定已经逐渐由对乌头类生物碱向多糖类、嘧啶类、微量元素类成分扩展,由测定单一或少数同类成分向同时测定多类成分发展,以便更全面地控制附子药材及其制剂的质量,更有效地研究附子炮制与配伍机理以及在体内的代谢动力学。
5.2 在附子单个生物碱的含量测定上,主要还是集中在乌头碱、新乌头碱、次乌头碱及其对应的单酯水解产物这六种,而化学成分分析的逐渐深入,已从附子中分离得到了其他二萜类生物碱,同时在双酯型生物碱经过两次水解后得到的低毒醇胺型生物碱的含量测定未见报道,由于其没有紫外吸收,故在用液相的方法进行同时测定多种生物碱含量时可以考虑使用蒸发光散射检测器。
5.3 各种分析方法均有其利弊,酸碱滴定法与紫外分光光度法简单易行但选择性差;离子选择电极法选择性高但因需要制备活性物质受到了实验条件的限制;薄层扫描法灵敏度高,操作简单,但影响因素多,测定误差较大;高效液相色谱法准确度高,分离效果好,能同时测定几种化学成分的含量,但所用流动相碱性较强,易破坏色谱柱固定相;气相色谱法准确、快速但在附子的研究中未得到推广应用;如今高效液相的应用最为活跃,超高效液相色谱法、液质联用技术、高效毛细管电泳技术因其独特的优势已在化学成分的含量测定中显示了良好的应用前景。
1 Chinese Pharmacopoeia Commission(国家药典委员会).Chinese Pharmacopoeia(中国药典):first volume.Beijing: Chemical Industry Press,2010.177.
2 Wang CL(王昌利),et al.Dynamic study of effect of preparation condition on Fuzi total alkaloid and ester-type alkaloid contents.J Shangxi Coll Tradit Chin Med(陕西中医学院学报),2009,32:61-63.
3 Zhang HW(张化为),et al.Effect of different decocting time on Fuzi alkaloid and FP Study.J Shangxi Coll Tradit Chin Med(陕西中医学院学报),2010,33:100-101.
4 Long PX(龙沛霞),Wang YZ(王玉珍).Determination of alkaloids from Radix Aconiti Preparata,Radix Aconitum Kusnezoffii,Radix Aconitii Lateralis Praeparata and their compound prescription.Chin Trad Herb Drugs(中草药),1996,27:531.
5 Yang Y(杨云),et al.Research on the quantification methods of Fuzi alkaloid.Lishizhen Med Mat Med Res(时珍国医国药),1998,9:331-332.
6 Shu XY(舒晓燕),et al.Study on the content of alkaloids and polysaccharide in different varieties of Aconitum camichaeli.Chin Pharm(中国药房),2010,21:2916-2918.
7 Chen JJ(陈佳江),Xiong M(熊敏).Content of total alkaloids in water extracts of Radix Aconitum Preparata with Rhizoma Zingiber by compatibility of different ratio.J Chengdu Univ Tradit Chin Med(成都中医药大学学报),2010,33:1-3.
8 Li XD(李孝栋),et al.Determination of total alkaloids in the compound prescription Fuzi Lizhong by acid dye colorimetry.J Fujjian Coll Tradit Chin Med(福建中医学院学报),2007,17:25-27.
9 Yang Y(杨云).Determination of aconitine-type alkaloids in the Fuzi Lizhong oral liquids.Chin J Exp Trad Med Form(中国实验方剂学杂志),1997,3:43-44.
10 Zheng LL(郑来丽),et al.Determination of aconitine-type alkaloids in the compound prescription Fugui Gutong by acid dye colorimetry.J Beijing Univ Chem Tech,Nat Sci(北京化工大学学报,自科版),2009,36:80-83.
11 Feng JF(奉建芳),Wu WK(吴伟康).Spectrophotometry of ion-couple extraction determined content of aconitine-type alkaloids in Baoxin decoction.Prim J Chin Mat Med(基层中药杂志),2000,14:3-4.
12 Li LF(李兰芳).Determination of poisonous alkaloids from Radix Aconitii Lateralis Praeparata and some compound prescription.Chin Trad Pat Med(中成药),1987,4:35.
13 Cao ZH(曹志红),Zhao Y(赵远).Determination of total aconitine-type alkaloids in Sini Decoction.J Emerg Trad Chin Med(中国中医急症),2003,12:559.
14 Chen QL(陈巧玲).General situation of the determination of aconitine-type alkaloids in Radix Aconiti Preparata,Radix Aconitum Kusnezoffii,Radix Aconitii Lateralis Praeparata and their compound prescription.West Chin Med J(华西药学杂志),1999,14:114-116.
15 Li YP(李娅萍),Tian SJ(田颂九),Wang GR(王国荣).Profile on chemical constituents and analysis methods of aconitum medicine.Chin J Chin Mat Med(中国中药杂志),2001,26:612-659.
16 Xu HY(徐红雨).Determination of aconitine in aconitum By ion-selective electrode.J SouthwestChin Teach Univ,Nat Sci (西南师范大学学报,自科版),1992,17:74-78.
17 Hu R(胡荣),Du HF(杜洪飞).Profile on content determination of alkaloids from Radix Aconitii Lateralis Praeparata and its compound prescription.Chongqing J Res Chin Drugs Herbs(重庆中草药研究),2003,2:52-54.
18 Dai Z(戴忠),et al.Determination of ester-alkaloids in Feng-ShiGuTongJiu by GC.Chin Pharm Anal(药物分析杂志),1995,15:170.
19 Li HR(李焕荣),et al.Determination of aconite in Zheng-TongNing injection by TLC-scanning.Chin Trad Herb Drugs (中草药),1996,27:58.
20 Wang YM(王浴铭),et al.Determination of aconite in HuoxueZhuangjinDan by dual wavelength TLC-scanning.Chin Trad Pat Med(中成药),1988,10:13.
21 Tang JS(杨基森),et al.Determination of aconite in COCHD XiangPiGao By TLC-Scanning.Chin Trad Pat Med(中成药),1989,11:12.
22 Wei ZW(尉志文),et al.Rapid diagnosis of aconites poisoning by TLCS.Chin J Health Lab Technol(中国卫生检验杂志),2008,18:1745-1746.
23 Chen XB(陈晓斌),et al.Determination of strychnine and aconite by dual wavelength TLCS.Chin J Chin Mat Med(中国中药杂志),1994,19:482.
24 Wang LN(王丽娜),et al.Determination of aconite in capsula Shenkang by TLC-scanning.J Changchun Coll Trad Chin Med(长春中医学院学报),2005,21:39-40.
25 Zhao YF(赵永芳),Principle and application of biochemical technology(生物化学技术原理及运用),Beijing:Science Technology Press,2002.
26 Zhang CS(张春水),Current situation about diagnosis of aconitum-type alkaloids.Forensic Sci Technol(刑事技术),1998:11-12.
27 Sun L(孙兰),et al.Determination of six kinds of monoesterand diester-alkaloids in Radix Aconitii Lateralis Praeparata by HPLC.Chin Trad Herb Drugs(中草药),2009,40:131-135.
28 Liu L(刘岚),et al.HPLC simultaneous determination of four aconitine alkaloids in patent medicine.Chin Pharm Anal(药物分析杂志),2010,30:236-240.
29 Xiao FX(肖凤霞),et al.A methodological study of quantitative determination of aconite in rats'serum.Food Drug(食品与药品),2005,7(10):47-50.
30 Wang R(王瑞),et al.Quantitative analysis of aconite,mesaconitine,hypaconitne in different Radix Aconiti Lateralis Praeparata.Chin J Pharm Anal(药物分许杂志),2006,26: 1361-1363.
31 Su JS(苏建树),et al.Effect of alkaloids determination from Radix Aconitum after microorganism fermentation.J Beijing Univ Chem Technol,Nat Sci(北京化工大学学报,自科版),2010,37:97-101.
32 Deng YQ(邓雅琼),et al.Determination of chemical constituents in aconitum L.plants by RP-HPLC.Lishizhen Med Mat Med Res(时珍国医国药),2009,20:1038-1039.
33 Jian H(简晖),et al.Quantitative Analysis of three diesteralkaloids in Radix Aconiti Lateralis Praeparata.Chin Trad Herb Drugs(中草药),2008,39:1413-1414.
34 Liu XX(刘秀秀),Chao RB(晁若冰),Determination of alkaloids in Radix Aconiti Lateralis Preparata by RP-ion-pair HPLC.Acta Pharm Sin(药学学报),2006,41:365-369.
35 Wada K,et al.Determination and Quantitative Analysis of Aconitum Alkaloids in Plants by Liquid Chromatography-Atmospheric Pressure Chemical Ionization Mass Spectrometry.J Chromatogr A.1993:43.
36 Yin J(阴健),Modern Application of Chinese Materia Medica(中药现代研究与临床应用),VolⅡ.Beijing:Xueyuan Press,1993.258.
37 Gao K(高瞰),Xing JJ(刑俊家),A Rapid Method for Determination of Aconitine in Biology Samples by LC-Ms/MS.Chin J Mod Appl Pharm(中国现代应用药学),2010,27: 729-731.
38 Wu W,et al.Direct analysis of alkaloid profiling in plant tissue by using matrix-assisted laser desorption/ionization mass spectrometry.J Mass Spec,2007,42:58-69.
39 Wang R(王瑞),Study on the quality assessment of Radix Aconiti Lateralis Praeparata and the pharmacokinetics of aconitum alkaloids in Radix Aconiti Lateralis in rats.Beijing: Beijing University of Chinese Medicine(北京中医药大学),PhD.2007.
40 Liu CH(刘春海),et al.Study on first decocted Radix Aconiti Preparata and later decocted Radix et Rhizomea Rhei in Wenpi Decoction.Chin Trad Herb Med(中草药),2003,34: 514-516.
41 Yu QY(虞巧英),Study on changes of contents from Radix Aconitii Lateralis Praeparata after companied with Radix Glycyrrhiza.Strait Pharm J(海峡药学),2010,22:86,38.
42 Zhao S,et al.Analysis of the aconitine alkaloids in traditional Chinese medicines by nonaqueous capillary electrophoresis using a new recording mode.Biomed Chromatogr,2004,18: 381-387.
43 Song J,et al.Development and validation of a rapid capillary zone electrophoresis method for the determination of aconite alkaloids in aconite roots.Phytochem Anal,2010,21:137-143.
44 Wang GL(王桂玲),Study on Separation and Identification of Cardiotonic components from Aconite roots.Tanbian:Yanbian University(延边大学),MSc,2005.
45 HongB(洪波),Study on Chemical Components and Effect Components from Aconite roots.Changchun:Jilin Agriculture University(吉林农业大学),MSc,2003.
46 Huang RS(黄瑞松).Profile on determination of polysaccharose in Chinese herbal medicine.China Pharm,2005,8(1): 68-70.
47 Zhao XS(赵祥升),et al.Content determination of polysaccharide in Aconitum camichaili of Jiangyou.J Anhui Agric(安徽农业科学),2009,37:650-651.
48 Gong JY(贡济宇),et al.Research on trace elements in Chinese traditional medicine.Studies Trace Elem Health(微量元素与健康研究),2002,19:68-70.
49 Zhang CX(张彩霞),et al.FAAS determination of trace element in different medicinal part of Poria cocos and different processed products of Radix Aconiti Lateralis.J Gansu Coll Tradit Chin Med(甘肃中医学院学报),2010,27:52-55.
Advances in Content Determination Methods of Chemical Constituents from Radix Aconiti Lateralis Preparata(Fuzi)
LEI Qi-fang,SI Jian-yong*
Institute of Medicinal Plant Development,Chinese Academy of Medical Science and Peking Union Medical College,Beijing 100193,China
Radix Aconiti Lateralis Preparata(Fuzi)has been used as an essential drug in traditional Chinese medicine (TCM)for treating heart failure,shock,arrhythmia,inflammation and pain.The content determination methods of its mainly active chemical constituents including alkaloids,pyrimidines,polysaccharides and trace elements had been summarized that based on a wide range of literature investigations.In addition,we also generalized the applications of different analysis methods such as titrimetry,spectrophotometry,TLC-scanning,HPLC,LC-MS,HPCE,and so on.This review is in order to set a basis to conduct an appropriate quality control for Fuzi and to research the active constituents of Fuzi crude materials and ready-made products.
Radix Aconiti Lateralis Preparata;chemical constituents;alkaloids;content determination;review.
1001-6880(2012)10-1480-07
2010-12-20 接受日期:2011-03-21
国家973计划(2009BC522805)
*通讯作者 Tel:86-10-57833299;Email:jysi@implad.ac.cn
R284.1
A
