蜡梅枝叶化学成分及其抗病毒活性
2012-11-24史琳婧杨世仙毕峻龙尹革芬王跃虎
史琳婧,杨世仙,毕峻龙,尹革芬*,王跃虎
1中南大学药学院,长沙410078;2中国科学院昆明植物研究所资源植物与生物技术所级重点实验室; 3云南农业大学园林园艺学院;4云南农业大学动物科技学院,昆明650201
蜡梅枝叶化学成分及其抗病毒活性
史琳婧1,2,杨世仙2,3,毕峻龙4,尹革芬4*,王跃虎2*
1中南大学药学院,长沙410078;2中国科学院昆明植物研究所资源植物与生物技术所级重点实验室;3云南农业大学园林园艺学院;4云南农业大学动物科技学院,昆明650201
利用各种色谱技术从蜡梅枝叶中共分离得到10个化合物,通过波谱学方法将其鉴定为(+)-Calycanthine(1)、(-)-Folicanthine(2)、(-)-Chimonanthine(3)、异秦皮啶(4)、3,3'-双异秦皮啶(5)、Euoniside(6)、山奈酚-3-O-芸香糖苷(7)、3,4-二羟基苯乙腈(8)、Di-O-methylcrenatin(9)和Acanthoside B(10)。化合物4~10为首次从该植物中发现。采用细胞病变效应法测试了化合物1~5与8对猪繁殖与呼吸综合征病毒的抑制活性,化合物2(IC50=58.9±10.2 μM;TI=19.3)、3(IC50=68.9±3.1 μM;TI=17.9)与8(IC50=80.5±16.9 μM;TI>19.9)显示出了弱的抑制活性。
蜡梅科;蜡梅;生物碱;猪繁殖与呼吸综合征病毒
蜡梅(Chimonanthus praecox Link)是蜡梅科(Calycanthaceae)蜡梅属落叶灌木或小乔木,主要分布于我国南方,是传统庭院名花和园林绿化植物。其根、叶可药用,用于治疗跌打、腰痛、风湿麻木、风寒感冒等。其花亦用于治疗头晕、胸闷、梅核气、咽喉肿痛、百日咳、小儿麻诊等。果实有健脾止泻功效,常用于治疗腹泻久痢等症[1]。前人对其根、果实、叶和花的化学成分进行过研究,发现了色胺来源的生物碱、花青素、黄酮醇、倍半萜及其糖苷以及苯丙素糖苷等[2-7]。其中生物碱(+)-Calycanthine和(-)-Folicanthine有抗真菌活性[6],(-)-Chimonanthine、(-)-Calycanthidine和(-)-Folicanthine有细胞毒活性[7]。为了从天然产物中筛选动物病毒抑制剂[8],我们对蜡梅枝叶的化学成分进行了研究,并测试了分离物对猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)的抑制活性。
1 仪器与材料
旋光通过JASCO DIP-370型数字式旋光仪测定;NMR在Bruker AM-400和DRX-500核磁共振仪上测量(TMS为内标);FAB-MS由VG Auto Spec-3000质谱仪测定;ESI-MS由API Qstar Pulsar1质谱仪测定;Sephadex LH-20是GE Healthcare Bio-Sciences AB产品;D101大孔树脂、硅胶GF254与柱层析用硅胶G(80~100目,300~400目)为青岛美高集团有限公司的产品;C-18反相硅胶(40~75 μm)来自美国的Fuji Silysia Chemical LTD的产品;高效液相色谱仪为Agilent 1200(色谱柱Zorbax SB-C18,9.4 (250 mm,5 μm);旋转蒸发仪是BUCHI公司的Rotavapor RII。
植物材料于2009年8月采自云南省昆明市,经中国科学院昆明植物研究所胡光万博士鉴定为蜡梅(Chimonanthus praecox)。
2 提取与分离
蜡梅枝、叶(3.6 kg)干燥、粉碎,用甲醇回流提取3次(4、3、3 h),浓缩后得浸膏,加适量水混悬,石油醚萃取(弃),无机相用1%HCl调pH值至1,乙酸乙酯萃取(弃)。无机相用5%NaOH调pH值至10,用氯仿萃取。氯仿萃取物部分(5 g)用中压反相硅胶层析,50%甲醇洗脱部分经 Sephadex LH-20 (MeOH)和制备性TLC(氯仿-甲醇-二乙胺,5∶1∶0.05)分离得到化合物1(11.2 mg)和3(87.7 mg);70%~80% 甲醇洗脱部分合并经 Sephadex LH-20 (MeOH)和制备性TLC(氯仿-甲醇-二乙胺,5∶1∶0.05)得到化合物2(35.2 mg)。
氯仿萃取后的无机相用1%HCl调pH值至7,D101大孔树脂柱层析分离,分别用水与95%乙醇洗脱。取95%乙醇部分经硅胶柱层析,用氯仿-甲醇梯度洗脱。氯仿-甲醇(5∶1)洗脱部分经中压反相硅胶柱层析,10%~30%甲醇洗脱部分用Sephadex LH-20(MeOH)和制备性TLC分离得到化合物8 (18.6 mg;氯仿-甲醇,5∶1)和9(13.4 mg;氯仿-甲醇,3∶1);40%~50%甲醇洗脱部分用Sephadex LH-20(MeOH)和硅胶柱色谱(氯仿-甲醇,5∶1)分离得到化合物4(18.0 mg);60%甲醇洗脱部分经Sephadex LH-20(MeOH)柱层析后得到化合物5(20.8 mg)。氯仿-甲醇(2∶1)洗脱部分经中压反相硅胶柱层析,20% 甲醇洗脱部分用 Sephadex LH-20 (MeOH)柱层析后重结晶得到化合物6(14.1 mg); 40% ~50% 甲醇洗脱部分用 Sephadex LH-20 (MeOH)和制备性TLC分离得到化合物7(28.7 mg;氯仿-甲醇,3∶1)和10(17.8 mg;氯仿-甲醇,5∶1)。
3 生物活性测定
3.1 细胞系与病毒
Marc-145细胞(中国科学院上海细胞库)用含有10%胎牛血清(Fetal bovine serum,FBS;HyClone Co.),100 U/mL青霉素,和100 μg/mL链霉素的营养液在37℃,5%CO2的培养箱中进行培养。待细胞长至单层时,使用0.25%胰酶(HyClone Co.)进行消化,根据实验的需要转入96孔培养板进行培养。本实验所使用的PRRSV(YN-1株)在云南分离获得[9]。该毒株在Marc-145细胞上的半数感染量(50%Tissue culture infectious dose,TCID50)为10-5.3TCID50/0.1 mL。
3.2 化合物细胞毒性测定
化合物对Marc-145细胞的毒性使用WST-8方法进行测定[10]。简单来说,将密度为1×104cells/ mL的Marc-145 cells加入96孔培养板中培养至单层,将化合物1~5和8以及阳性对照磷酸替米考星(湖北恒硕生物化工有限公司)用DMEM培养液(Dulbecco’s modified Eagle’s medium,HyClone Co.)做2倍连续稀释,每个梯度浓度接种3个细胞孔,混合液总量为100 μl。同时设正常细胞对照、培养液对照。37℃二氧化碳培养箱中培养3 d后,每孔加入10 μl CCK-8溶液(Cell Counting Kit-8,Beyotime Co.),在细胞培养箱内继续孵育1.5 h,酶标仪(Bio-Tek ELx 800)在450 nm处阅读OD值。根据OD值计算细胞存活率及 50%细胞毒性浓度(CC50)。
3.3 抗病毒活性实验
化合物抗病毒活性使用CPE抑制实验进行评价[11]。将Macr-145细胞接种于96孔培养板中,使之长满单层;将测试化合物分别做2倍连续稀释,将不同浓度提取物及阳性药物分别与500 TCID50/0.1 mL病毒液混合,然后将病毒药物混合液加入细胞中,同时设正常细胞对照组(不含药物和病毒),病毒对照组(只含病毒)。于37℃,5%CO2培养箱中继续培养,逐日观察CPE,在显微镜下可见细胞出现圆缩,聚集,最后脱落。4 d后根据CPE结果判订药物有效抑制50%细胞出现病变的浓度(50%inhibition concentration,IC50),并计算药物治疗指数(TI= CC50/IC50)。
3.4 荧光定量RT-PCR检测PRRSV mRNA表达的变化
应用RT-PCR方法检测了化合物2、3和8(设4个浓度)对PRRSV ORF7和NSP9基因mRNA表达的影响[12]。给药培养4 d后,使用RNA提取试剂RNAisoTM Plus(TaKaRa Biotechnology,中国大连),按照说明书提取药物组和病毒对照组的总RNA,所提取RNA使用30 μl RNase-free水溶解,待RNA完全溶解后于(80℃保存。所使用引物根据GenBank参考序列 PRU87392,利用Primer5.0和 Oligo6软件,在PRRSV ORF7和NSP9保守区域分别设计了一段长为330 bp和162 bp的引物。ORF7引物序列为:上游5'-AATGGCCAGCCAGTCAATCA-3'和下游5'-TCATGCTGAGGGTGATGCTG-3'。NSP9引物序列为:上游5'-CACTAAAGAGGAAGTCGCACTCA-3'和下游 5'-GGTATGTCTCCAAACCTTGTATTCTG-3'。内参基因beta-actin,引物序列为:上游引物5'-ATCCAGGCTGTGCTGTCC-3',下游引物 5'-GAGGATCTTCATGAGGTAGTCG-3'。
将所提取总RNA使用PrimeScript RT® Reagent Kit(TaKaRa)反转录为CDNA,反应体系为10 μL,其中RNase Free dH2O 4.5 μL,5×PrimeScript Buffer 2 μL,PrimeScript RT Enzyme MixⅠ0.5 μL,Random 6 mers(100 μM)0.5 μL,Oligo dT Primer (50 μM)0.5 μL,总RNA 2 μL。反应程序为:37℃,15 min;85℃,5 sec。PCR反应体系为25 μL,其中SYBR~Primix Ex TaqTMII(TaKaRa)12.5 μL,PCR Forward Primer(10 μM)0.5 μL,PCR Reverse Primer(10 μM)0.5 μL,dH2O 9.5 μL,cDNA 2 μL。使用iQ5 real time PCR仪(Bio-Rad.Co.Ltd.)进行扩增反应程序为:1个循环(95℃,30 sec),然后40个循环(95℃,5 sec;60℃,30 sec)。
3.5 统计分析
所有的实验进行三个重复,数据使用平均值 ±标准差(SD)表示。数据分析使用SPSS17.0统计软件进行分析,*表示差异极其显著(P<0.001)。
4 结构鉴定与生物活性筛选结果
从蜡梅枝叶甲醇提取物中共分离得到10个化合物(部分化合物结构式见图1),通过与文献对比波谱数据对其结构进行了鉴定,这些化合物包括3个色胺来源的生物碱即(+)-Calycanthine(1)[6]、(-)-Folicanthine(2)[6]和(-)-Chimonanthine(3)[13],3个香豆素类成分即异秦皮啶(4)[14]、3,3'-双异秦皮啶(5)[15]和Euoniside(6)[16],以及一些其它成分:山奈酚-3-O-芸香糖苷(7)[17],3,4-二羟基苯乙腈(8)[18],Di-O-methylcrenatin(9)[19]和Acanthoside B(10)[20]。
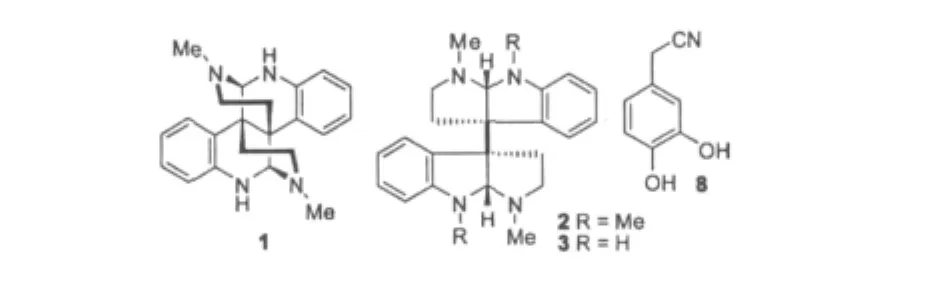
图1 化合物1~3与8的结构Fig.1 Chemical structures of compounds 1-3 and 8
采用细胞病变效应法(Cytopathic effect,CPE)对化合物1~5与8的对PRRSV的抑制活性进行测试,化合物2(IC50=58.9±10.2 μM;TI=19.3)、3(IC50=68.9±3.1 μM;TI=17.9)与8(IC50= 80.5±16.9 μM;TI>19.9)显示了弱的抑制活性(表1)。由于目前尚没有猪繁殖与呼吸综合征的有效治疗药物,我们选用了兽用抗生素磷酸替米考星作为阳性对照药,其对PRRSV的抑制作用(IC50= 225.1±27.4 μM)比上述3个化合物的更弱,且治疗指数(TI=3.8)较低。

表1 化合物2、3和8对Marc-145细胞感染的PRRSV病毒抑制效果Table 1 The Inhibitory Effects of 2,3 and 8 on PRRSV in Marc-145 Cells
在观察细胞病变的同时,通过荧光定量RTPCR检测了PRRSV mRNA表达的变化。在给药4 d后,化合物2、3和8(浓度50~400 μM)不同程度地下调了PRRSV NSP9与ORF7基因的相对表达量(图2)。
PRRSV病毒的RNA依赖性RNA聚合酶(RNA-dependent RNA polymerase,RdRp;nsp9)是 PRRSV病毒RNA合成的关键酶,由NSP9基因编码[21]。ORF7基因则编码N蛋白(Nucleocapsid protein N),后者是病毒感染的细胞中含量最丰富的病毒蛋白,其功能是负责病毒粒子的组装和去组装[22]。NSP9和ORF7 mRNA表达的下调,表明PRRSV RNA的复制和病毒粒子的组装可能被测试的化合物所抑制。
1 Zhou MQ(周明芹),Chen LQ(陈龙清),et al.Progress in research and application of Chimonanthus praecox.Hubei Agric Sci(湖北农业科学),2009,48:2874-2877.
2 Zhao HR(赵浩如),Ji QF(戢群芳),et al.Studies on constituents of roots of Chimonanthus praecox.J China Pharm Univ(中国药科大学学报),1993,24(2):76-77.
3 Iwashina T,Konta F,Kitajima J.Anthocyanins and flavonols of Chimonanthus praecox(Calycanthaceae)as flower pigments.J Jpn Bot,2001,76:166-172.
4 Takayama H,Matsuda Y,Masubuchi K,et al.Isolation,structure elucidation,and total synthesis of two new Chimonanthus alkaloids,chimonamidine and chimonanthidine.Tetrahedron,2004,60:893-900.
5 Kitajima M,Mori I,Arai K,et al.Two new tryptamine-derived alkaloids from Chimonanthus praecox f.concolor.Tetrahedron lett,2006,47:3199-3202.
6 Zhang JW,Gao JM,Xu T,et al.Antifungal activity of alkaloids from the seeds of Chimonanthus praecox.Chem Biodiversity,2009,6:838-845.
7 Wang WX,Cao L,et al.Constituents from Chimonanthus praecox(wintersweet).Phytochem Lett,2011,4:271-274.
8 Huang QQ,Bi JL,Sun QY,et al.Bioactive isoquinoline alkaloids from Corydalis saxicola.Planta Med,2012,78:65-70.
9 Duan BF(段博芳),Shen YP(沈艳萍),et al.Isolation and identification of porcine reproductive and respiratory syndrome virus from Yunnan Province PRRSV.Prog Vet Med (动物医学进展),2010,31(4):11-15.
10 Ishiyama M,Shiga M,Sasamoto K,et al.A new sulfonated tetrazolium salt that produces a highly water-soluble formazan dye.Chem Pharm Bull,1993,41:1118-1122.
11 Ma SC,He ZD,Deng XL,et al.In vitro evaluation of secoiridoid glucosides from the fruits of Ligustrum lucidum as antiviral agents.Chem Pharm Bull,2001,49:1471-1473.
12 Lurchachaiwong W,Payungporn S,Srisatidnarakul U,et al.Rapid detection and strain identification of porcine reproductive and respiratory syndrome virus(PRRSV)by real-time RT-PCR.Lett Appl Microbiol,2008,46:55-60.
13 Xiao BK(肖炳坤),Liu YM(刘耀明),Feng SX(冯淑香),et al.Chemical constituents from the leaves of Chimonanthus nitens(I).Chin Traditional and Herbal Drugs(中草药),2005,36:187-189.
14 Xu XD(许旭东),Hu XR(胡晓茹),et al.Studies on chemical constituents of Sarcandra glabra.China J Chin Mater Med(中国中药杂志),2008,33:900-902.
15 Wang F(王菲),Yuan ST(袁胜涛),Zhu DN(朱丹妮).Active components of antitumor fraction from Sarcandra glabra.Chin J Nat Med(中国天然药物),2007,5:174-178.
16 Tantray MA,Bhat BA,et al.Two new coumarins from Euonymus hamiltonianus.Chem Nat Compd,2008,44:10-12.
17 Tong XG(仝晓刚),Cheng YX(程永现).Chemical constituents from Acorus tatarinowii.Nat Prod Res Dev(天然产物研究与开发),2011,23:404-409.
18 Li XJ(李效军),Jia RS(贾睿生),Chen W(陈炜),et al.Synthesis of 5,6-dihydroxyindole.Speciality Petrochemicals (精细石油化工),2007,24(2):53-55.
19 Zhang DM(张东明),Li Y(李媛),Yu SS(庾石山).Glycosides from the stems of Photinia parvifolia.Nat Prod Res Dev(天然产物研究与开发),2004,16:496-499.
20 Vermes B,Seligmann O,Wagner H.Synthesis of biologicallyactive tetrahydro-furofuranlignan-(syringin,pinoresinol)-monoglucosides and bisglucosides.Phytochemistry,1991,30: 3087-3089.
21 Fang Y,Snijder EJ.The PRRSV replicase:Exploring the multifunctionality of an intriguing set of nonstructural proteins.Virus Res,2010,154s(1-2):61-76.
22 Hao XF,Lu ZJ,et al.Polymorphic genetic characterization of the ORF7 gene of porcine reproductive and respiratory syndrome virus(PRRSV)in China.Virol J,2011,8:1-9.
Chemical Constituents from the Branches and Leaves of Chimonanthus praecox with Antiviral Activity Investigations
SHI Lin-jing1,2,YANG Shi-xian2,3,BI Jun-long4,YIN Ge-fen4*,WANG Yue-hu2*1School of Pharmaceutical Science,Central South University,Changsha 410078,China;2Key Laboratory of Economic Plants and Biotechnology,Kunming Institute of Botany,Chinese Academy of Sciences;3College of Landscape and Horticulture,Yunnan Agricultural University;4College of Animal Science and Technology,Yunnan Agricultural University,Kunming 650201,China
Ten compounds were isolated from the branches and leaves of Chimonanthus praecox by various chromatographic techniques.By spectroscopic methods,their structures were elucidated as(+)-calycanthine(1),(-)-folicanthine(2),(-)-chimonanthine(3),isofraxidin(4),3,3'-biisofraxidin(5),euoniside(6),kaempferol-3-O-rutinoside (7),3,4-dihydroxybenzonitrile(8),di-O-methylcrenatin(9)and acanthoside B(10).Among them,compounds 4-10 were obtained from the herb for the first time.The inhibitory activity of compounds 1-5 and 8 against porcine respiratory and reproductive syndrome virus(PRRSV)was measured by the cytopathic effect(CPE)method.Compounds 2(IC50=58.9±10.2 μM;TI=19.3),3(IC50=68.9±3.1 μM;TI=17.9)and 8(IC50=80.5±16.9 μM;TI>19.9)showed weak effect on PRRSV.
Calycanthaceae;Chimonanthus praecox;alkaloids;PRRSV
1001-6880(2012)10-1335-04
2012-02-17 接受日期:2012-04-18
国家自然科学基金项目(31160509)
*通讯作者 E-mail:yingefen383@sohu.com;wangyuehu@mail.kib.ac.cn
R284.2;Q946.91
A
