促红细胞生成素对慢性肾脏疾病患者的肾保护作用研究
2012-11-24河南安阳市人民医院肾内科河南安阳455000
于 芳(河南安阳市人民医院肾内科,河南安阳 455000)
促红细胞生成素对慢性肾脏疾病患者的肾保护作用研究
于 芳*(河南安阳市人民医院肾内科,河南安阳 455000)
目的:研究患贫血的慢性肾脏疾病(CKD)患者,确定促红细胞生成素(EPO)是否影响肾血管和氧化应激生物标志物。方法:30例患有贫血的CKD患者采用重组人EPO治疗,每2周皮下注射1次12000U的EPO,治疗前和治疗后6个月测定各种参数。结果:6个月后,血清血红蛋白(Hbg)显著增加(P<0.05),尿蛋白水平、尿中肝型脂肪酸结合蛋白(L-FABP)、尿中8-羟基脱氧鸟苷(8-OHdG)、颈动脉内膜中层厚度(IMT)、臂踝脉搏波速度(baPWV)、血浆脑钠肽(BNP)和血清非对称二甲基精氨酸(ADMA)水平显著下降(P<0.05);血清肌酐、肾小球滤过率(eGFR)、左心室射血分数(LVEF)、心胸比(CTR)和下腔静脉尺寸(IVCD)差异不大。结论:重组人EPO可改善肾功能损伤、氧化应激和动脉粥样硬化进展,还可改善CKD患者贫血。
贫血;促红细胞生成素;肾血管;肾脏疾病
促红细胞生成素(EPO)是由肾脏和肝脏产生的一种主要的造血激素,在急性和慢性疾病条件下可显著保护多种器官。尿中肝型脂肪酸结合蛋白(L-FABP)可反映肾小管间质损伤[1];尿中8-羟基脱氧鸟苷(8-OHdG)是氧化应激的标志物,并且与慢性肾脏疾病(CKD)进展相关[2];颈动脉内膜中层厚度(IMT)和臂踝脉搏波速度(baPWV)已被广泛用作CKD患者的血管功能标记物[3];非对称二甲基精氨酸(ADMA)是内皮型一氧化氮合酶(eNOS)的竞争性抑制剂,是CKD进展的一个新型标志物[4];脑钠肽(BNP)是心脏功能的生物标志物[5]。本文研究患贫血的CKD患者,确定EPO是否影响肾血管和氧化应激生物标志物。
1 资料与方法
1.1 研究对象
2009年3月-2010年7月回顾性分析我院患有贫血的肾脏活检诊断为CKD的患者。入选标准:我院诊治的CKD患者,且排除糖尿病、全身性炎症性疾病(包括血管炎、胶原蛋白疾病、肝脏疾病或恶性肿瘤)与既往接受重组人EPO治疗的情况。贫血的定义[3]为入组研究时血红蛋白(Hbg)水平低于10g·dL-1。入选患者共计30例,其中男性18例,女性12例,年龄(68.46±6.65)岁。
1.2 治疗方法
根据查阅的文献[2,4,5]和我科室的集体讨论确定,所有患者接受皮下注射重组人EPO,起始剂量为每2周注射12000U,随后剂量调整至6个月内使Hbg水平达到12g·dL-1。在研究期间,同时给予患者口服补铁,以维持其血清铁蛋白水平和转铁蛋白饱和度指数分别超过150mg·L-1和20%。
1.3 指标检测
患者休息2min后采用立式标准血压计以坐姿测量血压(BP)。每日早晨8:00-10:00检验科检测血清肌酐水平、肾小球滤过率(eGFR)、总尿蛋白排出量、尿中L-FABP水平(尿中L-FABP值以尿肌酐浓度比值表示)、尿中8-OHdG水平。高效液相色谱法测定血清ADMA。使用血压计和脉搏描记器,测量baPWV。使用附有7.5MHz机械函数尺传感器,Aloka SSP-2000的高分辨率B型超声检查仪测量颈动脉IMT。采用Sonos 4500回波体层摄影仪计算左心室射血分数(LVEF)。采用放射免疫法测定血浆BNP水平。此外,我们还测量了心胸比(CTR)和下腔静脉尺寸(IVCD)。检验科各项指标由检验科不同人员检测2次,2次结果相近时取值,否则重测;其他指标检测1次。
1.4 统计学方法
采用SAS系统进行所有的统计分析。数据以x ±s表示。采用配对Student’s t检验分析差异。P<0.05认为差异有统计学意义。
2 结果
2.1 一般情况
合并用药处方为抗高血压药(24例)、他汀类药(6例)、口服碳吸附剂AST-120(16例)、抗血小板药(12例)和泼尼松龙(4例),研究期间不会改变使用这些药物的种类、剂量及给药途径。研究对象一般情况见表1。

表1 研究对象一般情况Tab 1 General information of study objects
2.2 治疗前、后指标的变化
EPO治疗后6个月,Hbg上升至(11.34±0.27)g·dL-1(P<0.05)。血清肌酐水平、eGFR、BP无变化。尿蛋白排出量降至(0.90±0.20)g·24h-1(P<0.05);尿中 L-FABP 水平降至(33.22±10.16)μg/g肌酐(P<0.05),尿中8-OHdG水平降至(18.84±4.11)ng/mg肌酐(P<0.05),均显著减少。LVEF无显著变化(P>0.05)。血清BNP下降至(47.54±16.34)pg·mL-1(P<0.05)。CTR和IVCD无显著变化(P>0.05)。血清ADMA降至(0.45±0.06)μmol·L-1(P<0.05),baPWV降至(1800.32±183.83)cm·s-1(P<0.05);颈动脉IMT降至(0.82±0.042)mm(P<0.05),均显著下降。EPO治疗前和治疗6个月后尿蛋白排出量、尿中L-FABP水平和尿中8-OHdG水平变化见图1;EPO治疗前和治疗6个月后血清ADMA水平、baPWV和IMT变化见图2。
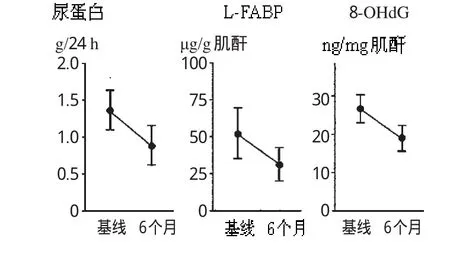
图1 EPO治疗前和治疗6个月后尿蛋白排出量、尿中L-FABP水平和尿中8-OHdG水平变化Fig1 Urinaryprotein excretion,urinary L-FABP levelsand urinary 8-OHdG levelsbeforeand 6monthsafterEPO treatment
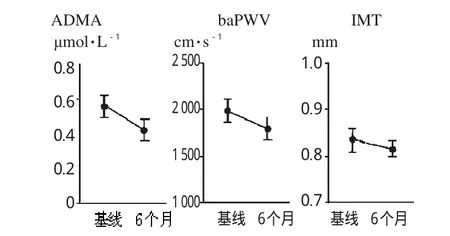
图2 EPO治疗前和治疗6个月后血清ADMA水平、baPWV和IMT变化Fig 2Serum ADMA levels,baPWV and IMT changes before and 6months after EPO treatment
3 讨论
越来越多的研究表明,EPO的治疗益处远不止改善贫血[6],还可预防或限制一些器官中组织损伤[7]。本研究提示,重组人EPO可改善肾功能损伤、氧化应激和动脉粥样硬化进展,还可改善CKD患者贫血。在本研究中,EPO治疗后6个月,Hbg水平明显上升,尿蛋白排出量减少,尿中L-FABP水平和尿中8-OHdG水平均显著减少。表明在患有贫血的CKD患者中,重组人EPO治疗6个月可显著降低尿蛋白排出量和尿中L-FABP水平,从而发挥了EPO的肾脏保护作用。重组人EPO治疗6个月后尿中8-OHdG、血浆BNP和血清ADMA水平也减少,表明EPO同样也发挥了抗氧化和心脏保护作用,并提高了NO的生物利用度。颈动脉IMT和baPWV的减少,显示了EPO有益的血管保护作用。此外,EPO还通过抗氧化机制促进细胞保护作用,例如抑制血红素加氧酶和谷胱甘肽过氧化物酶。EPO减少IMT和baPWV,表明了其在CKD患者中的抗动脉粥样硬化作用。在CKD患者中,EPO可降低血浆BNP水平,而不会改变LVEF、CTR和IVCD,表明EPO的主要作用可能主要是改善舒张功能。
本研究提示EPO治疗后6个月,Hbg水平明显上升,血清BNP水平下降,血清ADMA水平下降,baPWV和颈动脉IMT均显著下降。在输尿管梗阻模型中,EPO通过抑制炎症、间质纤维化和肾小管细胞凋亡改善肾小管间质损伤[8]。骨髓基质细胞(BMSC)在肾小管损伤中通过分泌减少细胞凋亡的因子和促进肾小管上皮细胞增殖发挥肾脏保护作用。EPO受体在BMSCs表面表达,EPO保护BMSCs免于血清饥饿诱导的细胞死亡,并刺激BMSC在体外增殖[9]。EPO可减少与顺铂给药相关的肾损伤[10]。ADMA是一种在血浆和各种组织中发现的天然存在的氨基酸,据报道,血液ADMA水平与心血管疾病的风险因素相关,并且是心血管疾病及CKD进展强有力的预测因素[4]。在本研究中,EPO可能通过减少血液ADMA水平而减少蛋白尿。高ADMA水平与颈动脉IMT增加相关,其中IMT是经验证的动脉粥样硬化的替代标志物。早期CKD受试者颈动脉IMT较高,CKD患者心血管疾病风险因素的患病率较高主要是因为颈动脉IMT较高[3]。心衰的诊断或排除在CKD患者中是非常重要的,因为在这一人群中左室肥厚和左室收缩功能障碍的患病率较高。此外,CKD患者具有较高的舒张功能障碍患病率。血浆BNP在CKD患者中可能是筛选心脏收缩和舒张功能障碍的一个合适的生物标志物。与肾功能正常患者的观察结果类似,在CKD患者中已报道血浆BNP水平是心血管疾病发展和心血管死亡的一个预后指标[11]。
本研究有6例合并使用影响IMT药物(他汀类)的患者,由于其治疗需要而采用了他汀类药。有研究者担心其药理作用可能对IMT观察有影响。我们的研究中充分地考虑到了这一点并查阅了相关文献,说法不一。最后我们采用了Beishuizen的说法,其文献[12]提示:他汀类药不能改变2型糖尿病患者IMT。我们排除了这6例数据,对其他数据进行了统计学分析,研究结果和结论与包含这6例数据时相比较,二者差别不大。因此我们的研究并未排除使用他汀类药的6例患者。
使用他汀类药对于标本量较大的情况,可能会对研究结果有影响。故对于大样本的研究,我们不推荐包含使用他汀类药的患者。
[1] Schena FP.Management of patients with chronic kidney disease[J].Intern Emerg Med,2011,6(Suppl 1):77.
[2] Fujiwara N,Nakamura T,Sato E,et al.Renovascular protective effects of erythropoietin in patients with chronic kidney disease[J].Intern Med,2011,50(18):1929.
[3] Liu N,Tian J,Wang W,et al.Effect and mechanism of erythropoietin on mesenchymal stem cell proliferation in vitro under the acute kidney injury microenvironment[J].Exp Biol Med(Maywood),2011,236(9):1093.
[4] Moore EM,Bellomo R,Nichol AD.Erythropoietin as a novel brain and kidney protective agent[J].Anaesth Intensive Care,2011,39(3):356.
[5] Bamgbola OF.Pattern of resistance to erythropoietin-stimulating agents in chronic kidney disease[J].Kidney Int,2011,80(5):464.
[6] Liu Y,Xu Y,Thilo F,et al.Erythropoietin increases expression and function of transient receptor potential canonical 5channels[J].Hypertension,2011,58(2):317.
[7] Akizawa T,Gejyo F,Nishi S,et al.Positive outcomes of high hemoglobin target in patients with chronic kidney disease not on dialysis:a randomized controlled study[J].Ther Apher Dial,2011,15(5):431.
[8] Singh AK.Is there a deleterious effect of erythropoietin in end-stage renal disease?[J].Kidney Int,2011,80(6):569.
[9]Wagner M,Alam A,Zimmermann J,et al.Endogenous erythropoietin and the association with inflammation and mortality in diabetic chronic kidney disease[J].Clin J Am Soc Nephrol,2011,6(7):1573.
[10] Parfrey PS.Erythropoietin-stimulating agents in chronic kidney disease:a response to hyporesponsiveness[J].Semin Dial,2011,24(5):495.
[11] 何 莉,向玉鸾,佘 强.曲美他嗪对2型糖尿病模型大鼠心室肌Ito通道表达的影响研究[J].中国药房,2011,22(5):11.
[12] Beishuizen ED,van de Ree MA,Jukema JW,et al.Two-year statin therapy does not alter the progression of intima-media thickness in patients with type 2diabetes withoutmanifestcardiovasculardisease[J].Diabetes Care,2004,27(12):2887.
Protective Effect of Erythropoietin on Kidney in Patients with Chronic Kidney Disease
YU Fang(Dept.of Nephrology,Anyang Municipal People’s Hospital of Henan Province,Henan Anyang 455000,China)
OBJECTIVE:To study the chronic kidney disease(CKD)with anemia,to determine whether erythropoietin(EPO)can influence renal vessel and oxidative stress biomarkers.METHODS:30CKD patients with anemia receiving subcutaneous injection of recombinant human EPO 12000U once every 2weeks.The parameters were measured before and 6months after treatment.RESULTS:After 6months,serum hemoglobin(Hbg)increased significantly(P<0.05),and urinary protein,urinary liver-type fatty acid binding protein(L-FABP),urinary 8-hydroxy-deoxyguanosine(8-OHdG),carotid intima-media thickness(IMT)and brachial-ankle pulse wave velocity(baPWV),plasma brain natriuretic peptide(BNP)and serum asymmetric dimethyl arginine(ADMA)levels were significantly decreased(P<0.05).The difference of serum creatinine,glomerular filtration rate(eGFR),left ventricular ejection fraction(LVEF),cardiothoracic ratio(CTR)and inferior vena cava size(IVCD)was not significant.CONCLUSION:Recombinant human EPO can improve renal function,oxidative stress and atherosclerosis progress;in addition,it can improve the anemia in patients with CKD.
Anemia;Erythropoietin;Renal vessels;Kidney disease
R969.4;R692.5;R556.9
A
1001-0408(2012)34-3228-03
DOI10.6039/j.issn.1001-0408.2012.34.21
2011-11-22
2012-02-03)
