人骨髓间充质干细胞在体内向造血细胞分化的研究
2012-11-24马洪喜韩秀丽张福明
陈 晓,马洪喜,李 丹,韩秀丽,张福明,白 欧*
(吉林大学第一医院1.肿瘤中心;2.临床病理诊断中心,吉林 长春130021)
骨髓中主要存在两种干细胞:造血干细胞(HSC)和间充质干细胞(MSC),后者是具有多向分化潜能的干细胞,能分化为神经细胞、成骨细胞、脂肪细胞、软骨细胞、肌细胞等[1]。它们均起源于中胚层细胞,MSC能否向造血干/祖细胞分化,在胚胎造血组织发生的研究过程中,不排除由正处于分化中及分化程度很低的幼稚MSC在一定的微环境的调控下向多能造血干细胞分化[2]。目前有关MSC向造血分化的研究相对较少,本实验首先建立人骨髓MSC分离、培养及扩增体系,以hMSC注射于亚致死剂量射线照射后的裸鼠,观察hMSC体内造血分化潜能和造血重建能力,为hMSC作为干细胞移植供体来源的可能性和干细胞横向发育的研究提供实验基础。
1 材料与方法
1.1 材料与试剂
取本院肿瘤中心健康志愿者骨髓,DMEM-LG、DMEM-HG、胎牛血清(FBS)、Percoll分离液(Phamacia),CD45-FITC、CD34-PE、CD29-PE、CD44-PE、CD90-FITC、CD105-PE(BD),BALB/C-nu/nu裸鼠,6-8周龄,体重18-20g,雌性,购自中科院上海实验动物中心。
1.2 人骨髓间充质干细胞的分离、培养、扩增和鉴定
将无菌肝素化骨髓制备成单个核细胞(MNC),以1×106/ml的密度接种于培养皿中,置37℃、5%CO2、100%饱和湿度的培养箱中培养,当细胞生长融合达90%时,用0.25%胰蛋白酶-0.02%EDTA消化传代,传至第4代(P4)后进行实验。取P5代细胞,消化洗涤后制成1.0×106/ml的单细胞悬液,分别加入抗CD34、CD45、CD29、CD44、CD90、CD105单克隆抗体,FACS检测MSC表面抗原表达。
1.3 人骨髓间充质干细胞在亚致死剂量射线照射BALB/C-nu/nu裸小鼠体内的造血分化潜能
1.3.1 取生长良好的P5代hMSC,常规消化洗涤后,收集细胞浓度为(0.8-1)×107/ml。细胞分离后冰上保存,尽快输注。
1.3.2 BALB/C-nu/nu裸鼠给予60Coγ射线全身照射,照射剂量为3.5Gy,照射剂量率为750cGy/min,照射后的裸鼠随机进行分为2组,每组10只,6小时内进行移植,实验组输注hMSC细胞,输注量为(1.6-2)×106/只。对照组输注PBS 0.2ml。
1.3.3 移植后每日观察裸鼠外观、活动状况、毛发、大小便及摄食情况,每周测量体重,断尾取血20μl进行白细胞计数。
1.3.4 骨髓病理及免疫组化分析 实验组移植后存活至第8周的裸鼠或对照组裸鼠在濒死时摘除眼球放血处死,剪下双侧股骨骨骺端,脱钙后,10%中性甲醛固定,石蜡包埋、脱水、透明,常规切片后HE染色,显微镜下观察。骨髓病理切片以鼠抗人CD34和CD45单抗为标记进行免疫组织化学染色。
1.3.5 骨髓细胞粒-单/巨噬系集落形成单位(CFU-GM)的培养 处死裸鼠后剪下双下肢,分离双侧股骨和胫骨,以IMDM培养液冲出骨髓细胞,加入含rhGM-CSF甲基纤维素半固体培养体系,置于37℃、5%CO2及饱和湿度下培养14天后,观察集落形成情况。
1.3.6 FACS检测人源细胞含量 取裸鼠1×106个骨髓细胞加入FITC-mouse anti hu CD45/PE-mouse anti hu CD34,同型对照为FITC-mouse IgG1/PE-mouse IgG1,流式细胞仪检测,联机专用软件Cell Quest分析,结果以FITC-PE双参数曲线图表示。
1.4 统计学处理
应用SPSS软件进行统计分析,计量资料以均数±标准差表示,采用单因素方差分析进行数据统计学处理。
2 结果
2.1 人骨髓间充质干细胞的分离、培养、扩增和鉴定
扩增后的hMSC呈梭形或多角形,成平行排列生长或漩涡状生长,胞浆淡染,核大、居中,核染色质粗,并可见双核细胞。经FACS检测,成人骨髓来源的 MSC主要表达黏附分子CD29、CD44、CD90、CD105,不表达造血细胞表面标志CD34、CD45,细胞均一性达90%以上。
2.2 照射及移植后祼鼠外观及白细胞计数
照射后裸鼠一般状态较差,体形明显消瘦,进食减少,毛色变暗,对照组从第2周至第4周,陆续死亡,而实验组除3只意外死亡外,均存活至8周,实验组裸鼠9-12d后状态逐渐恢复至正常。照射后第1周两组裸鼠白细胞数明显下降,对照组裸鼠白细胞数呈持续下降趋势,直至全部死亡。实验组裸鼠白细胞数在第2周开始恢复,至第6周白细胞计数恢复正常。
2.3 对移植后存活8周和对照组的裸鼠进行骨髓病理学分析
实验组裸鼠骨髓增生活跃,可见各期幼稚细胞。对照组裸鼠骨髓病理显示骨髓细胞增生低下,造血面积减少,非造血细胞增多(图1-2)。免疫组化结果表明实验组小鼠的骨髓中可以检测到CD34阳性和CD45阳性的细胞,细胞呈局灶性分布,阳性细胞胞浆及胞膜呈棕黄色(图3-4)。而对照组裸鼠的骨髓细胞中未检测到阳性细胞。
2.4 骨髓细胞粒-单/巨噬系集落形成单位(CFUGM)的培养结果
实验组裸鼠的骨髓细胞在含rhGM-CSF甲基纤维素半固体培养体系培养14天后,可见少量的密集型集落形成(图略)。
2.5 FACS检测人源细胞含量
经流式细胞仪分析,实验组裸鼠骨髓中可以检测到CD34阳性和CD45阳性的细胞,阳性百分率分别为4.63%±0.57%和0.87%±0.12%(图略),而对照组未检测到CD34阳性和CD45阳性的细胞。
3 讨论
大量的研究证实,成体干细胞不仅仅是一种“定向干细胞”(Commited stem cells),即只能分化为其所起源或定居组织的特定细胞类型,同时它能够分化为其他组织细胞类型。研究表明,MSC已不再局限于其支持和维持体内外造血的功能[3],不仅可在体内、体外分化为中胚层来源的细胞,也可以分化为外胚层来源的神经样细胞,而且在一定的微环境的调控下向多能造血干细胞分化,发育成各系造血细胞,但应有适合于复制和分化的基质即“生态龛”的存在[2]。推测MSC可能是造血细胞和基质细胞的公共干细胞(Common stem cells),即MSC同样具有向造血细胞分化的潜能。呼莹等将扩增后的雄性小鼠骨髓MSCs输注给预先经致死剂量照射的雌性小鼠,输注后的第3周,外周血和骨髓中的有核细胞都明显恢复,数天后通过PCR方法特异性地扩增Y染色体的sry基因,确定在重建造血的小鼠体内,造血细胞大部分来源于供体 MSC[4]。Porada等研究发现将表型为 CD90+、CD44+、CD29+、CD106+、CD45-、STRO-1+MSC进行羊宫内羊胎移植,借助于胚胎微环境,MSC能分化为造血细胞和肝细胞,尽管检出率不高,但这种MSC来源的细胞能在体内存活长达半年以上而无任何毒性反应[5]。

图1 实验组裸鼠骨髓病理(×100)

图2 对照组裸鼠骨髓病理(×100)

图3 实验组骨髓病理免疫组化CD34阳性(×1000)
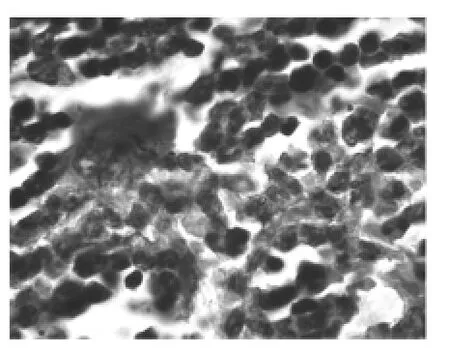
图4 实验组骨髓病理免疫组化CD45阳性(×1000)
本实验将体外分离扩增的hMSC移植给亚致死剂量照射后的裸鼠,移植后第1周裸鼠白细胞数值下降明显,实验组移植后第6周,外周血白细胞明显恢复并接近正常水平。骨髓病理结果显示,移植后8周,实验组裸鼠骨髓细胞增生活跃,可见各个阶段的细胞。同时我们以CD34、CD45作为标记,通过FCM、免疫组化的方法检测人源性造血细胞的植入情况,结果表明实验组骨髓可以检测到CD34和人CD45阳性的细胞,体外造血祖细胞集落培养结果也进一步证实移植受体小鼠骨髓中存在人源性造血干/祖细胞。说明hMSC能在亚致死剂量射线照射的裸鼠骨髓中植入并分化表型为人CD34+的造血干/祖细胞,重建造血。
HSCT作为一种重要的生物或细胞治疗,尽管已取得了令人鼓舞的临床疗效,但供源不足、原始造血干细胞能否大量扩增仍存争议以及移植物中肿瘤细胞的污染等使得HSC在数量和质量上远不能满足临床的需要。相比之下,MSC来源广、易于分离和体外培养,并且在体外易于大量扩增,本研究结果证实MSC可以分化为造血细胞,MSC以贴壁的方式生长,而白血病细胞主要以悬浮的方式生长,那么,我们可以从白血病患者骨髓中分离出MSC,通过贴壁和体外反复消化传代培养,大量扩增的同时也可清除移植物中的白血病细胞以达到净化移植物的目的,MSC不仅可分化为造血干/祖细胞重建造血,而且能在一定程度上减少术后复发,因此MSC有望成为HSC的新来源,MSC移植将具有更广泛的应用前景。
[1]Yuchua J,Jahagirdar BN,Reinhardt RL,et al.Pluripotency of mesenchymal stem cells derived from adult marrow[J].Nature,2002,418(6893):41.
[2]施斐曼,刘 永.造血干细胞发生学研究-人胚肝造血干细胞[J].细胞生物学杂志,1982,4:15.
[3]Linzhao CH,Qasba P,Vanguri P,et al.Human mesenchymal stem cells support megakaryocyte and pro-platelet formation from CD34+ hematopoietic progenitor cells[J].Cell Physiol,2000,184(1):58.
[4]呼 莹,马 丽,马冠杰,等.具骨髓间充质干细胞表型的成体干细胞移植造血[J].中国医学科学院学报,2002,24(1):20-24.
[5]Porada GA,Brouard N,et al.Generation of hematopoietic and hepatic cells by human bone marrow stromal cells in vivo[J].Blood.2001,96(11):57.
