猪繁殖与呼吸综合征病毒相关猪microRNA的初步筛选
2012-11-23薄联锋武小椿温俊歌徐志坤张德礼
郜 原,薄联锋,武小椿,孙 柏,温俊歌,孙 岩,徐志坤,张德礼
(西北农林科技大学动物医学院 兽医微生物学与病毒学课程组病毒免疫与生物信息研究室,陕西 杨凌712100)
猪繁殖与呼吸综合征病毒(PRRSV)是一种严重危害着我国乃至全世界养猪业发展的猪免疫抑制性疾病,尤其是高致病性猪蓝耳病的暴发,对我国养猪业造成了极大损失。但受限于病毒主要结构蛋白GP5超变异性等原因,PRRSV 疫苗开发受到严重制约[1],目前 microRNA(miRNA)的病毒调节作用引起人们广泛关注。miRNA是一类小分子非编码单链RNA,大小约18~25bp,成熟的miRNA在细胞内和靶基因的3′端非编码区(3′utr)互补,调节基因表达,抑制病毒复制。本试验旨在寻找猪体与PRRSV 3′utr发挥作用的miRNA,为PRRSV乃至高致病性猪蓝耳病的防治探索新方法。
1 材料与方法
1.1 细胞系、血清与细胞培养基 猪脐静脉血管内皮细胞系(SUVEC)为西北农林科技大学张彦明教授惠赠;胎牛血清购自HyClone;高糖DMEM购自Invitrogen公司。
1.2 主要酶、试剂与载体 内切酶PmeⅠ、XhoⅠ,购自纽英伦生物技术(北京)有限公司;LipofectamineTM2000,购自Invitrogen公司;TaqDNA聚合酶;双荧光素酶载体psiCHECKTM-2、双荧光素酶检测试剂盒,购自Promega公司。
1.3 miRNA、PRRSV 3′utr和引物的合成 人工合成ssc-miR-323、ssc-miR-105-1及两者的抑制物inhibitor,由上海吉玛制药技术有限公司合成,同时合成阴性对照miRNA Control及相应抑制物inhibitor control。
根据GenBank中公布的PRRSV JXA1株基因序列(GenBank登录号:EF112445),获得病毒3′utr序列,将两端分别加上酶切位点PmeⅠ和XhoⅠ,送南京金斯瑞生物科技有限公司合成。用Primer软件 设 计 1 对 3′utr引 物 P1:5′-ACCTCGAGTGGGCTGGCATTCTTTGG-3′; P2:5′-TGGTCGACAATTACGGCCGCATGGTTC-3′,由南京金斯瑞生物科技有限公司合成,其中斜体部分为PmeⅠ和XhoⅠ酶切位点。
1.4 PRRSV 3′utr双荧光素酶重组载体的构建将公司合成并转入pUC-3′utr的载体菌接于普通LB培养基中,37℃过夜摇起,提取质粒,PmeⅠ/XhoⅠ37℃2h双酶切,琼脂糖凝胶电泳,回收157bp大小的目的片段,与经相同双酶切处理的psiCHECKTM-2载体用T4连接酶4℃连接过夜,转化感受态大肠杆菌DH5α,氨苄抗性筛选摇菌提取质粒,PmeⅠ/XhoⅠ双酶切鉴定及PCR鉴定,送往南京金斯瑞生物科技有限公司测序。
1.5 生物信息学预测与PRRSV 3′utr作用的潜在miRNA 根据miRBase公布的猪76条miRNA,结合Mirnada,RNAhybrid和RNA22三个网络软件,预测PRRSV 3′utr有潜在靶标的猪miRNA,选出可能性最大的miRNAs进行试验。
1.6 重组质粒与miRNA转染猪血管内皮细胞(SUVEC) 大量摇菌,提取psiCHECK-utr和psi-CHECKTM-2质粒。将合成的miRNAs及其抑制物分别与psiCHECK-utr质粒共转染SUVEC,设立空载体对照,依照LipofectamineTM2000试剂说明转染96孔板,各自设置6个复孔,转染设置组如下:1:psiCHECKTM-2vector,2:psiCHECK-utr,3:miRNA control;psiCHECK-utr,4:inhibitor control;psiCHECK-utr,5:miR-323;psiCHECK-utr,6:miR-323inhibitor;psiCHECK-utr,7:miR-105-1;psiCHECK-utr,8:miR-105-1inhibitor;psiCHECK-utr,9:miR-323;miR-105-1;psiCHECK-utr,10:miR-323inhibitor;miR-105-1inhibitor;psiCHECK-utr。转染后分别于24、36、48h进行双荧光素酶活性检测。
1.7 转染组细胞的双荧光素酶活性检测 将转染完成后细胞培养板中的培养液弃去,按照双荧光素酶检测试剂盒说明,用微孔板发光分析仪检测萤火虫荧光素酶(firefly luciferase)和海参荧光素酶(renilla luciferase)活性。
2 结果
2.1 psiCHECK-utr重组载体的鉴定 将构建好的psiCHECK-utr重组载体做PCR鉴定和PmeⅠ/XhoⅠ双酶切鉴定,均得到了大小157bp的目的条带(图1),测序结果与标准序列一致,psiCHECK-utr重组载体构建成功。

图1 psiCHECK-utr重组载体的双酶切和PCR鉴定
2.2 生物信息学预测与PRRSV相关的miRNAs
结合 Mirnada、RNAhybrid和RNA22三个靶标预测软件,筛选到3条潜在的猪miRNAs:ssc-miR-323、ssc-miR-105-1、ssc-miR-105-2,由 于 ssc-miR-105-1和ssc-miR-105-2同源,只有3′末端两个碱基互换,选取其中的ssc-miR-105-1进行本次试验。
2.3 双荧光素酶检测结果
2.3.1 psiCHECK-utr受SUVEC细胞作用影响
转染psiCHECK-utr和psiCHECKTM-2空载体对照的SUVEC细胞,双荧光素酶试剂检测发现,psi-CHECK-utr发光比率相比对照组在24、36、48h都略有上升,48h时最明显(图2),说明SUVEC细胞对PRRSV 3′utr表达没有抑制效果,进行t检验发现,3组产生的变化差异都不显著,可能说明细胞中相关miRNA对PRRSV 3′utr没有抑制作用,而且某些未知因素有利于PRRSV 3′utr的表达。
2.3.2 psiCHECK-utr与 ssc-miR-323、ssc-miR-105-1共转染细胞双荧光素酶检测 重组载体psi-CHECK-utr分别与ssc-miR-323、ssc-miR-105-1以及两者混合物共转染SUVEC,设置miRNA Control做对照,36h、48h后检测(图3),可以看到psi-CHECK-utr与ssc-miR-105-1共转染组以及与两个miRNAs的混合共转染组荧光比率在36h和48h较对照组都有所下降,48h时变化更明显,抑制率可以达到 30%,而 psiCHECK-utr与ssc-miR-323共转染组荧光比率较对照组没有下降,说明sscmiR-105-1可能对PRRSV 3′utr有一定抑制的作用,不过差异显著性检验并没有发现试验组与对照组之间有显著性差异。
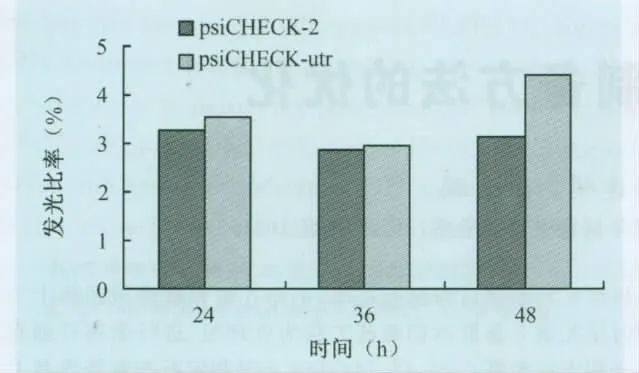
图2 psiCHECK-utr转染SUVEC细胞后双荧光素酶相对活性比较
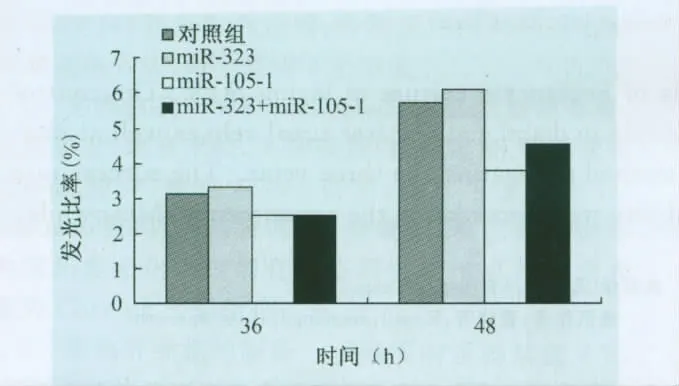
图3 psiCHECK-utr与ssc-miR-323、ssc-miR-105-1共转染细胞双荧光素酶相对活性比较
2.3.3 psiCHECK-utr与 ssc-miR-323、ssc-miR-105-1抑制物共转染细胞双荧光素酶检测 重组载体 psiCHECK-utr 分 别 与 ssc-miR-323、ssc-miR-105-1的抑制物以及两者的混合物共转染SUVEC细胞系,同时设置inhibitor control做对照,36h、48 h后,双荧光素酶试剂检测(图4),柱状图看到,加入miRNA抑制物的各试验组比对照组略有下降,但差异不明显。
2.3.4 ssc-miR-323、ssc-miR-105-1 对 PRRSV 3′utr表达的影响 分别分析ssc-miR-323和sscmiR-105-1对 PRRSV 3′utr抑 制 作 用,设 置 psi-CHECK-utr单独转染做对照(图5),发现ssc-miR-323转染后,双荧光素酶发光比率略有上升,与2.3.1中psiCHECK-utr转染SUVEC后荧光比率上升情况相同,说明ssc-miR-323对 PRRSV 3′utr表达没有抑制作用;而转染ssc-miR-105-1后,发光比率有所下降,36h和48h抑制率都在13%左右,而转染ssc-miR-105-1抑制物后,发光比率恢复,说明sscmiR-105-1对PRRSV 3′utr表达是有抑制作用的。

图4 psiCHECK-utr与ssc-miR-323、ssc-miR-105-1抑制物共转染细胞双荧光素酶相对活性比较
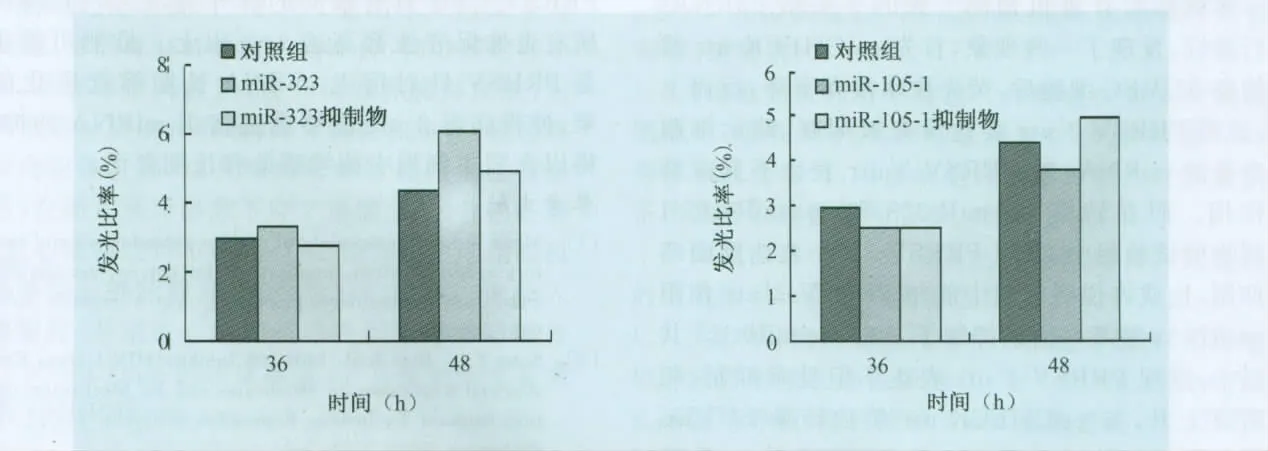
图5 ssc-miR-323和ssc-miR-105-1对PRRSV 3′utr抑制作用的双荧光素酶相对活性检测
3 讨论
已经有大量研究证明,细胞miRNA可以对病毒起到调节作用[2],miRNA与PRRSV的研究有助于为PRRSV防控带来新的机遇,双荧光素酶报告基因是目前国际上通用的对miRNA及靶标进行验证的工具载体[3]。
本试验对计算机预测[4]到的3条猪miRNAs进行验证,发现了一些现象,首先psiCHECK-utr载体转染SUVEC细胞后,荧光比率没有下降,反而上升,说明PRRSV 3′utr表达没有被抑制,暗示细胞系自身的miRNAs对PRRSV 3′utr表达不具有抑制作 用。而在转染 ssc-miR-323 和 ssc-miR-105-1抑制物的试验组中,发现PRRSV 3′utr表达反而略受抑制,这或许说明细胞中能与PRRSV 3′utr作用的miRNAs被某些因素抑制了。在ssc-miR-323共转组中,发现PRRSV 3′utr表达不但没有抑制,相反略有上升,与psiCHECK-utr单独转染SUVEC结果相同,说明ssc-miR-323对 PRRSV 3′utr并没有抑制作用。而在ssc-miR-105-1的转染组中,发现PRRSV 3′utr有一定抑制,而且ssc-miR-323和sscmiR-105-1混合转染组结果也证实了这一点,但是抑制效果并不明显,抑制率只有13%~30%。同时,进行 PRRSV 3′utr BLAST 比对后,发现PRRSV 3′utr具有极高的保守性,已知的PRRSV所有毒株保守性都高达94%以上。推测可能也正是PRRSV针对宿主miRNA长期筛选进化的结果,使得病毒3′utr能够逃避宿主miRNA的抑制,得以在宿主细胞中持续感染和长期存活。
[1]Meng X J.Heterogeneity of porcine reproductive and respiratory syndrome virus:implications for current vaccine efficacy and future vaccine development[J].Vet Microbiol,2000,74(4):309-329.
[2]Sung T L,Rice A P.MiR-198Inhibits HIV-1Gene Expression and Replication in Monocytes and Its Mechanism of Action Appears To Involve Repression of Cyclin T1[J].PLoS Pathogens,2009,2(5):1-13.
[3]侯勃,张彦明,朱晓娟,等.猪血管内皮细胞中与猪瘟病毒相关microRNA的初步筛选[J].畜牧兽医学报,2010,41(5):576-580.
[4]Peng X X,Chan E Y,Li Y,etal.Virus-host interactions:from systems biology to translational research[J].Current Opinion in Microbiology,2009,7(12):432-438.
