胰岛素对雏鸡心肌发育及其超微结构的影响
2012-11-23吴荣富杨亚群张红强曹海霞
秦 健,吴荣富,杜 荣,杨亚群,张红强,曹海霞,辛 香
(1.中国农业大学动物医学院,北京 海淀100193;2.山西农业大学信息科学与工程学院电镜中心,山西 太谷030801;3.中国农业科学院家禽研究所,江苏 扬州225003;4.山西农业大学动物科技学院,山西 太谷030801)
胰岛素是由胰岛β细胞受内源性或外源性物质刺激而分泌的一种蛋白质激素,是动物体内降低血糖,促进糖原、脂肪、蛋白质合成的重要激素,在机体的代谢调节和生长发育中起着重要作用。心肌是动物体的重要组成部分,是胰岛素作用的一个重要靶器官。因此,研究胰岛素对心肌发育的影响具有重要意义。有研究表明,胰岛素可以改善糖尿病大鼠损伤的心肌超微结构,对心肌具有保护作用[1]。胰岛素早期干预对糖尿病大鼠心肌细胞具有抗凋亡作用[2]。然而,关于胰岛素对正常动物心肌发育及其超微结构的影响,特别是针对禽类的研究,则鲜见报道。本试验旨在通过给雏鸡注射适量胰岛素,分析其对心肌发育及其超微结构的影响,为进一步深入研究胰岛素对心肌发育和代谢的分子细胞机制奠定基础,也为在实践中更好地利用胰岛素抗应激、抗疾病并促进生长提供依据。
1 试验材料
1.1 试验动物 选用16只体重约200g的健康雏鸡,随机分成两组,常规饲养和管理,自然光照,自由采食和饮水。
1.2 主要试验试剂 胰岛素注射液(江苏万邦生化医药股份有限公司)、0.9%生理盐水、磷酸二氢钠、磷酸氢二钠、四氧化锇酸、0.1mol/L磷酸缓冲液、2.5%磷酸缓冲的戊二醛固定液、1%磷酸缓冲的四氧化锇固定液、无水乙醇、无水硫酸铜、环氧丙烷、Epon812、DDSA、MNA、DMP-30、醋酸双氧铀、硝酸铅、柠檬酸钠。
1.3 主要仪器和器材 日本电子GEOL-1400透射电镜、LEICA EM KMR2制刀机、LEICA EM UC6超薄切片机(Leica,Austria)、XTB-I型连续变倍体视镜、DG/20-002型台式干燥箱(重庆试验设备厂制造)、SC-210F白雪牌商用陈列柜、SE202F型电子天平(上海奥豪斯仪器有限公司生产)、D系列超声波清洗机(宁波新芝生物科技股份有限公司生产)、BCD-197KZ型新飞冰箱、SPR-1水平振荡器。
2 试验方法及分析
2.1 动物处理方法 试验组8只雏鸡每天定时腹腔注射1mL胰岛素注射液(0.4单位/mL),对照组8只雏鸡腹腔注射等体积生理盐水。连续注射10d后,禁食,称重,解剖取出心脏,称重,并迅速剖出1mm3相同部位心室肌组织2块,放入预冷的2.5%的戊二醛固定液中。
2.2 电镜样本制作及分析 在4℃2.5%戊二醛固定液固定24h,PBS漂洗;1%锇酸固定液固定1.5 h,PBS漂洗;乙醇梯度脱水,环氧丙烷过渡,环氧丙烷和Epon812树脂的混合液浸透2h;纯Epon812树脂浸透过夜、包埋,干燥箱中聚合48h;半薄切片定位,50~70nm超薄切片,醋酸双氧铀和柠檬酸铅双染色;JEOL-1400透射电镜观察拍照。心肌线粒体横截面积采用Gantan Digital Micrograph软件(Gatan Inc.USA)定量分析。
2.3 统计分析 试验数据采用SPSS 13.0统计软件处理,各组试验数据以均数±标准差(±SD)表示。两组间差异显著性分析用两样本均数差别的t检验,P<0.05为组间差异具有显著性,P<0.01为组间差异极显著。作图采用Excel 2007软件。
3 试验结果
3.1 试验期末雏鸡的体重和心肌重量 见表1。

表1 雏鸡体重、心肌重和心体比
试验期末,试验组与对照组雏鸡的体重、心肌重和心体比均差异不显著(P>0.05)(表1)。表明在本试验的注射剂量和注射时间下,胰岛素对雏鸡的生长发育未产生显著影响。
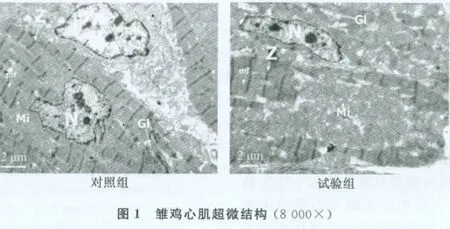
3.2 超微结构观察 8 000倍电镜下观察雏鸡心肌肌原纤维超微结构(图1),对照组和试验组均可见结构完整的细胞核(N),核仁清晰,核染色质均匀,结构正常的线粒体(Mi),清晰完整的肌丝(mf),排列整齐的Z线,粗细均匀的肌节,A带中有粗肌丝和细肌丝交错排列,肌原纤维或肌丝之间可见糖原颗粒(Gl)。
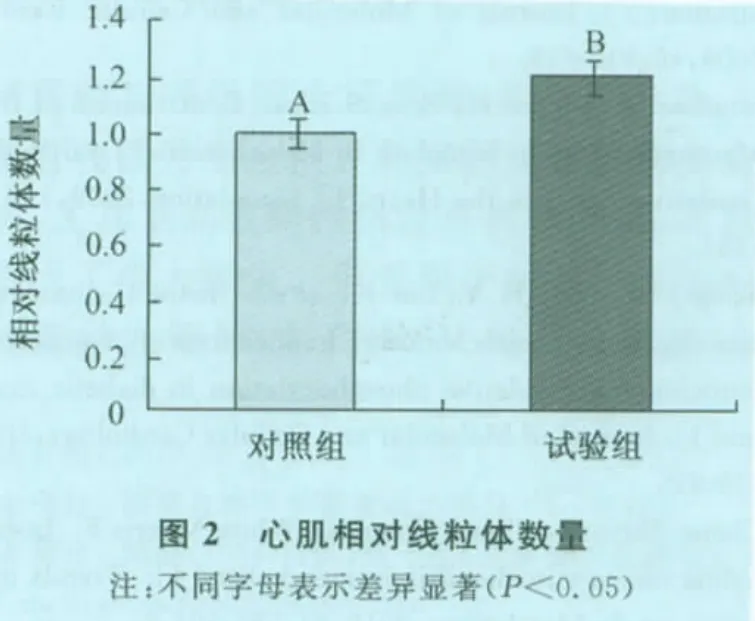
定量分析结果表明,与对照组相比,试验组肌细胞内线粒体数量和面积均明显增加(P<0.05)(图2和图3)。

80 000倍电镜下进一步观察雏鸡心肌细胞线粒体(Mi)超微结构(图4),对照组和试验组均可见完整清晰的线粒体双层膜结构、内膜向内折叠形成许多嵴(Ci)、嵴长而密,呈平行排列,嵴间腔内由无定形物质或细粒状物质构成,呈中等电子密度。与对照组相比,试验组线粒体明显变大,嵴更加清晰,并且嵴间腔面积增加,基质更为丰富。

图4 雏鸡心肌超微结构 (80 000×)
4 讨论与分析
胰岛素通过调节物质代谢和能量代谢对动物的生长发育等起着至关重要的作用。而线粒体作为动物细胞内的能量转换器,是细胞内氧化磷酸化和形成ATP的主要场所。对人类和小鼠等哺乳动物的研究表明,胰岛素与线粒体的发生及功能有关。有研究表明,胎牛骨骼肌中线粒体蛋白的含量与血清胰岛素的增加呈正相关[3]。Pawlikowska等(2006)通过体外培养的细胞研究表明,线粒体是胰岛素介导肌生成的必需细胞器,而胰岛素又能刺激线粒体的发生和促进线粒体的功能[4]。
心肌细胞由于其高效的收缩功能,其线粒体含量比骨骼肌更为丰富,线粒体的氧化磷酸化是心肌能量的主要来源。而心肌细胞又含有大量胰岛素受体,是典型的胰岛素靶细胞。所以胰岛素对心肌线粒体的发生及功能具有重要的意义。在心肌梗死小鼠,胰岛素信号受损降低了线粒体的氧化功能[5]。另有研究表明,胰岛素信号受阻明显促进了小鼠心肌线粒体的氧化应激和解偶联[6]。本试验短期内给雏鸡注射生理剂量的胰岛素后对其体重和心体比虽未产生显著影响(表1),但明显影响了心肌的超微结构,如糖原颗粒增加、线粒体数量增加和体积增大(图1~4)。而且大量图片的观察结果表明,线粒体数量和体积增加的同时,线粒体的结构也有所改善,如嵴间基质面积增加。这些结果表明,适量补充生理剂量的胰岛素可以通过增加线粒体的发生和提高线粒体的功能而改善正常雏鸡心肌的代谢功能,从而提高雏鸡的生长发育和抗应激、抗疾病能力。胰岛素增加线粒体数量和体积的原因可能是细胞对代谢加强的一种适应性反应。从小鼠等哺乳动物的一些研究结果推测,胰岛素提高禽类心肌线粒体功能的机制,可能与下列因素有关:胰岛素刺激可以激活PI3K-Akt途径,诱导Akt磷酸化并促进Akt向心肌线粒体迁移[7];胰岛素信号可以通过维持线粒体生物发生和作用过程中的一些关键介质如NAD+/NADH比例等而加强线粒体电子传递链的完整性和活性[8]。有关胰岛素促进线粒体发生和增殖机制的研究较少,而且禽类具有不同于哺乳动物的一些生理机制,因此有关生理剂量胰岛素促进禽类心肌线粒体发生和功能的确切分子和细胞机制有待进一步研究。
[1]金秀平,吴云丹,崔路坤.甘精胰岛素对糖尿病大鼠心肌纤维化及超微结构的影响[J].西安交通大学学报:医学版,2009,30(6):732-734.
[2]刘雅玲,江时森,程训民,等.胰岛素抑制糖尿病大鼠心肌细胞凋亡的作用及机制[J].解放军医学杂志,2010,35(7):798-801.
[3]Pajak B,Pawlikowska P,Cassar-Malek I,etal.Abundance of some skeletal muscle mitochondrial proteins is associated with increased blood serum insulin in bovine fetuses[J].Research in Veterinary Science,2010,89(3):445-450.
[4]Pawlikowska P,Gajkowska B,Hocquette J F,etal.Not only insulin stimulates mitochondriogenesis in muscle cells,but mitochondria are also essential for insulin-mediated myogenesis[J].Cell Proliferation,2006,39(2):127-145.
[5]Sena S,Hu P,Zhang D F,etal.Impaired insulin signaling accelerates cardiac mitochondrial dysfunction after myocardial infarction[J].Journal of Molecular and Cellular Cardiology,2009,46:910-918.
[6]Boudina S,Bugger H,Sena S,etal.Contribution of Impaired Myocardial Insulin Signaling to Mitochondrial Dysfunction and Oxidative Stress in the Heart[J].Circulation,2009,119:1272-1283.
[7]Yang J Y,Yeh H Y,Lin K,etal.Insulin stimulates Akt translocation to mitochondria:Implications on dysregulation of mitochondrial oxidative phosphorylation in diabetic myocardium[J].Journal of Molecular and Cellular Cardiology,2009,46:919-926.
[8]Cheng Zhiyong,Tseng Yolanda,White Morris F.Insulin signaling meets mitochondria in metabolism[J].Trends in Endocrinology & Metabolism,2010,21:589-598.
