8批硝苯地平缓释片(Ⅱ)的检验与分析
2012-11-22杨俊峰十堰市中医医院药剂科湖北十堰442011
杨俊峰 (十堰市中医医院药剂科,湖北 十堰 442011)
陈银华 (十堰市食品药品监督检验所,湖北 十堰 442599)
8批硝苯地平缓释片(Ⅱ)的检验与分析
杨俊峰 (十堰市中医医院药剂科,湖北 十堰 442011)
陈银华 (十堰市食品药品监督检验所,湖北 十堰 442599)
目的:对硝苯地平硝苯地平缓释片(Ⅱ)进行质量评价。方法:参考国家标准新药转正标准及中国药典对8批硝苯地平硝苯地平缓释片(Ⅱ)进行性状、鉴别、释放度和含量测定等项检验。结果:8批样品中5批各项检验全部合格,另外1批含量测定不合格,有2批释放度检查不合格,不合格样品均为假冒。结论:应加强对该药品的监督检验和防假冒。
硝苯地平硝苯地平缓释片(Ⅱ);释放度;含量测定;假冒药品
硝苯地平缓释片(Ⅱ)收载于国家标准新药转正标准第52册[1],主要用于慢性稳定性心绞痛(劳累型心绞痛)、血管痉挛型心绞痛(Prinzmetal's心绞痛、变异型心绞痛)和原发性高血压。硝苯地平缓释片(II)是按照控释片的工艺来生产的,比普通的缓释片进步一点,为了和普通的缓释片区别所以叫硝苯地平缓释片(II)。作者在日常工作中,检验到8批标示为青岛黄海制药有限责任公司生产的硝苯地平缓释片(Ⅱ)(商品名伲福达),其中有3批为不合格产品。经与生产厂家进行核查,确认该3批药品均为假冒。
1 仪器、试剂及样品
RCZ-8M溶出仪RZQ-8D 取样系统(天津天大天发),UV2100分光光度计(美国Lab Tech)。硝苯地平对照品:购自中国药品生物制品检定所,批号100338-0001,试剂均为分析纯。硝苯地平缓释片(Ⅱ),标示为青岛黄海制药有限责任公司,批号分别为0912020、1003012、1004020、1006016、1008105、1009106、1101109、1009021。
2 方法与结果
2.1鉴别
本品为黄色片。①取硝苯地平约50mg,加丙酮3ml,振摇提取,放置后,取上清液,加20%NaOH溶液3~5滴,振摇,溶液应显橙红色。②取含量测定项下的溶液,加等量的无水乙醇稀释后,按照分光光度法测定。在237nm的波长处有最大吸收,在320~355nm的波长处有较大的宽幅吸收(见图1)。
2.2释放度检查
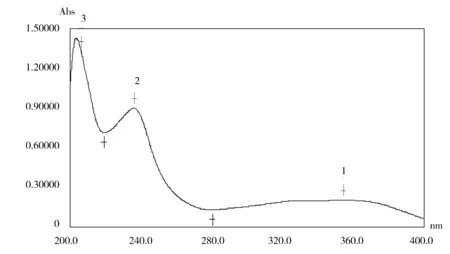
图1 供试品溶液紫外吸收色谱图
①取异丙醇200ml,加入0.1mol/L的盐酸溶液至1000ml作为溶剂6份,再取硝苯地平片6片照释放度测定法第一法装置,将药物放置后进行旋转,转速100rpm,经过60min,分别取出溶液10ml,滤过,取续滤液作为供试品溶液I。②更换缓冲液为溶剂,取异丙醇200ml,加磷酸盐酸缓冲液(pH5.8)至1000ml的溶液为溶剂6份,同法操作,经过120min时,取溶液10ml,滤过,取续滤液作为供试品溶液II。③再取2mol/L NaOH溶液约10ml调节缓冲液的pH至7.2,同法操作,又经过180min时,取溶液10ml,滤过取续滤液作为作为供试品III。④另精密称取经105℃干燥1h的硝苯地平对照品约12.5mg,置25ml量瓶中,加无水乙醇溶液溶解并稀释至刻度,摇匀;分别精密量取2ml,置100ml量瓶中,并分别加入上述酸性溶液和缓冲液制成每1ml中约含10μg的对照品溶液(1)和对照品溶液(2)。取对照品溶液(1)与供试品溶液I,对照品溶液(2)与供试品溶液Ⅱ、Ⅲ,紫外分光光度法,在333nm的波长处测定稀释度[2],分别计算每片在不同时间的溶出量。本品每片在1、3h和6h的释放量应分别为标示量的10%~35%、35%~65%和70%以上,均应符合规定。
2.3含量测定
避光操作,取本品20片,精密称取适量约相当于硝苯地平30mg置乳钵中,加氯仿2ml,研磨,用无水乙醇分次定量转移至100ml量瓶中,加无水乙醇稀释至刻度,摇匀,滤过,精密量取续滤液5ml,置50ml量瓶中,加无水乙醇稀释至刻度,摇匀,照分光光度法,在333nm的波长处测定吸收度,按C17H18N2O6的百分吸光系数(E)为140计算,含硝苯地平应为标示量的90.0%~110.0%。
2.4结果
8批样品中5批各项检验全部合格,另外1批含量测定不合格,有2批释放度检查不合格,不合格样品均为假冒。见表1。

表1 硝苯地平缓释片(Ⅱ)的检验结果
3 讨 论
正品硝苯地平缓释片(Ⅱ)在整个释放度检查的过程中膨大成直径大约为1cm左右的球状。1批伪品硝苯地平缓释片(Ⅱ)含量测定不合格(批号1006016),不需要继续检查释放度。另2批假冒品(批号1009021和1004020)鉴别项和含量测定均符合标准规定,但释放度不符合规定,主要表现为在释放度检查的第一步酸性溶液中释放60min后,该药片已经全部崩解成粉末状并从转篮中漏出至溶出杯,在第二、三步缓冲液中则无法继续释放。说明该假冒药物生产工艺不能达到缓释片(Ⅱ)的要求。
经与厂家核查证实不合格品均为假冒品,经仔细辨别外包装、标签和说明书与正品稍有不同,普通消费者很难辨别。3批药品按标准规定进行鉴别均符合规定,其中2批甚至含量测定都符合规定,仅仅是释放度不符合规定。不法商贩的作假手段越来越高,对药品检验和监督部门提出了更大的考验,也对正规生产厂家的防伪包装提出了更高的要求。
检验标准中鉴别(2)规定在237nm的波长处有最大吸收,在320~355nm的波长处有较大的宽幅吸收。在实际检验过程中,我们对对照品及多批样品均进行测定,结果表明,在(237±2)nm的波长处有最大吸收,在320~355nm的波长处有较大的宽幅吸收,与标准相符;而宽幅吸收的位置更准确的说大约在330~365nm,建议此药品标准进行进一步修订时对此项内容进行研究。
物质在最大吸收波长下,吸光度比较大,其它对吸光度有影响的物质、色散因素等对吸光度的影响相对情况下就比较小,更能真实的反应物质的特性。因此,一般用分光光度法测定含量时选择的吸收波长为其最大吸收波长。另外,紫外分光光度法的吸光度读数,以在0.3~0.7之间的误差较小。而本新药转正标准中释放度和含量测定的检测波长均为333nm,不是在最大吸收的237nm处测定,使释放度的检测过程中供试品溶液的吸光度偏低(0.2甚至0.1以下),使检测的系统误差偏大,建议此药品标准对此项内容进行进一步的修订。
[1]中华人民共和国卫生部药典委员会. 国家食品药品监督管理局国家药品标准——新药转正标准[S]. 52册. 2003:124.
[2]中华人民共和国卫生部药典委员会.中华人民共和国药典:二部,附录4[S].2010.
10.3969/j.issn.1673-1409(R).2012.08.022
R927.2
A
1673-1409(2012)08-R045-02
2012-05-21
杨俊峰(1964-),男,湖北郧县人,主管药师,主要从事临床药学工作。
[编辑] 一 凡
