同时蒸馏萃取-气质联用分析养殖暗纹东方鲀肉中的挥发性成分*
2012-11-21吴容陶宁萍刘源王锡昌
吴容,陶宁萍,刘源,王锡昌
(上海海洋大学食品学院,上海,201306)
河豚鱼(fugu)英文名pufferfish,与鲥鱼、刀鱼并称“长江三鲜”。长期以来,我国沿海地区一直有吃河豚鱼的习惯;日本人、韩国人也把河豚鱼视为珍馐佳肴。近年来由于野生资源过度利用、控毒技术的日益完善、养殖规模不断扩大,养殖河豚鱼越来越受到国内外消费者的欢迎。人们对开放鲜河豚市场的呼声也越来越高,养殖河豚鱼巨大的市场经济价值越来越突显。统计数据显示,目前国内食用较多的品种为淡水养殖的暗纹东方鲀,多以熟食为主。而目前对暗纹东方鲀的研究报道主要集中在毒性及一些营养评价,但对风味物质的研究国内外鲜有报道,因此探究河豚鱼美味奥秘及不同养殖环境下风味的差异能够为河豚鱼的养殖和加工食用及改善河豚鱼肉品质提供指导,具有十分现实的意义。
近年来,关于鱼肉中挥发性成分提取的方法有溶剂萃取法、固相微萃取、溶剂辅助蒸馏萃取技术和顶空吹扫捕集、同时蒸馏萃取法等,前4种前处理方法存在一定缺陷,如溶剂萃取法耗时、风味物质损失大;固相微萃取萃取头对风味物质有较大选择性;溶剂辅助蒸馏萃取技术装置比较复杂,仪器的清洗比较费时;顶空吹扫捕集不利于挥发性低的化合物的捕集。而其中同时蒸馏萃取是近年来使用较多的一种提取、分离和富集试样中挥发性、半挥发性成分的有效方法,能将水蒸气蒸馏与溶剂萃取合二为一,从而减少了试验步骤,缩短了分析时间,节省了萃取溶剂[2]。而目前有关河豚鱼风味研究报道国内仅有邓捷春等[1]采用了顶空固相微萃取技术结合GC-MS对其挥发性成分进行了研究。所以本实验分别以二氯甲烷和乙醚作溶剂,采用同时蒸馏萃取法(SDE),提取养殖暗纹东方鲀肉中的挥发性成分,结合感官评价和电子鼻技术对提取的挥发性成分进行比较,采用气相色谱-质谱联用(GC-MS)对挥发性成分进行定性和内标定量分析,并采用主成分分析(PCA)对挥发性成分进行数据挖掘。旨在为探究河豚鱼美味奥秘及改善河豚鱼肉品质等方面提供有参考意义的基础理论数据。
1 材料与方法
1.1 实验材料
暗纹东方鲀:采自江苏省中洋集团河豚鱼养殖基地,2龄鱼,平均体重350g左右(12条),置于充水、充氧的聚乙烯袋中,运回实验室活杀。去眼、皮及内脏等废弃物后,鱼肉于-18℃贮藏待用。
1.2 主要试剂
无水Na2SO4(将分析纯Na2SO4在550℃下灼烧2 h,冷却后置于干燥器内备用);重蒸二氯甲烷、乙醚(将分析纯二氯甲烷、乙醚蒸馏,去掉前30 mL以及后30 mL的馏分,取中间二氯甲烷、乙醚馏分备用,重蒸后的二氯甲烷、乙醚经GC-MS检测无杂质峰出现);氯化钠(分析纯),以上试剂购自上海国药试剂公司。C7-C30饱和烷烃(1 000 μg/mL,溶于正己烷溶液中)购自美国 sigma公司,2,4,6-三甲基吡啶(纯度,99%)(内标)购自上海安谱科学仪器有限公司。
1.3 主要仪器与装置
同时蒸馏萃取装置(安徽优信玻璃仪器厂);Oldershow浓缩柱(浙江台州玻璃仪器厂);5975B型质谱和6890N型气相色谱(美国Agilent公司);DHT型搅拌调温电热套(山东鄄城创新仪器有限公司);恒温水浴锅(上海申生科技有限公司);DL-2020节能型低温冷却循环泵(宁波新芝生物科技股份有限公司);FOX4000电子鼻(阿法莫斯公司)。
1.4 样品处理
将贮于-18℃冰箱中的暗纹东方鲀肉在4℃冰箱中解冻12 h,然后将已解冻的鱼置冰上用刀取其背肉。将取下的肉置玻璃皿中,盖上玻璃皿盖,放在蒸锅中用电磁炉蒸20 min以保证鱼肉全熟。蒸好后迅速置于冰上冷却,再将冷却后的鱼肉绞碎备用。
1.5 同时蒸馏萃取(SDE)
取处理好的鱼肉样品150 g加250 mL去离子水,加入 50 μg 2,4,6-三甲基吡啶后,用匀浆机匀浆后置于1 000 mL圆底烧瓶中,加入沸石和磁力搅拌子,接SDE装置的右端,用电热套加热至微沸;装置的左端接100 mL圆底烧瓶,内装50 mL重蒸乙醚,恒温50℃水浴加热保持乙醚沸腾;用-5℃的乙醇作冷却循环液,萃取3h后在萃取液中加入5 g无水硫酸钠,放入-18℃冰箱内冷冻过夜;过滤,滤液用Oldershow柱浓缩至1 mL时,停止加热,静置使柱内的溶液滴下,总量约为3 mL,再转入带刻度试管中,用氮气吹至0.5 mL。由于乙醚的密度比水小,二氯甲烷的密度比水大,所以采用二氯甲烷为萃取溶剂时,SDE装置左右两端的搭建方式交换,将水浴温度设为55℃。其它操作程序不变。
1.6 GC-MS分析
色谱条件:色谱柱HP-INnowax,60 m×0.25 mm×0.25 μm毛细管柱,载气为He气,流量1 mL/min,进样量为2 μL,不分流进样。程序升温:柱初温40℃,保持5 min,以4℃/min升温至230℃,保持20 min;溶剂延迟3 min。
质谱条件:传输线温度 280℃,离子源温度230℃,四极杆温度150℃,电子能量70 eV;质量扫描范围30~400 m/z。
1.7 定性、定量方法
定性:实验数据处理由Xcalibur软件系统完成。挥发性成分通过NIST和Wiley谱库确认定性,仅报道匹配度大于80(最大值为100)的鉴定结果。采用相同的升温程序,以C7~C30的饱和烷烃作为标准,以保留时间计算样品测试中的化合物Kovats保留指数(Kovats retention indices,RI),并与文献值相比较,与数据库检索结果共同定性。


其中:S为所测挥发物峰面积与内标物2,4,6-三甲基吡啶峰面积的比值。
1.8 数据分析与统计检验
采用origin8.0、PAST1.79和R2.11.1软件对实验结果进行分析,根据不同方法得到的色谱总离子图中峰数量和相对含量判断不同方法的优劣。
其中:Rt(i)、Rt(n)、Rt(n+1)分别为待测挥发物、含n及n+1个碳原子的饱和烷烃保留时间。
定量:对于SDE提取的挥发性成分采用内标定量法计算相对含量。
2 结果与分析
2.1 养殖暗纹东方鲀肉中挥发性成分主体分析
采用GC-MS对两种溶剂的萃取液进行检测分析,得到相应的质谱总离子流图如图1所示。根据谱库检索结果和人工质谱解析等手段,鉴定出养殖暗纹东方鲀肉中的挥发性成分见表1。从鉴定出的挥发性成分测定结果可以看出,养殖暗纹东方鲀肌肉的主要挥发性成分为醛类、酮类、醇类、含氮含硫及杂环类、酯类、酸类和烷烃类。

图1 SDE法乙醚(1)、二氯甲烷(2)提取GC-MS总离子图叠图
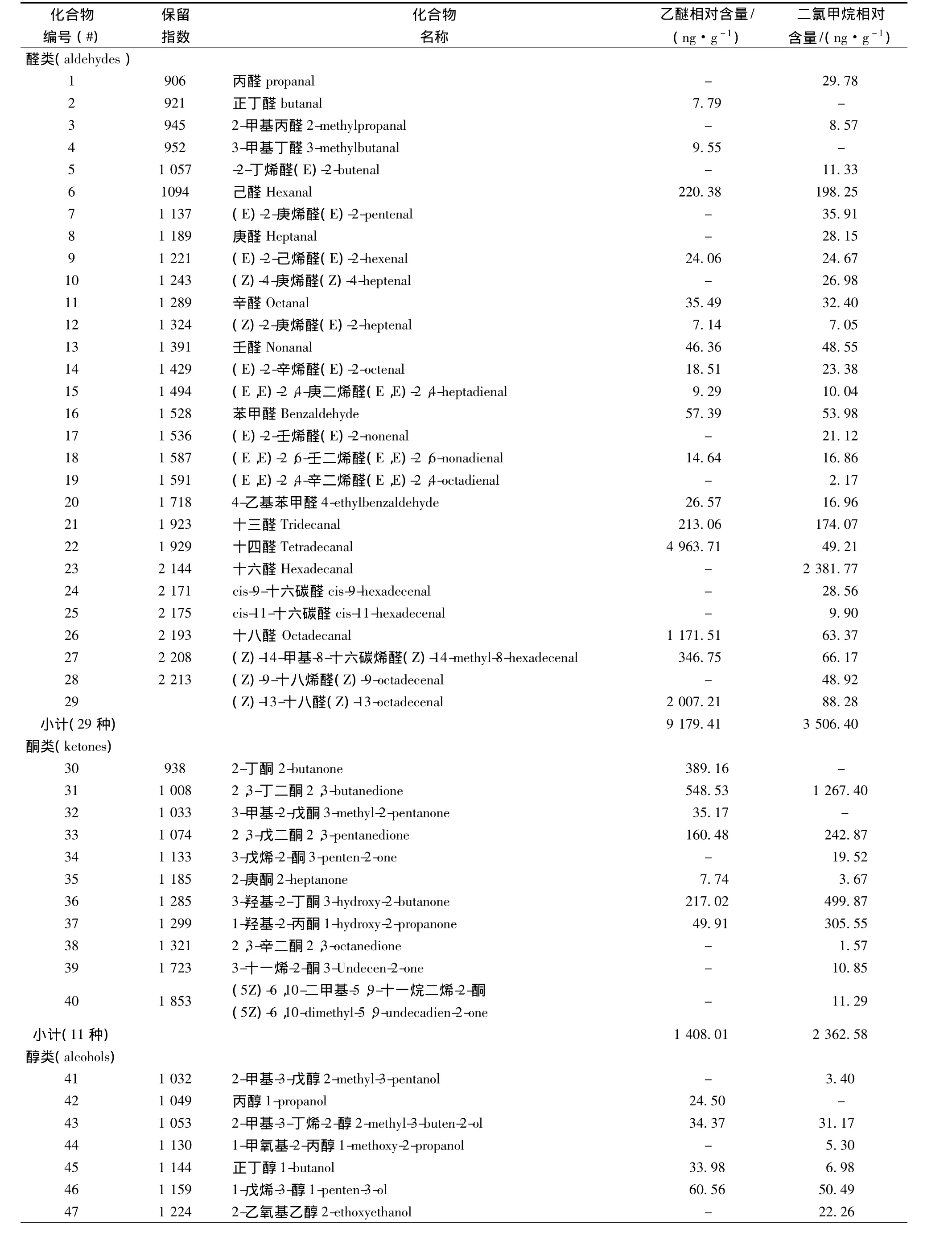
表1 养殖暗纹东方鲀肉中挥发性成分GC-MS分析结果

续表1

续表1
2种萃取液经GC-MS检测得到的挥发性成分种类数和相对含量见图2。
功能训练带捆绑技术是利用有弹性的训练带缠绕于患者肢体不同部位,起到改善患者运动控制能力的一种康复治疗方法[8]。本研究的功能性肌力训练带后拉法对帕金森病患者的平衡功能训练疗效的明显改善,BBS评分观察组的提升幅度明显大于常规训练组,观察组提升了约7分。TUGT测试观察组训练后的成绩提高业明显优于对照组,大大缩短了PD患者的步行时间,提高了约6s。从研究结果看单腿站立平衡测试观察组的训练效果也比对照组要明显,提升了2.4s的站立时间。

图2 养殖暗纹东方鲀肉中挥发性成分相对含量和种类数
从图2可以看出,从种类上看,二氯甲烷萃取液中,检测到的挥发性成分种类数(78种)多于乙醚萃取液(57种)。乙醚萃取液中除检测到的烷烃较二氯甲烷萃取液多1种外,其它化合物种类数都比二氯甲烷萃取液的要少。尤其是二氯甲烷萃取液中检测出的醛类物质比乙醚萃取液多10种,在二氯甲烷萃取液中检测出的可能对风味有贡献的物质,如(E)-2-庚烯醛、庚醛、(Z)-4-庚烯醛、(E)-2-壬烯醛等物质,在乙醚萃取液中均未检出。出现差异性的原因可能与2种溶剂的挥发性有关,乙醚的挥发性比二氯甲烷要强,在SDE提取过程中损失较多,尤其是在用oldershow和氮吹浓缩的过程中损失较多。所以检测出的化合物种类数少于二氯甲烷。从极性方面看,乙醚是弱极性溶剂,对非极性和弱极性微量成分萃取效果好;二氯甲烷是中等极性溶剂,萃取的极性成分更多[3]。另一方面,实验中采用的强极性毛细管柱(Wax),也利于极性物质的检出,因此,单从定性方面,二氯甲烷为溶剂萃取的效果较好。
从含量上看,乙醚萃取液中主要是醛类(9 179.41 ng/g)、酸类(4 729.69 ng/g)和酮类(1 408.01 ng/g);二氯甲烷萃取液中主要是醛类(3 506.4 ng/g)、酮类(2 362.58 ng/g)和含氮含硫及杂环类(811.48 ng/g)。乙醚萃取液中物质的相对含量明显高于二氯甲烷萃取液中的物质。可以看出,乙醚溶剂可能对某些低含量物质的提取有更好的效果。其中乙醚萃取液中含量较高的有十四醛(4 963.71 ng/g)、十八醛(1 171.51 ng/g)、(Z)-13-十八醛(2 007.21 ng/g)、乙酸乙酯(1 148.44 ng/g)、十六酸(4 639.90 ng/g)等;二氯甲烷萃取液中,含量较高的有十六醛(2 381.77 ng/g)、2,3-丁二酮(1 267.40 ng/g)、十六酸(545.08 ng/g)等。2种溶剂中含量最多的都是醛类,但乙醚萃取液中的醛类物质相对含量是二氯甲烷萃取液的近3倍,可以看出,醛类物质可能对养殖暗纹东方鲀肉风味有很大贡献。因此,单从定量方面乙醚溶剂萃取效果较好。
从以上分析可以看出,将2种溶剂结合起来有利于对养殖暗纹东方鲀肉中挥发性成分进行综合分析。
2.2 养殖暗纹东方鲀肉中挥发性成分分析
2种溶剂萃取一共检测出96种化合物,其中醛类29种、酮类11种、醇类16种、含氮含硫及杂环类化合物22种、酯类7种、酸类3种、烷烃类8种。
2.2.1 醛类
鱼肉中的醛类物质一般来源于不饱和脂肪酸中碳碳双键氧化后产生的氢过氧化物和甘油三酯自动氧化降解产物,阈值一般比较低,通常具有脂肪、奶油、草香以及清香等气味[4-7]。其中饱和醛类物质一般主要来自n-6或n-9的PUFA或MUFA的氧化降解[8]。尤其是C6~C12饱和醛类物质阈值一般较低,对风味贡献较大。如本试验种检测到的饱和醛有己醛、庚醛、辛醛、壬醛等,其中己醛被报道主要是来自于亚油酸的氧化,亚油酸在自动氧化作用下产生了亚油酸的13-氢过氧化物,13-氢过氧化物断裂生成己醛[9]。在适宜浓度下,己醛被感觉清香和草香味,浓度过大时,己醛具有不愉快的酸败味和刺激性辛辣味,此外壬醛被认为呈清香味,辛醛为生嫩的新香[10-11],壬醛则在浓度过大时表现出明显的动物油脂味[12]。也有报道醛类物质与 Maillard和 Strecker反应有着重要联系,在长时间的加热过程中,氨基酸的氨基与糖类物质的羰基发生反应生成了醛类物质[13]。如本试验中检测到的苯甲醛已经被鉴定是由氨基酸的Strecker反应生成的,被感觉具有令人愉快的杏仁香、坚果香和水果香[14]。本实验中除了检测到了大量阈值比较低的醛类物质外,还检测出了含量比较高的醛类物质,如十四醛(4 963.71 ng/g)、十六醛(2 381.77 ng/g)、十八醛(1 171.51 ng/g)、(Z)-13-十八醛(2 007.21 ng/g)等,这几种醛属于长链饱和醛类物质,一般具有较高的阈值,可能对风味的贡献较小。
2.2.2 酮类
酮类的阈值一般远远高于其同分异构体的醛类[15],对于鱼肉风味的贡献相对较小。酮类可能是由于不饱和脂肪酸的热氧化或降解产生[16-17]。也有文献报道,氨基酸的降解、Maillard反应和微生物氧化也是形成酮类物质的重要来源[18]。酮类一般被认为呈桉叶味、脂肪味和焦燃味,并且随着碳链的增长给出更强的花香特征。二酮类一般是Maillard反应最初阶段的产物,被感觉具有肉香和黄油香,在本次试验中检测到的有 2,3-丁二酮、2,3-戊二酮、2,3-辛二酮,其中检测到的2,3-丁二酮相对含量高达1 267.40 ng/g,曾被报道对奶油香气有贡献。烯酮类如3-戊烯-2-酮、3-甲基-2-丁酮等则被认为是在加热期间生成的脂质氧化产物且有一种青叶芳香[11]。另外酮类被报道对腥味物质有增强作用,可使腥味物质增强或改变。在本实验中酮类物质在总的挥发性物质中所占相对含量虽然不高,但可能对2种河豚鱼的特征风味有贡献。
醇类物质可能是由n-3和n-6不饱和脂肪酸二级氢过氧化物的降解产物[19]。饱和醇类一般是在加热过程中脂肪经氧化分解生成的或是有羰基化合物还原而生成,一般阈值较高,在浓度较高时可能对鱼肉的风味有贡献[20]。本次试验中检测的饱和醇有丙醇(24.50 ng/g)、丁醇(33.98 ng/g)、辛醇(11.55 ng/g)等,相对含量较低,此外检测到的2-乙基-1-己醇被报道具有蘑菇香气[21],可能对暗纹东方鲀的风味有贡献。不饱和醇类化合物的阈值通常比饱和醇类化合物高,它们对鱼类制品风味贡献一般较大[22]。如检测到的1-戊烯-3-醇具有鱼腥味,是构成美国红鱼肉的主要腥味成分[23]。1-辛烯-3-醇是亚油酸的氢过氧化物降解的产物,它呈类似于蘑菇和泥土的气味,普遍存在于淡水鱼和海水鱼的挥发性气味物质中[24]。
2.2.4 含氮、含硫及杂环化合物
含硫化合物主要来自于含硫的氨基酸如甲硫氨酸、半胱氨酸和胱氨酸,它们通过Strecker降解形成硫醇[25],如 2-乙基-1-己硫醇,能贡献给产品理想的芳香和不良的气味。含氮、含硫及杂环化合物的阈值一般很低,对鱼肉的整体风味贡献很大。据报道,三甲胺是一种强风味化合物,与鱼组织中的脂肪反应产生了鱼的特殊气味。呋喃类有一种强烈的、香脂的、甜的风味和似烟草的气味,如检测到了被报道有火腿香味的2-乙基呋喃主要是由亚油酸氧化而来[26]。2-戊基呋喃可能会对鱼腥味有一些影响。几种含苯化合物如1-甲基萘、2-甲基萘等会造成鱼肉中令人不愉快的风味,可能是从环境中转移到鱼体内的,说明鱼肉的风味也可能会受到环境污染物质的影响[27]。吡嗪类化合物是美拉德反应的产物,它们一般形成于食品的烹饪过程[28],因为SDE法控制的温度为微沸状态,所以本实验中检测到的吡嗪类物质很少,如2-甲基吡嗪通常是坚果香、烘烤香的特征物质[29]。含硫化合物通常对鱼肉的整体风味影响很大。本试验中检测到的2-乙酰基吡咯具有烤香和焦甜气,曾被报道是构成霉干菜的主体香气成分[30]。
2.2.5 酯类、酸类、烷烃类
酯类化合物是由羧酸和醇经酯化而成。一般而言,短链酸形成的酯如乙酸乙酯具有水果香味,本试验中检测到的乙酸乙酯含量高达1 148.44 ng/g。而长链酸形成的酯具有轻微的油脂味[11],检测到的有十六酸甲酯、邻苯二甲酸二异丁酯、邻苯二甲酸二丁酯等,故酯类对整体风味也做出了贡献。短链的挥发性酸如乙酸会产生非常强烈的令人不愉快的汗味,被认为是鱼油风味品质的重要标志[31]。各种烷烃(C6~C19)已经被鉴定存在于某些鱼肉的挥发物中,由于它们的阈值较高,因此烷烃对于食品整体的风味贡献很小[32]。本试验中检测到的酯类、酸类、烷烃类的化合物种类都较少,但乙醚溶剂中检测出的酸类含量很高,这可能是样品中的油脂被乙醚溶解导致的,也可能是在高温蒸煮过程中相应的醇、醛等化合物氧化而来的。
2.3 挥发性成分的PCA分析
以4个样本的面积百分含量和它们的平均值为特征值,数据标准化后用PAST软件进行PCA分析,得到图3。从图3中可以看出,二氯甲烷萃取液和乙醚萃取液各2个样本检测结果较分散,说明SDE法的重现性差,但二氯甲烷溶剂与总物质的距离近,比较接近总物质。

图3 养殖暗纹东方鲀肉中挥发性成分面积百分含量PCA分析图谱
以4个样本的峰面积为特征值,将数据标准化后用R软件进行PCA分析,得到载荷图4(a)和图4(b)。从图4(a)中可以看出,SDE法中二氯甲烷萃取液之间的距离较近,乙醚萃取液之间距离较远,说明二氯甲烷溶剂的重复性较好。图4(b)表示了96种挥发性成分的主成分分析结果:每个箭头对应某一种挥发物(不同颜色对应不同类挥发物)。将图4(a)和图4(b)比对后发现,若图4(b)中“箭头”和图4(a)中“样品点”在各自图中所处位置相近,则两者相关性较高。从将图4(b)中部分具有分类意义的组分可划分为2个区域。第一象限中对应的物质可能是乙醚萃取液中的主要挥发性成分;第二象限中对应的物质可能是二氯甲烷萃取液中的主要挥发性成分。从图4也可以看出2种溶剂检测到的挥发性成分,在组分和含量上具有一定差异,与GC-MS分析的结果基本相吻合。

图4 养殖暗纹东方鲀肉中96种挥发性成分PCA分析图谱
3 结论
本研究对SDE法中的萃取溶剂进行了选择,通过GC-MS分析,乙醚为溶剂时,总共鉴定到了57种成分,以二氯甲烷为溶剂时,总共鉴定到了78种成分。比较得出,二氯甲烷溶剂在定性方面有优势,乙醚溶剂在定量方面效果较好。2种溶剂萃取一共检测出96种化合物,其中醛类29种、酮类11种、醇类16种、含氮含硫及杂环类化合物22种、酯类7种、酸类3种、烷烃类8种。从PCA分析虽然可以初步确定暗纹东方鲀熟肉中的挥发性主体成分,但是还需要与感官分析结合进行分析,同时为了能更好的检测出养殖暗纹东方鲀中的挥发性成分,希望能与其它前处理方法结合起来共同鉴定。
[1]邓捷春,王锡昌,刘源.暗纹东方鲀与红鳍东方鲀气味成分差异研究[J].食品科学,2009,30(22):335-339.
[2]李桂花,何巧红,杨君.一种提取复杂物质中易挥发组分的有效方法一同时蒸馏萃取及其应用[J].理化检验:化学分册,2009,45(4):491 -496.
[3]练顺才,谢正敏,叶华夏,等.粮食香气成分分析方法的研究[J].酿酒科技,2011,206(8):31-35.
[4]Xie J,Sun B,Zheng F,et al.Volatile flavor constituents in roasted pork of Mini-pig[J].Food chemistry,2008,109(3):506-514.
[5]Shahidi F,Botta J R.Seafoods:chemistry,processing technology and quality[M].Blackie Academic& Professional,1994.
[6]Min D B,Lee H O.Chemistry of lipid oxidation[J].Flavor chemistry:thirty years of progress,Klumewer Academic/Plenum Publishers,New York,1999:175-189.
[7]Farmer L J,Mcconnell J M,Graham W D.Flavor characteristics and lipid composition of Atlantic salmon[C].ACS Publications,1997.
[8]刘敬科.鲢鱼风味特征及热历史对鲢鱼风味的影响[D].武汉华中农业大学,2009.
[9]Ho C T,Zhang Y,Shi H,et al.Flavor chemistry of Chinese foods[J].Food Reviews International,1989,5(3):253-287.
[10]Toldrá F,Flores M.The role of muscle proteases and lipases in flavor development during the processing of drycured ham[J].Critical Reviews in Food Science,1998,38(4):331-352.
[11]沙希迪,李洁,食品加工,等.肉制品与水产品的风味[M].北京:中国轻工业出版社,2001.
[12]Toldra F.Proteolysis and lipolysis in flavour development of dry-cured meat products[J].Meat Science,1998,49:101-110.
[13]Varlet V,Prost C,Serot T.Volatile aldehydes in smoked fish:Analysis methods,occurence and mechanisms of formation[J].Food Chemistry.2007,105(4):1 536 -1 556.
[14]Mason M E,Johnson B,Hamming M C.Volatile components of roasted peanuts.Major monocarbonyls and some noncarbonyl components[J].Journal of Agricultural and Food Chemistry,1967,15(1):66-73.
[15]Siek T J,Albin I A,Sather L A,et al.Comparison of flavor thresholds of aliphatic lactones with those of fatty acids,esters,aldehydes,alcohols,and ketones[1]and[2][J].Journal of Dairy Science,1971,54(1):1 -4.
[16]Kumazawa Y,Seguro K,Takamura M,et al.Formation of ε ‐(γ ‐ glutamyl)lysine cross-link in cured horse mackerel meat induced by drying[J].Journal of Food Science,1993,58(5):1 062-1 064.
[17]Cha Y J,Cadwallader K R,Baek H H.Volatile flavor components in snow crab cooker effluent and effluent concentrate[J].Journal of Food Science,1993,58(3):525-530.
[18]Chung H Y,Yung I K S,Ma W C J,et al.Analysis of volatile components in frozen and dried scallops(Patinopecten yessoensis)by gas chromatography/mass spectrometry[J].Food Research International,2002,35(1):43-53.
[19]Kawai T,Sakaguchi D M.Fish flavor[J].Critical Reviews in Food Science& Nutrition,1996,36(3):257-298.
[20]Wurzenberger M,Grosch W.Stereochemistry of the cleavage of the 10-hydroperoxide isomer of linoleic acid to 1-octen-3-ol by a hydroperoxide lyase from mushrooms(Psalliota bispora)[J].Biochimica et Biophysica Acta(BBA)-Lipids and Lipid Metabolism,1984,795(1):163-165.
[21]孙宝国刘玉平.食用香料手册[M].北京:中国石化出版社,2004.
[22]M.Wurzenberger W G.Enzymic oxidation of linolei c acid to 1,Z-5-Octadien-3-ol,Z-2,Z-5-octadien-1ol and 10-oxo-E-8-decenoic acid by a protein fraction from mushrooms(Psalliota bispora)[J].Lipids,1986,21:261-266.
[23]王怡娟,娄永江,陈梨柯.养殖美国红鱼鱼肉中挥发性成分的研究[J].水产科学,2009(6):303-307.
[24]Josephson D B,Lindsay R C,Stuiber D A.Identification of compounds characterizing the aroma of fresh whitefish(Coregonus clupeaformis)[J].Journal of Agricultural and Food Chemistry,1983,31(2):326-330.
[25]Shahidi F,Rubin L J,D'Souza L A,et al.Meat flavor volatiles:A review of the composition,techniques of analysis,and sensory evaluation[J].Critical Reviews in Food Science& Nutrition,1986,24(2):141-243.
[26]Toldrá F,Flores M.The role of muscle proteases and lipases in flavor development during the processing of drycured ham[J].Flavor of meat,Meat Products and Seafood.,1998,38(4):331-352.
[27]施文正,王锡昌,陶宁萍,等.野生草鱼与养殖草鱼的挥发性成分[J].江苏农业学报,2011,27(001):177-182.
[28]田怀香,王璋,许时婴.GC-O法鉴别金华火腿中的风味活性物质[J].食品与发酵工业,2004,30(12):117-123.
[29]Maga J A,Sizer C E.Pyrazines in foods[J].Journal of Agricultural and Food Chemistry,1973,21(1):22 -30.
[30]刘玉平,杨俊凯,孙宝国,等.同时蒸馏萃取-气质联用分析绍兴霉干菜中挥发性香气成分[J].水利渔业,2009,30(18):347-350.
[31]莫意平,娄永江,薛长湖.水产品风味研究综述[J].食品科学,2005,25(001):82-84.
[32]Josephson D B,Lindsay R C,Stuiber D A.Enzymic hydroperoxide initiated effects in fresh fish[J].Journal of Food Science,1987,52(3):596 -600.
