1株源自如皋火腿的产谷氨酰胺酶腐生葡萄球菌RG-2催化条件的优化*
2012-11-21于海王敏李梦璐葛庆丰吴满刚汪志君
于海,王敏,李梦璐,葛庆丰,吴满刚,汪志君
(扬州大学食品科学与工程学院,江苏扬州,225127)
谷氨酰胺酶(EC 3.5.1.2)存在于很多细菌和真核微生物中[1],是谷氨酰胺分解的关键酶和限速酶[2-3]。含氮有机物如蛋白质等经过蛋白酶及肽酶的催化降解作用形成一些小分子的含氮化合物如谷氨酰胺等[4],而谷氨酰胺酶则可继续催化水解谷氨酰胺等生成谷氨酸和NH4+[5],在谷氨酸形成过程中起着重要作用[4],而谷氨酸与火腿等发酵肉制品的鲜味形成有关[6-8]。
火腿是我国历史悠久的肉制品之一,深受消费者喜爱。火腿的成熟过程主要由内源酶、微生物外源酶以及其他非酶促理化反应而共同形成[9],其中微生物外源酶中谷氨酰胺酶在肉制品中具有明显的增鲜作用。M-Asunción Durá等人将产谷氨酰胺酶菌株作为发酵剂或谷氨酰胺酶加入到香肠中,可明显地改善香肠的感官和品质[10]。此外,谷氨酰胺酶催化形成的氨还可以减少发酵肉制品中乳酸等酸类物质的含量,降低产品的酸度,改善口感[11-12]。
腐生葡萄球菌作为发酵剂已经应用于发酵里脊肉、发酵鸭肉香肠等发酵肉制品的加工工艺中,而且研究人员对腐生葡萄球菌对发酵肉制品脂质分解氧化规律以及脂质氧化产物对风味特性的影响也进行研究[13-14]。但与发酵肉制品鲜味形成有关的谷氨酰胺酶催化条件的研究还不够深入,因此本文利用从如皋火腿中分离得到的1株腐生葡萄球菌RG-2,通过单因素试验及响应面设计方法分析其谷氨酰胺酶的特性,从而为利用腐生葡萄球菌开发肉品发酵剂提供理论依据。
1 材料与方法
1.1 材料
腐生葡萄球菌(Staphylococcus saprophyticus)RG-2,由实验室筛选保藏。
L-谷氨酰胺,购自上海生工生物有限公司;L-谷氨酸,购自上海蓝季科技公司;其它试剂均为分析纯。
1.2 方法
1.2.1 培养基
牛肉膏蛋白胨培养基和MSA培养基的配制方法参照文献[15]进行。
1.2.2 粗酶液的制备
将腐生葡萄球菌RG-2接种至MSA液体培养基,37℃培养16 h后,以1%接种量接至牛肉膏蛋白胨液体培养基中,37℃,150 r/min摇床培养60 h,调菌密度至 1010CFU/mL,之后取此菌液 2 mL,4℃、8 000×g离心15 min,沉淀用pH 6.0的TE缓冲液(50 mmol Tris-HCl、5 mmol EDTA)洗涤 2 次,弃去上清液后再次加入2 mL pH 6.0的TE缓冲液后,在37℃保温条件下用溶菌酶处理3 h后用超声波细胞破碎仪破碎,破碎条件:400 W,超声5 s间隔5 s,120次。细胞破碎液4℃、8 000×g离心10 min,取上清液备用。
1.2.3 谷氨酰胺酶的测定
采用纳氏试剂法绘制铵标液标准曲线。
取1 mL粗酶液,加入pH6.0的1%谷氨酰胺溶液8 mL,再加入pH6.0磷酸氢二钠-柠檬酸缓冲液2 mL,37℃保温1 h,纳氏试剂法测氨浓度。
酶活力定义:在37℃,pH 6.0条件下每小时催化谷氨酰胺产生1 μmol NH3定义为1个酶活力单位。
1.3 谷氨酰胺酶催化条件的单因素试验
固定催化温度、pH、NaCl浓度3因素中的2个因素,按照表1设计改变其中一个因素,以谷氨酰胺酶酶活为响应值,进行单因素试验。

表1 单因素试验设计表
1.4 谷氨酰胺酶催化条件的响应曲面设计
1.4.1 Box-Behnken 试验设计
根据Box-Behnken设计原理,以不同条件下的谷氨酰胺酶酶活为响应值,选取温度、pH、NaCl浓度为影响因素,进行3因素3水平分析,共17个试验点,其中5个为中心点。
1.4.2 数据处理
响应曲面实验数据采用Design Expert 8.0软件对响应值进行多元回归分析,建立回归方程。对回归模型结合三维响应面图和等高线图,判断是否存在稳定点,据此得出最大酶活的主效因子条件,建立优化的催化条件并建立模型进行验证。
2 结果与讨论
2.1 菌株粗酶酶活的测定
采用牛肉膏蛋白胨液体培养基,37℃ 150 r/min摇床培养60h后,菌株RG-2的粗酶液酶活约为13.7 U/mL。谷氨酰胺酶的催化产物谷氨酸是肉制品鲜味的主要组成物质或风味前体物质,较高的谷氨酰胺酶酶活表明该菌株能产生足量的谷氨酸以保证肉制品较好的鲜味。
2.2 谷氨酰胺酶催化条件的单因素试验
2.2.1 pH对谷氨酰胺酶酶活的影响
催化体系为37℃,不添加NaCl,改变反应体系pH进行单因素试验,酶活结果如图1所示,在pH 4.2~4.8范围内,腐生葡萄球菌RG-2所产谷氨酰胺酶活力随pH值增大略有上升,但酶活较低;在pH 5.4~6.6范围内酶活随pH增大快速上升,并在pH 6.6 时达到最大值,为 18 U/mL,在 pH 6.6~7.8 范围内酶活随pH增大快速下降。

图1 pH值对菌株RG-2谷氨酰胺酶酶活的影响
据文献报道,源于微生物的谷氨酰胺酶最适pH大约为 7~8[6,11],而 Durá 分离的 1 株德巴利汉逊氏酵母所产谷氨酰胺酶最适pH约为8.5[11]。本文所用的菌株RG-2所产谷氨酰胺酶的最适pH约为6.6,低于文献已报道的微生物源谷氨酰胺酶的最适pH,这可能与菌种所产酶特性有关,如韩铭海等[16]通过筛选得到的1株高产谷氨酰胺酶的菌株,为柠檬酸细菌属,其最适pH为6.2。
2.2.2 温度对谷氨酰胺酶酶活的影响
催化体系 pH值为6.0,不添加 NaCl,改变反应体系反应温度并进行单因素试验,酶活结果如图2所示,腐生葡萄球菌RG-2谷氨酰胺酶活在32~37℃范围内随温度升高快速增加,当温度达到42℃时达到最大值,并且在42~47℃范围内均具有较高的催化活力。52~57℃时,酶因高温而失活,酶活下降,该腐生葡萄球菌RG-2谷氨酰胺酶的最适温度为42~47℃,42℃时酶活达到22 U/mL。

图2 温度对菌株RG-2谷氨酰胺酶酶活的影响
温度对谷氨酰胺酶酶活性的影响较大。多数已报道的谷氨酰胺酶在37~45℃的温度范围最活跃[11,16-17],而 Alexandra 等筛选得的1 株 Lactobacillus rhamnosus所产的谷氨酰胺酶的最适温度在50℃[4]。本研究的菌株所产谷氨酰胺酶最适温度可能为42~47℃,最高催化温度范围相对较大,属于中温酶范畴。
2.2.3 NaCl浓度对谷氨酰胺酶酶活的影响
根据以上单因素试验,催化体系pH 6.6,反应温度42℃,改变反应体系NaCl浓度进行单因素试验,酶活结果如图3所示:当NaCl浓度低于2.0%时,NaCl对谷氨酰胺酶酶活无明显影响,当盐浓度2.0%~3.0%时,NaCl对谷氨酰胺酶催化活力具有促进作用,当盐浓度超过3.0%,NaCl表现出对谷氨酰胺酶活力有抑制作用。由此可知,在该单因素试验中,当盐浓度达到3.0%时,谷氨酰胺酶酶活达到最大值33 U/mL。

图3 NaCl浓度对菌株RG-2谷氨酰胺酶酶活的影响
NaCl浓度对于谷氨酰胺酶的影响依菌种不同差异较大。Jeong-Min Jeon等[17]筛选得到的菌株L.reuteri KCTC3594所产的谷氨酰胺酶最适NaCl浓度为5%,而Alexandra等筛选得的1株Lactobacillus rhamnosus所产的谷氨酰胺酶的最适最适NaCl浓度只有2.5%[4]。因为火腿等发酵肉制品具有一定的盐含量,所以研究NaCl浓度对于谷氨酰胺酶催化活力的影响具有重要的意义。
2.3 响应面设计
运用Design expert8.0中的Box-Behnken进行试验设计如表2所示。

表2 Box-Behnken试验设计
2.3.1 Box-Behnken 试验结果
响应曲面法的试验设计及结果见表3。Design expert8.0软件分析谷氨酰胺酶酶活回归模型的显著性,方差分析见表4。由表4可知:模型的 F值为731.29,P <0.000 1,表明该回归模型极显著。失拟项的 P=0.085 0>0.05,说明失拟项不显著,该模型有较好的拟合度。根据回归系数,可得二次多项回归方程:
Y=40.26+3.03A+2.76B+0.59C+3.50AB+1.55AC+0.68BC-10.74A2-16.77B2-4.12C2,其中 R2=0.998 9。
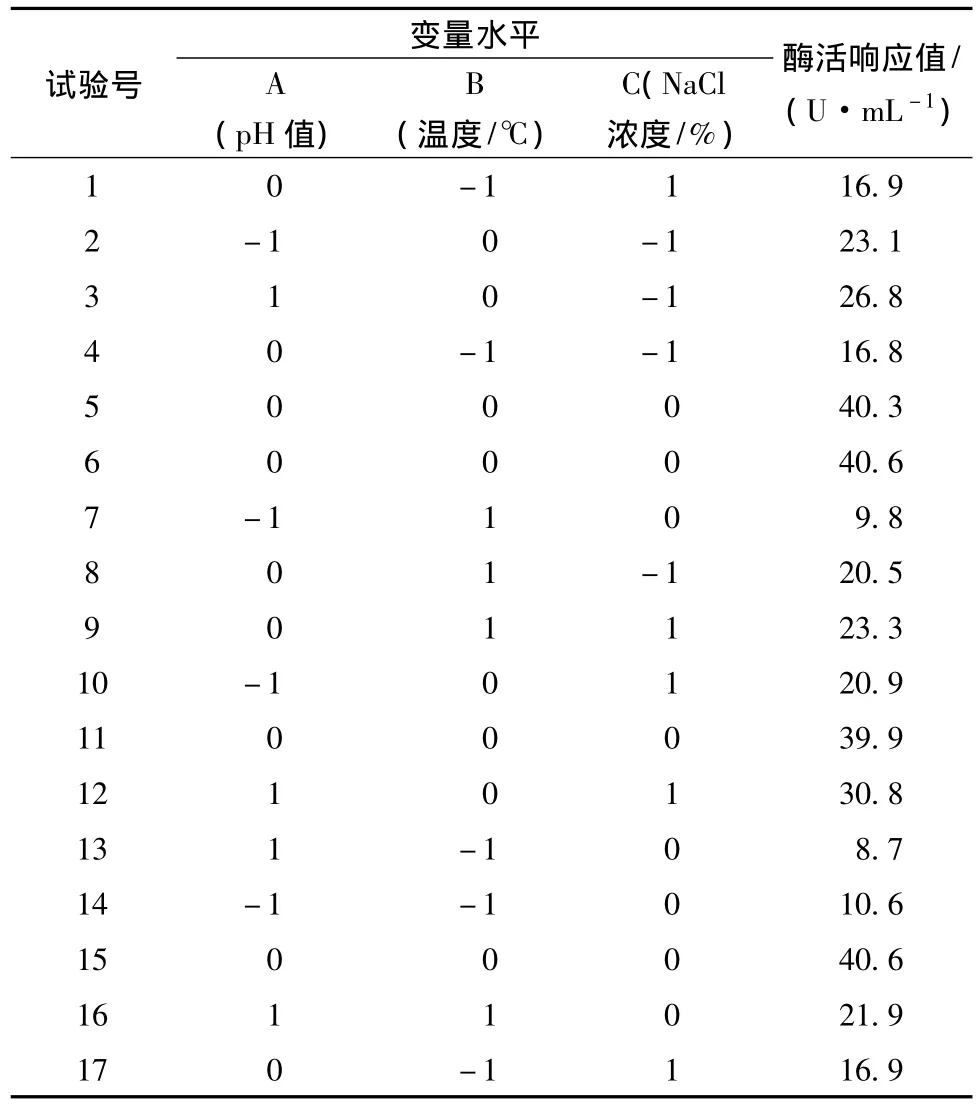
表3 响应曲面法优化催化条件与响应值

表4 方差分析表
2.3.2 响应曲面分析与条件优化
各因素间交互作用的响应曲面如图4所示。

图4 各因素交互影响谷氨酰胺酶酶活的响应曲面和等高线图
由图4可知,AB、AC、BC交互作用均很显著,失拟项不显著(P>0.05)。由图4a可知,pH(A)与温度(B)交互作用极显著(P<0.01)且F值较大,因素作用效果明显;由图4b可知,pH(A)与NaCl浓度(C)交互作用极显著(P=0.000 9<0.01)且 F值较大,因素作用效果明显,但相对A-B较低;由图4c可知,温度(B)与NaCl浓度(C)交互作用显著(0.01<P<0.05),因素作用效果相对较差,但仍处于合理范围之内;综合以上结论并由曲面的弯曲程度和等高线可以看出,响应值的变化相当复杂,各个具体的试验因素对响应值的影响不是简单的线性关系,而是二次关系。模型优化的最佳催化条件为:pH 6.702、温度42.5℃、NaCl浓度为3.055%。采用优化的条件对催化条件进行模型验证,为操作方便,验证实验条件设为 pH 6.7、温度43℃、NaCl浓度为3.1%。结果表明,此条件下测得的谷氨酰胺酶酶活为40.2 U/mL,与模型估计值40.683 4 U/mL相比,相对误差为1.19%,说明采用响应曲面法优化得到的催化条件参数准确可靠,利用本试验建立的模型在实践中进行预测是可行的。
3 结语
RG-2菌株所产谷氨酰胺酶的最佳催化体系为:pH6.7、温度 43 ℃、NaCl浓度为 3.1%。此时,谷氨酰胺酶的催化效率最高,达到40.2 U/mL,为预测值的98.8%。模型验证实验表明此模型具有较好的预测能力。谷氨酰胺酶在酱油酿造工业中早有应用,并且研究较为深入,但对谷氨酰胺酶在肉制品中的应用及研究还较少。鲜味是发酵肉制品不可或缺的优良品质之一,对滋味贡献极大。研究成果对于该菌株及其所产谷氨酰胺酶在如皋火腿及其它发酵肉制品中的应用具有重要的理论指导价值,为最佳发酵条件的确立提供参考依据。
[1]Imada A,Igarasi S,Nakahama K,et al.Asparaginase and glutaminase activities of micro-organisms[J].Journal of General Microbiology,1973,76(1):85-99.
[2]Tomita K,Yano T,Kumagai H,et al.Formation of γ-glutamylglycylglycine by extracellular glutaminase of Aspergillus oryzae[J].Journal of Fermentation Technology,1988,66(3):299-304.
[3]Medina M Á.Glutamine and cancer[J].The Journal of Nutrition,2001,131(9):2 539S-2 542S.
[4]Alexandra Weingand-Ziadé,Christiane Gerber-Décombaz,Michael Affolter.Functional characterization of a salt-and thermotolerant glutaminase from Lactobacillus rhamnosus[J].Enzyme and Microbial Technology,2003,32(7):862-867.
[5]Nandakumar R,Yoshimune K,Wakayama M,et al.Microbial glutaminase:biochemistry,molecular approaches and applications in the food industry[J].Journal of Molecular Catalysis B:Enzymatic,2003,23(9):87-100.
[6]Löliger J.Function and importance of glutamate for savory foods[J].the Journal of Nutrition,2000,130(4):915S-920S.
[7]Yamaguchi S.Umami:a basic taste.physiology,biochemistry,nutrition,food science[M].New York:Marcel Dekker,1987:41-73.
[8]Chaudhari N,Landin AM,Roper SD.A metabotropic glutamate receptor variant functions as a taste receptor[J].Nature Neuroscience,2000,3(2):113-119.
[9]Dainty R,Blom H.Fermented meats[M].Glasgow:Blackie Academic & Professional,1995:176-193.
[10]M-Asunción Durá,Mónica Flores,Fidel Toldrá.Effects of curing agents and the stability of a glutaminase from Debaryomyces spp.[J].Food Chemistry,2004,86(3):385-389.
[11]Durá M A,Flores M,Toldrá F.Purification and characterisation of a glutaminase from Debaryomyces spp.[J].International Journal of Food Microbiology,2002,76(1-2):117-126.
[12]Miteva E,Kirova E,Gadjeva D,et al.Sensory aroma and taste profiles of raw-dried sausages manufactured with a lipolytically active yeast culture [J].Food/Nahrung,1986,30(8):829-832.
[13]李想,邓锋,秦春君,等.腐生葡萄球菌CGMCC 3475对发酵里脊猪肉脂质分解氧化及风味特性的影响[J].食品与发酵工业,2011,37(1):152-156.
[14]于海,秦春君,郦晨,等.腐生葡萄球菌发酵鸭肉香肠工艺研究[J].食品科学,2010,31(17):277-280.
[15]沈萍,范秀容,李广武主编.微生物学实验[M].北京:高等教育出版社,1999:214-222.
[16]韩铭海,赵娟娟,华盛龙,等.一株高产谷氨酰胺酶菌株的鉴定和酶活特性的研究[J].大豆科学,2008,27(6):1 037-1 040.
[17]Jeong-Min Jeon,Hae-In Lee,Jae-Seong So.Glutaminase activity of Lactobacillus reuteri KCTC3594 and expression of the activity in other Lactobacillus spp.by introduction of the glutaminase gene[J].African Journal of Microbiology Research,2009,3(10):605-609.
