UrotensinⅡ对大鼠心脏效应的作用机制探讨
2012-11-21韩清华刘文媛李晨娟王睿史宏涛
韩清华 刘文媛 李晨娟 王睿 史宏涛
UrotensinⅡ(尾加压素Ⅱ,UⅡ)是最初从硬骨鱼尾部的下垂体中被提取出的一种生长抑素样多肽[1],主要分布于心血管及神经系统[2,3],它的缩血管效应是内皮素的 8~10倍[4]。Ames等[5]的研究发现,人体内的孤儿受体 G 蛋白偶联受体14(G-protein coupled receptor 14,GPR14,UT)是 UⅡ的特异性受体。UⅡ与UT结合后,可产生多种生物学效应,如促进内皮细胞、血管平滑肌细胞、心肌纤维细胞的增殖、强烈的收缩血管作用及心脏抑制等心血管效应。其作用途径很多,可能有钙(Ca2+)、磷脂酶、酪氨酸激酶、RhoA等因子参与[6],但具体通过哪条信号转导通路发挥效应尚不清楚。本研究利用全细胞膜片钳技术,观察UⅡ对大鼠心肌细胞L-型钙电流的影响,并选用特异性 PKA拮抗剂-KT5720,研究KT5720对UⅡ作用的阻断效应,进而阐明UⅡ作用于大鼠心脏效应的可能电生理机制及信号转导通路。
1 材料与方法
1.1 材料 Wistar大鼠,♂,体重200~250 g,由山西医科大学实验动物中心提供。主要试剂:UrotensinⅡ(human)与KT5720购自英国TOCRIS公司;牛磺酸(taurine)、L-谷氨酸(L-glutamic acid)、乙二醇四乙酸(EGTA)、HEPES(hydroxyethyl piperazine ethanesulfonic acid)均购自美国Sigma公司;胶原酶P(Collagenase P)购自德国Bochringer Mannhein公司;其余试剂均为国产分析纯试剂。
1.2 单个心室肌细胞的急性分离 取大鼠击头致昏,迅速剪断颈部放血,开胸取出心肺,立即置于0℃氧饱和的无钙台式液中修剪,然后将心脏挂在Langendorff灌流装置上经主动脉逆行灌流,流速2 ml/min。先用无钙台式液灌流7~8 min,再用酶液循环灌流15~20 min。灌流过程中保持37℃恒温,灌流压为70 cmH2O,并持续通以100%氧气。待心脏组织变大、变软后将左心室肌组织剪下来,置于KB液中轻柔吹打,得到分散的心室肌细胞,经150 μm孔径的滤网过滤后保存于KB液中,室温下稳定1 h后,放入4℃冰箱静置2 h备用。
1.3 全细胞膜片钳记录 实验前先将存放于KB液中的心室肌细胞复钙,复钙终浓度为1.8 mmol/L。吸取适量细胞悬液滴加于灌流槽中,放置5~10 min使细胞牢固贴壁后,用细胞外灌流液以1~2 ml/min匀速灌流,使细胞逐渐复钙,10~20 min后,于倒置相差显微镜下选择贴壁牢固、无跳动、横纹清晰、折光性好、立体感强的细胞进行实验。玻璃微电极由PP-83型二步拉制仪(Narishige Co,Japan)拉制而成,充灌电极内液后,电极电阻为2~5 mΩ。用微电极操纵器(Narishige Co,Japan)将电极推向细胞,负压吸引形成高阻封接,电击破细胞膜,补偿电容电流和串联电阻,形成全细胞记录模式记录ICa-L。细胞破膜后5 min开始记录Ica-L,电流值以电流密度(pA/pF)表示。以上记录均在室温下进行。信号经Axopatch-200B膜片钳放大器放大、Digidate 1322A模数转换器转换,通过pClamp8.2软件进行数据采集、储存及分析。
L-型钙电流记录:在全细胞模式下,用TEA-Cl、CsCl阻断电压依赖性的Ik,从钳制电位-40 mV开始,以10 mV步阶逐步去极化至+50 mV,电压刺激时程为300 ms,刺激频率为0.1 Hz激活Ica-L。心肌细胞分离及全细胞电流记录方法参照文献。
1.4 溶液组成 台氏液(mmol/L):KCl 5.4;NaH2PO40.33;HEPES 5.0;Glucose 10.0;MgCl21.0;NaCl 140;CaCl21.8;用NaOH调pH值到7.35~7.40。无钙台氏液:去除钙离子的台式液。酶液(mmol/L):KCl5.4;NaH2PO40.33;HEPES 5.0;Glucose 10.0;MgCl21.0;NaCl 125;Taurine 20.0;CaCl275 μmol/L;胶原酶P 5~7 mg。KB液(mmol/L):L-谷氨酸50.0;KCl 30.0;牛磺酸20.0;KH2PO430.0;HEPES 10.0;Glucose 10.0;MgCl21.0;EGTA 0.5;用KOH调pH值到7.35~7.40。
L-型钙电流(Ica-L)的电极内液(mmol/L):KCl 150;HEPES 5.0;EGTA 5.0;K2ATP 3.0;MgCl21.0;4-AP 5.0;MgATP 1.0,;用KOH调pH值到7.3。细胞外灌流液为台式液。
1.5 统计学处理 原始数据经Clampfit处理。实验数据以均数±标准差()表示。两样本均数间比较用t检验,多个样本均数间比较用方差分析。P<0.05认为差异有统计学意义。
2 结果
2.1 UⅡ对大鼠心肌细胞Ica-L的影响
2.1.1 不同浓度的UⅡ对大鼠心肌细胞Ica-L的影响 10-9~10-5mol/L UⅡ灌流5 min后,UⅡ呈浓度依赖性的抑制大鼠心肌细胞Ica-L,10-6和10-5mol/L UⅡ的下降率明显大于对照组(P<0.01,n=10)(图1)。

图1 10-9~10-5mol/L UⅡ灌流后,UⅡ呈浓度依赖性的抑制大鼠心肌细胞Ica-L
2.1.2 不同浓度UⅡ对大鼠心肌细胞L-型钙电流密度的影响(表1,图2)
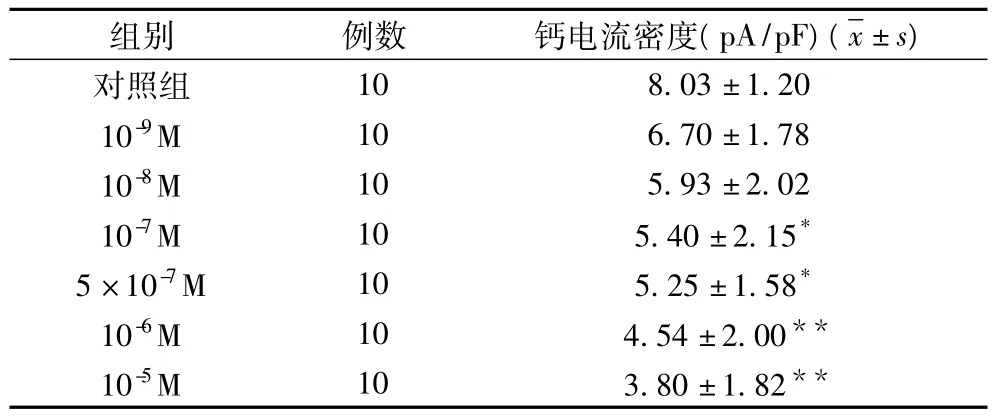
表1 不同浓度UⅡ对大鼠心肌细胞L-型钙电流密度的影响
2.2 KT5720对UⅡ作用于大鼠心肌细胞Ica-L的影响(图2)。

图2 灌流KT-5720基础上给予UⅡIca-L变化不明显
3 讨论
UⅡ是迄今为止发现的收缩血管活性最强的物质,可引起心功能抑制、心肌收缩力减弱等心血管效应。因此,UII对心血管系统的效应仍是当今研究的热点。本课题组在前期研究中,利用Langendorff离体大鼠心脏模型,用不同浓度的UⅡ(10-9、10-8、10-7、10-6mol/L)依次灌注正常大鼠心脏,±dp/dtmax抑制率随浓度增加而增大,呈剂量依赖性抑制作用。
为进一步探讨UⅡ作用于心脏的电生理机制,本研究采用全细胞膜片钳技术,观察到UⅡ呈浓度依赖性的抑制大鼠左心室心肌细胞Ica-L。正常状态下心室肌细胞L-型钙通道开放,细胞外Ca2+内流,通过细胞内Ca2+诱导的钙释放机制引起钙池释放钙,从而使胞浆内Ca2+水平升高,引起心肌收缩。在本实验中我们观察到UⅡ能减弱心肌细胞L-型钙电流强度,抑制细胞外钙离子内流,进而降低细胞内Ca2+浓度,从而抑制心肌收缩。因此我们推测UⅡ对心功能的抑制作用是与抑制钙电流有关。
目前研究显示UⅡ与其受体结合后的作用途径很多,可能有钙(Ca2+)、磷脂酶A2(PLA2)、磷脂酶C(PLC)、肌球蛋白轻链激酶(MLCK)、磷酸肌醇、酪氨酸激酶、小型的 GTP酶RhoA及效应器Rho激酶-RhoK等因子参与,但具体通过哪条途径发挥效应尚有争议,因此UⅡ对心血管系统的作用转导机制尚不清楚。本研究选用特异性PKA拮抗剂-KT5720,在单个心肌细胞L-型钙电流的记录中,观察到在灌流KT-5720基础上给予UⅡ,L-型钙电流密度峰值变化不明显,表明KT-5720可阻断UⅡ对钙电流的抑制作用。由此我们推测,UrotensinⅡ可能通过PKA途径抑制心肌细胞L-型钙电流而发挥其心功能抑制作用。
UⅡ作为收缩血管活性最强的物质,目前已成为心血管疾病治疗的潜在的靶点。但是UⅡ作用非常广泛而且复杂,其生物学作用还有待于进一步的研究。
[1]David P.Johne S,Brianr C.et al.Urotensin Ⅱ:A somatostatinlike peptide in the caudal neurosecretory system of fishes.Proc Natl Acad Sci,1980,77(8):5021.
[2]Zhu Y C,Zhu Y Z,Moore P K.The role of urotensin II in cardiovascular and renal physiology and diseases.Br J Pharmacol,2006,148(7):884-901.
[3]Zhu X M,Du G H.Progress in the study of biological activities of urotensinⅡ.Chin Pharmacol Bull,2006,22(6):651-4.
[4]Tasaki K,Hori M,Ozaki H,Karaki H,Wakabayashi I.Mechanism of human urotensin II-induced contraction in rat aorta.J Pharmacol Sci,2004,94(4):376-83.
[5]Ames RS,Sarau HM,Chambers JK,et al.Human urotensinⅡis a potent vasoconstrictor and agonist for the orphan receptor GPR14.Nature,1999,402(6764):898-903.
[6]Maguire J J,Davenport A P.Is urotensin-Ⅱ the new endothelin?.Br J Pharmacol,2002,137(5):579-588.
[7]Yazawa K,Kaibara M,Ohara M,et al.An improved method for isol-ating cardiac myocytes useful for pathch-clamp studies.Jpn J Physiol,1990,40:157-163.
