间尼索地平微孔渗透泵微丸的制备及释药机制研究Δ
2012-11-21王伟张晶齐晓丹河北医科大学药学院药剂学教研室石家庄050017
王伟,张晶,齐晓丹(河北医科大学药学院药剂学教研室,石家庄050017)
间尼索地平微孔渗透泵微丸的制备及释药机制研究Δ
王伟*,张晶,齐晓丹#(河北医科大学药学院药剂学教研室,石家庄050017)
目的:制备间尼索地平微孔渗透泵微丸,并探讨其释药机制。方法:以磺丁基醚-β-环糊精(SBE-β-CD)为渗透压物质,采用挤出滚圆法制备丸芯,流化床包衣法包衣;以累积释放度为指标,通过单因素法考察增塑剂癸二酸二丁酯(DBS)用量、包衣增重、包衣液(醋酸纤维素的丙酮-异丙醇溶液)浓度对微丸释放的影响,优选包衣处方。按最优处方制备3批微丸并以累积释放度与时间进行零级、一级、Higuchi方程拟合来考察其释药特征。结果:增塑剂用量为15%,包衣增重为4%,包衣液浓度为1%;所制备的间尼索地平微孔渗透泵微丸12h内释药具有零级释放特征(r=0.9996,0.9995,0.9989),释放动力以渗透压为主。结论:该制备工艺稳定、重现性良好,12h内释药恒定。
间尼索地平;微丸;制备;磺丁基醚-β-环糊精;渗透泵;零级释放;渗透压
间尼索地平(m-Nisoldipine,m-Nis)是河北医科大学药学院合成的国家一类新药,属于二氢吡啶类钙离子拮抗药,主要用于治疗冠心病、心绞痛、高血压和慢性充血性心力衰竭及心源性休克[1]。但间尼索地平不溶于水、溶出度低,影响其口服后体内生物利用度(t1/2:1.23h,AUC:71.94ng·h·mL-1)[2],所以在其缓控释制剂研制中,提高水溶性是保证其发挥药效的前提。在口服制剂中,水溶性环糊精可以增加难溶性药物溶出的速度和程度,从而提高体内生物利用度[3]。在环糊精及其衍生物中,磺丁基醚-β-环糊精(SBE-β-CD)具有水溶性好、肾毒性低及溶血性小等优点,是性能优良的药用辅料[4],国内外对SBE-β-CD在制剂中的应用研究非常活跃[5]。特别是利用SBE-β-CD本身的高渗透压作为渗透压活性物质来制备渗透泵制剂[6~8]。
本试验以SBE-β-CD为增溶物质和渗透压物质,采用挤出滚圆法制备微丸丸芯,并采用流化床包衣制得12h释药的间尼索地平微孔渗透泵微丸,为其进一步开发和应用奠定基础。
1 仪器与试药
ZRS-8G型溶出试验仪(天津大学精密仪器公司);TU-1901型双光束紫外-可见分光光度计(北京普析通用仪器有限责任公司);FLP型流化床包衣机(常州市佳发制粒干燥设备有限公司)。
间尼索地平(批号:091203,纯度:99.11%)、SBE-β-CD(批号:091010,平均取代度:7.0)均由河北医科大学药物化学教研室提供;醋酸纤维素(国药集团化学试剂有限公司,批号:F20091109);癸二酸二丁酯(DBS,天津市福晨化学试剂厂);聚乙二醇(PEG)400(天津市大茂化学试剂厂);其余试剂均为市售分析纯。
2 方法与结果
2.1 微孔渗透泵微丸的制备
2.1.1 挤出滚圆法制备丸芯[9]。将SBE-β-CD与间尼索地平按质量比30∶1混合均匀,以1%高取代羟丙基纤维素(H-HPC)无水乙醇溶液为黏合剂,制得湿度适宜并有一定黏性的软材,置挤出机中,以挤出频率45Hz挤出,滚圆机中滚圆,滚圆频率开始60Hz,随后迅速调为30Hz,滚圆时间约为5min。所得的微丸于60℃干燥,筛取18~24目微丸备用。
2.1.2 微丸的包衣。(1)包衣液的制备:称取一定量醋酸纤维素,用丙酮和异丙醇(8∶2)溶解,配成3%的溶液,加入致孔剂PEG 400,用量为包衣材料总量的40%,再加入适量增塑剂,溶解搅匀即得。(2)微丸包衣工艺:将含药微丸进行流化床包衣,调节流化压力为3×104Pa、雾化压力为(1.2~1.4)×105Pa、包衣温度为30~35℃、喷液流速为1.0~1.2mL·min-1。包衣结束后所得微丸于35℃继续干燥20min,将微丸从流化床内取出,即得。
2.2 方法学建立
2.2.1 含量测定。精密称取间尼索地平5mg,置于100mL量瓶中,用无水乙醇溶解并定容,作为贮备液。分别精密量取适量贮备液,置于10mL量瓶中,加水定容,得浓度分别为0.5、1、2、3、4、5μg·mL-1的溶液,照文献[10]在237nm波长处分别测定吸光度(A)。结果,以浓度(c)为横坐标,A为纵坐标,进行线性回归,得标准曲线:A=609.9c+0.0756(r=0.9991),表明间尼索地平在0.5~5μg·mL-1范围内线性关系良好。测试浓度为80%、100%、120%的间尼索地平溶液日内RSD分别为3.80%、1.13%和2.29%,日间RSD分别为2.54%、1.89%和1.31%。低、中、高浓度的间尼索地平溶液的回收率分别为98.53%、98.37%和101.02%。
即使我以身犯险,冲上去,凭我这点力气能抓住她吗?如果我明知自己太弱帮不上忙,还努力去帮她,这值不值得呢?
制备3批间尼索地平微丸(批号为20100911、20100913、20100915),研细,精密称取适量(约相当于间尼索地平10mg),测定含量,计算出每批相当于标示量的百分含量。3批含量测定结果分别为:(102.6±0.25)%、(101.1±0.33)%、(99.6±0.40)%。
2.2.2 微丸累积释放度测定。取同批次自制微丸(含间尼索地平10mg),照2010年版《中国药典》(二部)附录ⅩD第二法[11]测定累积释放度。转速100r·min-1,在(37±0.5)℃下,释放介质为超声脱气的新鲜蒸馏水900mL。于2、4、6、8、10、12h分别取样5mL,立刻用0.8μm微孔滤膜滤过(自6h起样品精密量取2.5mL,置于10mL量瓶中,用释放介质定容),并及时补充空白释放介质,在237nm波长处测定吸光度,再根据标准曲线求出各取样点的浓度,并绘制药物释放曲线。
2.3 包衣液处方的单因素考察
2.3.1 增塑剂用量对微丸释药的影响。选用DBS为增塑剂,在包衣液中分别加入包衣材料的10%、15%、20%的DBS,以溶出后衣膜的完整性及累积释放度为评价指标,考察增塑剂用量对微丸释药的影响,结果见图1。
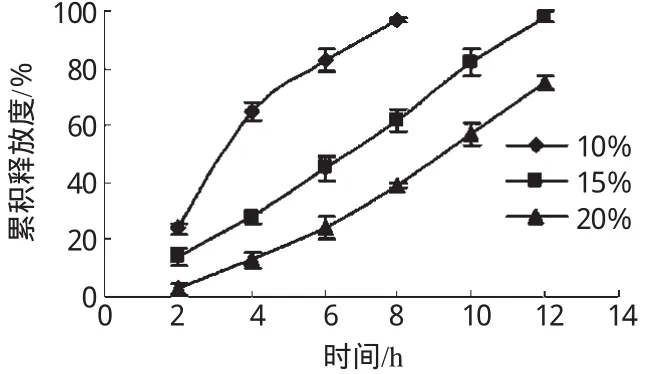
图1 不同增塑剂DBS用量微丸的释药曲线Fig 1 Release profiles of pellets with different content of DBS
由图1可见,增塑剂用量对微丸的释药有较大影响。用量为10%时,增塑效果较差,溶出过程中有部分微丸的衣膜破裂脱落,6h时的累积释放度已达80%以上;增塑剂用量为15%和20%时,微丸在溶出过程中无衣膜破裂脱落现象,溶出后衣膜完整,但从一定时间内的释放度来看,用量为20%时释药速率较用量为15%时慢。综合考虑,确定增塑剂DBS的用量为15%。
2.3.2 包衣增重对微丸释药的影响。按增塑剂DBS用量为15%、致孔剂PEG 400用量为40%加入包衣溶液中,对载药丸芯进行包衣,制备包衣增重为2%、4%、6%、8%的微丸,考察包衣增重对微丸释药的影响,结果见图2。

图2 不同包衣增重微丸的释药曲线Fig 2Release profiles of pellets with different coating weight
由图2可见,包衣增重对微丸的释药影响较大。增重为2%时,12h药物释放较快;随着包衣增重的增加,药物释放速度减慢,12h的累积释放度逐渐减少。考虑药物释放时间,确定包衣增重为4%。
2.3.3 包衣液浓度对微丸释药的影响。将包衣液稀释成醋酸纤维素含量分别为0.5%、1%、3%及5%的溶液,分别用上述不同浓度的包衣液,对同一批载药丸芯进行包衣,使包衣增重均为4%,考察包衣液浓度对微丸释药的影响,结果见图3。
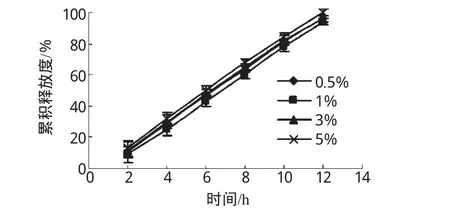
图3 不同包衣液浓度微丸的释药曲线Fig 3 Release profiles of pellets with different concentration of coating solution
由图3可见,在相同包衣增重的条件下,用不同含量的包衣液制得的包衣微丸,其累积释放度无显著差异。但在包衣过程中,若浓度过低,包衣时间会较长;若浓度过高,包衣时粘连现象严重,容易使喷枪堵塞。故以醋酸纤维素含量为1%时比较适合。
综上所述,包衣液处方为增塑剂DBS用量15%,致孔剂PEG 400用量40%,包衣增重4%,1%醋酸纤维素的丙酮-异丙醇溶液。
2.4 包衣工艺重现性及释放度考察
根据“2.3”项下包衣液处方制备包衣液,包衣增重为4%,以同批制得的表面平整、光滑的微丸为丸芯,制备3批间尼索地平渗透泵微丸,测定其累积释放度,并将累积释放度(Q)与时间(t)进行各种释放方程拟合,结果见表1。3批微丸释放曲线见图4。

表1 3批微丸释药动力学方程拟合Tab 1 Fitted release kinetic equation of 3batches of pellets

图4 3批微丸释放曲线Fig 4 Release profiles of 3batches of pellets
由表1中的r值可见,以零级释药方程拟合度最高。因此,间尼索地平微孔渗透泵微丸释放的最佳拟合模型为零级释药模型。所制备的3批微丸体外释药速率在12h内基本恒定,呈现出良好的零级释放特征。
由图4可见,所制备的3批微丸在2、6、12h的累积释放度分别在8%~20%、40%~55%、80%以上,符合2010年版《中国药典》对缓控释制剂的要求。3批样品的累积释放度无显著差异,表明制备工艺稳定、重现性良好。
2.5 释药机制研究
在微孔渗透泵制剂中,同时存在渗透压机制和扩散机制作为释药动力。如果一种制剂存在渗透压释药机制,则环境中的渗透压增高时,药物的释放将受到一定的抑制。故可用此方法来证实制剂是否存在渗透压释药机制。
2.5.1 释放介质渗透压对释药行为影响。为了研究渗透压对药物释放行为的影响,测定了间尼索地平微孔渗透泵微丸在不同浓度氯化钠溶液中的药物释放曲线。结果,随着氯化钠溶液浓度的升高,药物释放速率显著降低,表明本制剂以渗透压为主要释药动力。不同释放介质渗透压对间尼索地平微孔渗透泵微丸释药的影响见图5。

图5 不同释放介质渗透压对微丸释药的影响Fig 5 Effects of different osmotic pressure on drug release of pellets
2.5.2 释放介质对释药行为的影响。为了考察本制剂是否受体内释药环境的影响,以pH 1.2人工胃液、pH 6.8人工小肠液模拟胃肠道的pH变化,测定在不同pH介质中的药物释放曲线。结果,各药物释放曲线之间的相似因子(f2)值为76~85,表明体内存在的离子无法透过半透膜,因此释放介质pH对本品的释药行为影响较小。不同释放介质pH对微丸释药的影响见图6。

图6 不同释放介质pH对微丸释药的影响Fig 6Effects of different pH on drug release of pellets
2.5.3 溶出条件(转速)对释药行为的影响。以转速分别为25、50和100r·min-1来模拟不同程度胃肠道蠕动情况,测定微丸在不同搅拌速度下的药物释放曲线。结果相似因子f2值为79~86,表明药物释放不受转速影响。不同转速对微丸释药的影响见图7。
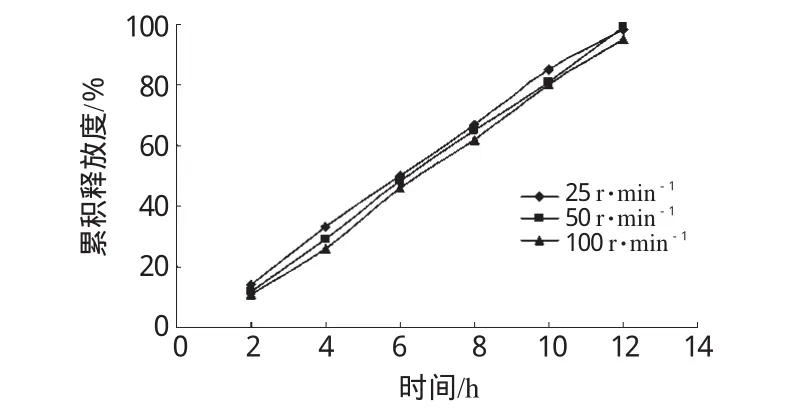
图7 不同转速对微丸释药的影响Fig 7 Effects of different rotation speed on drug release of pellets
3 论
由于SBE-β-CD每个分子上结合有7个钠离子,在水中完全解离后可形成很大的渗透压,因此可作为渗透压物质使用,同时又可以作为难溶性药物的增溶剂。SBE-β-CD用于难溶性药物制备渗透泵制剂,具有良好的应用前景。
在丸芯制备时,最初加入适量微晶纤维素(30%~40%,W/W)作为成丸辅料,但所得包衣微丸释药曲线只在2~6h内维持零级释放,此后便不符合零级释放。分析原因可能是由于微晶纤维素的存在使得释药后期渗透压下降,此时渗透压不再作为主要释药动力。所以笔者尝试在挤出滚圆制备丸芯时,全部采用SBE-β-CD作为成丸辅料,结果所制微丸在整个释放过程中维持高渗透压,实现12h零级释放,而且其释药主要受渗透压的影响,不受pH值和转速影响。
综上所述,本工艺简单可行、重现性好;所制微丸12h释药恒定,呈现良好的零级释放特征。
[1] 陈雪彦,张 伟,苗庆峰.间尼索地平对野百合碱诱导的肺动脉高压防治作用及其抗5羟色胺-细胞外信号调节激酶通路的机制探讨[J].药学学报,2008,43(10):1011.
[2] 王树华,储金秀,尚 清.RP-HPLC法测定Beagle犬血浆中间尼索地平浓度及其药代动力学[J].中国药科大学学报,2007,38(2):140.
[3] Rajewski RA,Stella VJ.Pharmaceutical applications of cyclodextrins.2.In vivo drug delivery[J].J Pharm Sci,1996,85(11):1142.
[4] Irie T,Uekama K.Pharmaceutical applications of cyclodextrins.Ⅲ.Toxicological issues and safety evaluation[J].J Pharm Sci,1997,86(2):147.
[5] 谷福根,高永良,崔福德.磺丁基醚-β-环糊精及其在药剂学中的应用[J].中国新药杂志,2004,13(1):15.
[6] Zannou EA,Strengw H,Stella VJ.Osmotic properties of sulfobutylether and hydroxypropyl cyclodextrins[J].Pharm Res,2001,18(8):1226.
[7] Okimoto K,Tokunaga Y,Ibuki R,et al.Applicability of(SBE)7M-beta-CD in controlled-porosity osmotic pump tablets(OPTs)[J].Int J Pharm,2004,286(1-2):81.
[8] Sotthivirat S,Haslam JL,Stella VJ.Controlled porosityosmotic pump pellets of a poorly water-soluble drug using sulfobutylether-beta-cyclodextrin,(SBE)7M-beta-CD,as a solubilizing and osmotic agent[J].J Pharm Sci,2007,96(9):2364.
[9] 齐晓丹,王 伟,田 珊.挤出滚圆法制备间尼索地平-磺丁醚-β-环糊精微丸及其质量评价[J].中国现代应用药学,2011,28(1):60.
[10] 吴 华,袁志芳,张兰桐.间尼索地平含量测定方法的研究[J].中国新药杂志,2006,15(5):367.
[11] 国家药典委员会.中华人民共和国药典(二部)[S].2010年版.北京:中国医药科技出版社,2010:附录87-88.
Preparation and Drug Release Mechanism of m-Nisoldipine Osmotic Pump Pellets
WANG Wei,ZHANG Jing,QI Xiao-dan(Pharmacy Teaching and Research Section,Pharmacy School of Hebei Medical University,Shijiazhuang 050017,China)
OBJECTIVE:To prepare m-nisoldipine(m-Nis)controlled porosity-osmotic pump pellets,and to study the release mechanism.METHODS:Sulfobutylether-β-cyclodextrin(SBE-β-CD) was used as a solubilizing and osmotic agent.The extrusion-spheronisation method was used to prepare the core of pellets which then coated by fluid-bed coating technology.The single factor design was applied to review the influence of the amount of DBS,coating weight and the concentration of acetone-isopropyl alcohol on the dissolution of pellets.3batches of pellets were prepared in a ccordance with the optimal prescription and zero and first-order,Higuchi equation of cumulative release with time were fitted to study its release characteristics.RESULTS:The formula of coating was optimized as follows:DBS of 15%,coating weight of 4%,cellulose acetate(CA)acetone-isopropanol solution of 1%.Zero-order kinetics existed in the release of the pellets in 12h(r=0.9996,0.9995,0.9989).Moreover,the osmotic pressure-controlled delivery was greatly responsible for drug release.CONCLUSION:The preparation technique is stable with a good repeatability in a constant release within 12h.
m-Nisoldipine;Pellets;Preparation;Sulfobutylether-β-cyclodextrin;Osmotic pump;Zero-order release;Osmotic pressure
R944.9;R972+.4
A
1001-0408(2012)33-3102-04
DOI10.6039/j.issn.1001-0408.2012.33.12
Δ河北省自然科学基金资助项目(C2010000488)
*高级实验师。研究方向:新药研制与开发。电话:0311-86266040。E-mail:hbydwangwei1@sohu.com
#通讯作者:副教授,硕士。研究方向:药物新剂型。电话:0311-86265591。E-mail:dzihwt@sina.com
2011-09-24
2011-11-27)
