红霉素原料药微生物限度检查法探索及方法验证
2012-11-21陈万胜
陈万胜
红霉素原料药是大环内酯类抗菌药物,本身有抑菌作用,影响微生物的生长。建立药品微生物限度检查法时,应进行细菌、霉菌及酵母菌计数方法的验证和控制菌检查方法的验证,以确认所采用的方法是否适合于该药品的细菌、霉菌及酵母菌的测定和控制菌检查。若药品的组分或原检验条件发生改变可能影响检验结果时,计数方法和检查方法应重新验证[1]。
1 材料与方法[2]
1.1 一般材料
1.1.1 药品 霉素原料药,批号:201109001、201109002、201109003三个批次生产单位:安阳九州药业有限公司。
1.1.2 培养基及稀释剂 营养琼脂培养基、改良马丁琼脂培养、营养肉汤培养基、胆盐乳糖培养基、pH7.0氯化钠-蛋白胨缓冲液均为北京三药科技开发公司生产。
1.1.3 验证试验用菌种 金黄色葡萄球菌CMCC(B)26 003、枯草芽孢杆菌 CMCC(B)63 501、大埃希菌CMCC(B)44 102、白色念珠菌CMCC(F)98 001、曲霉 CMCC(F)98 003均为3代,从河南省食品药品检验所购进。
1.1.4 主要仪器 NSO1-3型集菌器;PYX-DHS隔水式电热恒温培养箱;L-5霉菌培养箱;htysteritest601集菌仪。
1.2 方法
1.2.1 菌液制备
1.2.1.1 细菌菌液的制备 接种大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌的新鲜培养物至营养琼脂上,30℃ ~35℃培养18~24 h。取此培养物用0.9%的无菌氯化钠溶液分别采用10倍递增稀释法,稀释至10-4~10-6,制成每1 ml含菌数为50~100 cfu的菌悬液,作活菌计数用。
1.2.1.2 霉菌菌液的制备 接种白色念珠菌的新鲜培养物至改良马丁琼脂培养基中,23℃ ~28℃培养24~48 h。取此培养物用0.9%的无菌氯化钠溶液分别采用10倍递增稀释法,稀释至10-4~10-6,制成每1 ml含菌数为50~100 cfu的菌悬液;接种黑曲霉的新鲜培养物至改良马丁琼脂培养基中,23℃ ~28℃培养5~7 d。取此培养物加3~5 ml含0.5%聚山梨酯80的0.9%的无菌氯化钠溶液分别采用10倍递增稀释法,稀释至10-4~10-6,制成每1 ml含孢子数为50~100 cfu的孢子悬液,作活菌计数用。
上述菌悬液保存在冰箱内,2~8℃保存,在24 h内使用。
1.2.2 供试药液的制备
1.2.2.1 称取红霉素10 g溶于100 ml无菌pH7.0氯化钠-蛋白胨缓冲液中,作为1∶10的供试药液。
1.2.2.2 称取红霉素10 g加入含10 g吐温80的pH7.0无菌氯化钠-蛋白胨缓冲液至100 ml,充分振摇使溶解,作为1∶10的供试液。
1.2.2.3 称取红霉素10 g加入含10 g吐温80的pH7.0无菌氯化钠-蛋白胨缓冲液至2000 ml,充分振摇使溶解,作为1∶200的供试液。
1.2.3 细菌计数方法及验证试验方法
1.2.3.1 实验方法 中国药典2010年版二部附录微生物限度检查法中的平皿稀释法和薄膜过滤法。
1.2.3.2 回收率测定 ①试验组:分别取以上3种供试药液1 ml于5个营养琼脂平皿中;同时分别取以上3种供试药液10、10、200 ml以无菌操作加入装有直径50 mm、孔径不大于0.45 μm微孔滤膜的过滤器内,减压抽干后,用pH7.0无菌氯化钠-蛋白胨缓冲液冲洗7次,每次100 ml,最后一次加入1 ml金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌菌液,过滤后,取出滤膜,菌面朝上贴于凝固的营养琼脂平板上,于30℃~35℃培养3 d,逐日观察,计数。②菌液组:测定每一菌株的试验菌数,采用平板菌落计数法。③供试药品对照组:不加菌液,其他操作同试验组,测定样品本底菌数。④稀释剂对照组:分别取无菌pH值7.0氯化钠-蛋白胨缓冲液与含10 g吐温80的pH7.0无菌氯化钠-蛋白胨缓冲液,按照试验组的方法,逐一加入试验菌液1 ml,其他操作同试验组。
1.2.3.3 回收率计算公式 试验组的菌回收率%=(试验组菌落数均值-供试品对照组菌落数均值)/菌液组菌落数均值×100%。
稀释剂对照组回收率%=稀释剂对照组菌落数均值/菌液组菌落数均值×100%。
1.2.4 霉菌和酵母菌计数方法及验证试验方法
1.2.4.1 实验方法 中国药典2010年版二部附录微生物限度检查法中的平皿法和薄膜过滤法。
1.2.4.2 回收率测定 ①试验组:分别取以上三种供试药液1 ml于5个玫瑰红钠琼脂平皿中,同时分别取以上三种供试药液10、10、200 ml以无菌操作加入装有直径50 mm、孔径不大于0.45 μm微孔滤膜的过滤器内,减压抽干后,用pH7.0无菌氯化钠-蛋白胨缓冲液冲洗7次,每次100 ml,最后一次加入1 ml白色念珠菌、黑曲霉菌菌液,,过滤后,取出滤膜,菌面朝上贴于凝固的玫瑰红钠琼脂平板上,于23℃ ~28℃培养,培养5 d,逐日观察,计数。②菌液组:测定每一菌株的试验菌数,采用平板菌落计数法。③供试药品对照组:不加菌液,其他操作同试验组,测定样品本底菌数。④稀释剂对照组:分别取无菌pH值7.0氯化钠-蛋白胨缓冲液与含10 g吐温80的pH7.0无菌氯化钠-蛋白胨缓冲液,按照试验组的方法,逐一加入试验菌液1 ml,其他操作同试验组。
1.2.4.3 回收率计算公式 同细菌:①供试品试验组、供试品对照组均无菌生长,菌液组、稀释剂对照组菌落生长良好。②供试品试验组、供试品对照组、菌液组、稀释剂对照组菌落生长情况如表1。③供试品试验组、供试品对照组、菌液组、稀释剂对照组菌落生长情况如表2。
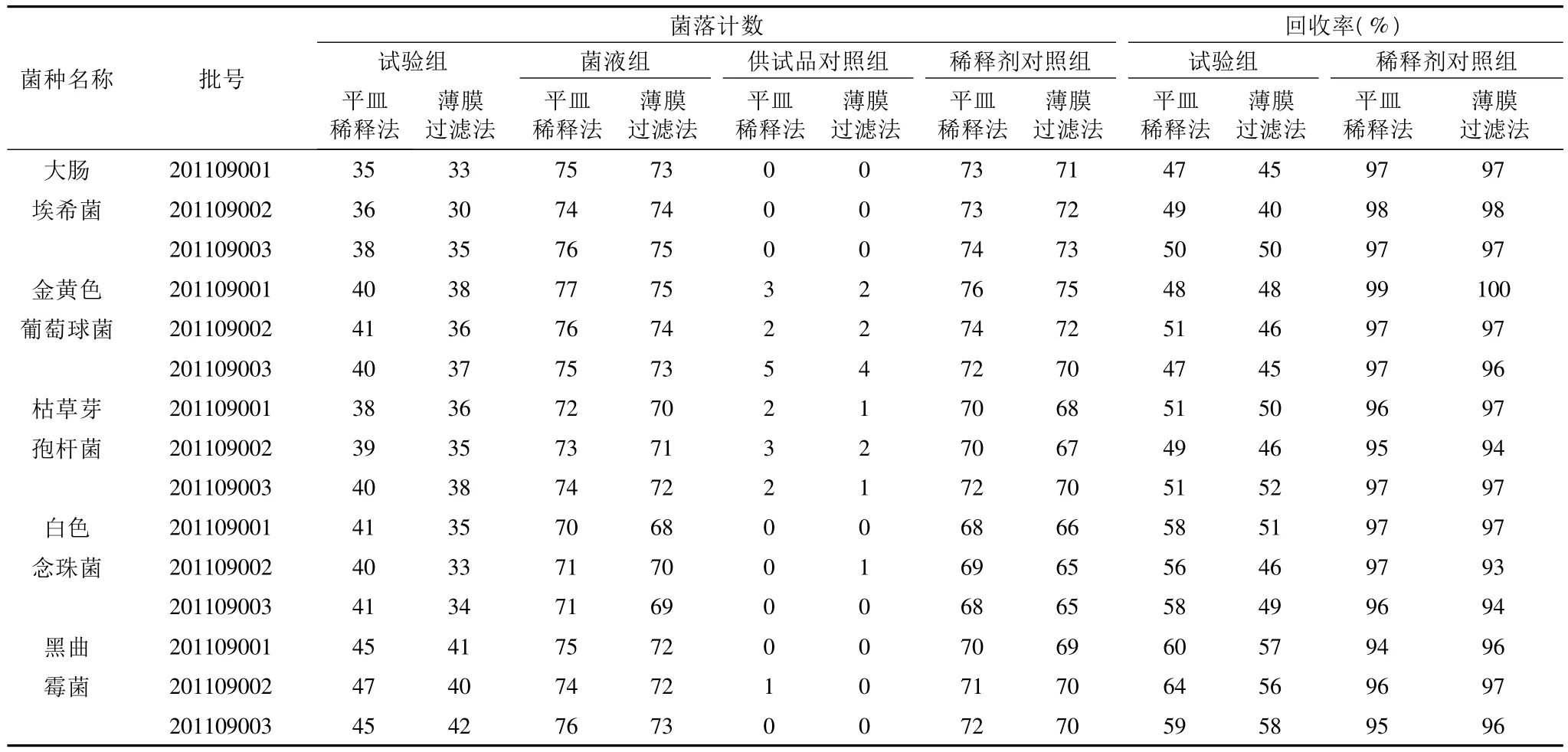
表1
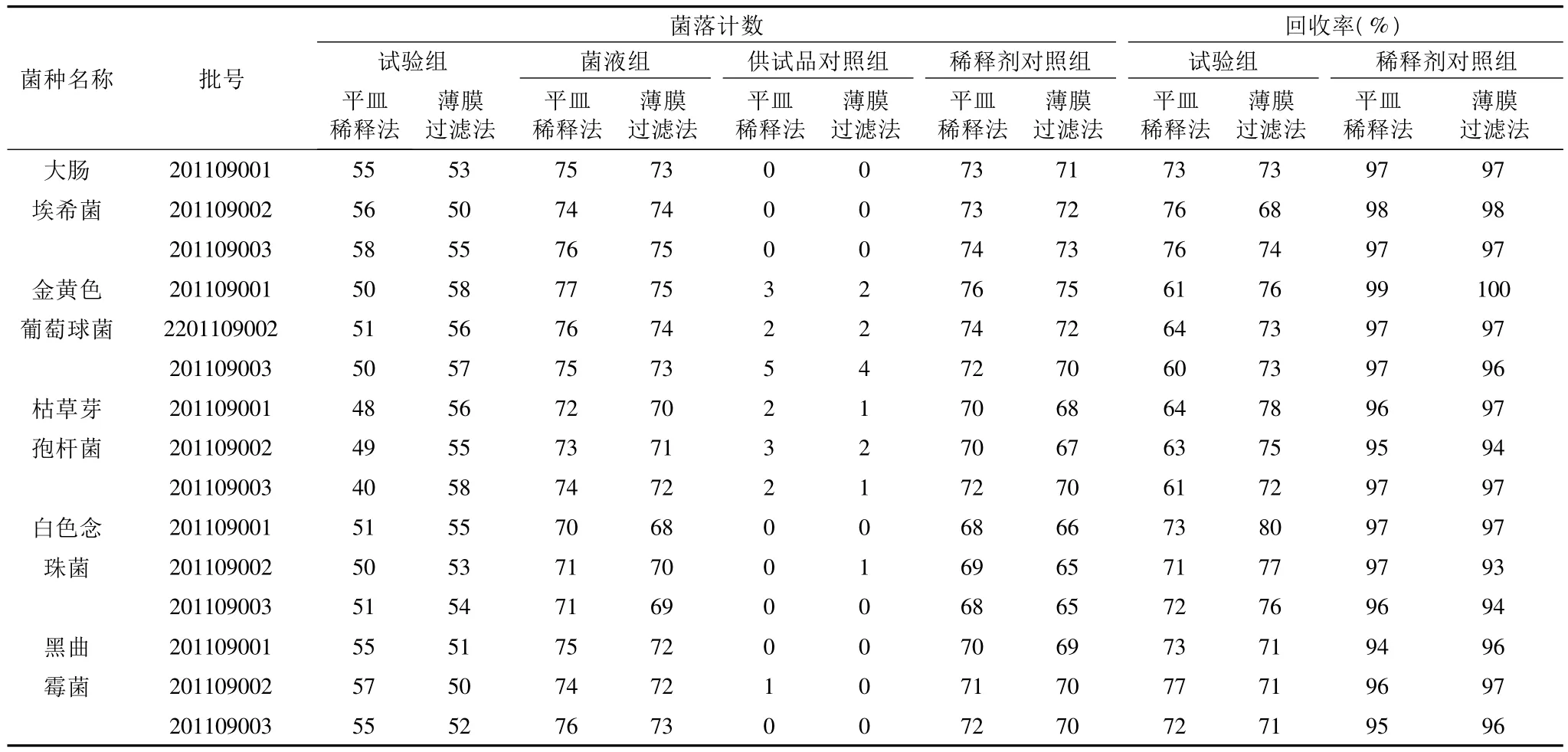
表2
1.2.5 控制菌检查方法及验证
1.2.5.1 实验方法 中国药典2010年版二部附录微生物限度检查法中的平皿法和薄膜过滤法。
1.2.5.2 菌液制备 取经37℃培养18~24 h大肠埃希菌的营养肉汤培养物1 ml加9 ml灭菌生理盐水,10倍稀释至10-6,细菌数约为 10 ~100 cfu/ml。
1.2.5.3 控制菌验证 试验组:分别取三种供试药液10 ml以无菌操作加入100 ml胆盐乳糖培养基中培养;同时分别取以上三种供试药液10 ml、10 ml、200 ml以无菌操作加入装有直径50 mm、孔径不大于0.45 μm微孔滤膜的过滤器内,减压抽干后,用pH7.0无菌氯化钠-蛋白胨缓冲液冲洗7次,每次100 ml,最后一次加入1 ml大肠埃希菌液,过滤后,取出滤膜,加入100 ml胆盐乳糖培养基中培养,35℃ ~37℃培养24 h。
1.2.6 观察结果 ①供试品试验组均无菌生长。②供试品试验组均无菌生长。③供试品试验组菌落生长情况见表3。

表3
2 结果
2.1 结果可知:①制备的供试液由于没有完全溶解,没有消除药品本身的抑菌作用,不能用于细菌限度的测定。②制备的供试液虽然完全溶解,但供试液浓度过高,药物的抑菌作用仍没有完全消除。③制备的供试液平皿稀释法金黄色葡萄球菌和枯草芽孢杆菌回收率低于70%,不符合验证的要求,薄膜过滤法冲洗量为700 ml时,金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌、白色念珠菌和黑曲霉菌的回收率均高于70%,符合验证规定的要求。
2.2 从2.6结果可知:控制菌(大肠埃希菌),采用薄膜过滤法检查大,冲洗量为700 ml,结果符合验证规定要求。
3 讨论
3.1 从上述结果可知,红霉素原料药的微生物限度检查可依据中国药典2010年版二部附录微生物限度检查法中的薄膜过滤法进行,即取本品10 g加入含10 g吐温80的pH7.0无菌氯化钠-蛋白胨缓冲液至2000 ml,充分振摇使溶解,作为1∶200的供试液,取供试液200 ml以无菌操作加入装有直径50 mm、孔径不大于0.45 μm微孔滤膜的过滤器内,减压抽干后,用 pH7.0无菌氯化钠-蛋白胨缓冲液冲洗7次,每次100 ml。
3.2 红霉素原料本身具有抑菌作用,制备供试药液的方法会影响微生物的生长,做微生物限度检查法的验证试验证明,必须消除药品中抑菌物质的干扰,才能得到准确的测定结果。
3.3 由以上验证实验证明,做微生物限度检查法的验证是很有必要的,若不做验证实验,所做的实验结果就不一定准确、可靠。
3.4 一个药品要做微生物限度检查时,应该怎样去操作,什么方法才最适合个品种,是常规平皿法还是薄膜过滤法等,是要根据药品的性质选用你认为适宜的一个方法或几个方法进行试验来验证你所选用的方法是否可行。只有这样你的试验才是科学的。
[1]中华人民共和国药典2010年版二部药典委员会.中国医药科技出版社附录ⅪJ微生物限度检查法:107.
[2]中国药品检验标准操作规范2010年版.中国药品生物制品检定所.中国药品检验总所.编写.微生物限度检查法:351.
