EGB对大鼠脑缺血-再灌注损伤的作用
2012-11-21王淑英李慧玲李文侯丽然张辉原德新斗章
王淑英 李慧玲 李文 侯丽然 张辉 原德新 斗章
缺血-再灌注损伤是在缺血性损伤的基础上发展而来的,涉及许多疾病的发病机制并影响其愈后。再灌注可以使可逆性缺血加重,即可能促进可逆性缺血损伤转化为不可逆性损伤。寻找有效的防治脑缺血再灌注损伤药物已成为国内外的研究热点[1,2]。本实验运用电镜、光化学分析方法研究EGB对大鼠局灶性脑缺血-再灌注损伤的影响,以期在脑缺血-再灌注损伤的预防与治疗中为EGB的开发和临床应用提供足够的实验依据。
1 材料与方法
1.1 一般材料 健康Wistar大鼠75只,体重280~380 g,雌雄不限,随机分为3组。动物由佳木斯大学实验动物中心提供。动物术前12 h禁食,自由饮水。
1.2 方法
1.2.1 动物分组 随机将大鼠分为假手术组(Sham组):25只,做动脉分离手术,不栓塞大脑中动脉;缺血-再灌注组(I/R组):25只,大脑中动脉栓塞2 h,再灌注24 h;EGB干预组(EGB+I/R):25只,对其进行大脑中动脉栓塞2 h,栓塞后2 min内尾静脉注射 EGB(20 mg/kg),再灌注24 h,其间给3次药。
1.2.2 实验动物模型的制备及干预 参照Nagasawa、汪家龙、马常升等[3-5]报道的方法,采用颈内动脉插入线栓法造模。Wistar大鼠用3.5%水合氯醛(350 mg/kg,腹腔注射)麻醉,仰卧固定。切开颈部正中皮肤,钝性游离右侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA),仔细分离以免刺激迷走神经。由CCA分叉处向头端依次游离,并用电热烧灼器烧断颈外动脉所有分枝,使其主干游离备用。然后分离ICA至颅底,并分离出 ICA颅外段的惟一分支翼腭动脉(PPA)。用蛙心夹夹住CCA和ICA,并在ECA(靠近CCA分叉处)上剪一小口,将一端涂有聚氨酯的栓子(预先蘸有肝素钠溶液)沿切口插入ECA,经CCA分叉处并将预先放置于ECA根部的手术缝合线扎紧,以防止其中的栓子滑出和出血,然后放开ICA上的蛙心夹,将栓子缓慢地向ICA入颅方向推进约19~21 mm,微遇阻力即停,使栓子头端停留在大脑中动脉(MCA)与大脑前动脉(ACA)分叉处。固定栓子,即完成一侧MCA的栓塞。栓塞2 h后,缓慢的轻拉栓子使其头端回到ECA内,可实现MCA再灌注。假手术组除不插线外,全过程同模型组。术后2 min尾静脉给药,20 mg/kg,3次/d,假手术组和模型组给予等体积生理盐水。各组大鼠均在再灌注24 h后取材。
1.2.3 神经病学评分 参考Kuluz[6]神经缺陷三级评分标准,动物清醒后分别在对应时点进行评分。标准如下:0级:无缺陷,活动正常;Ⅰ级:右侧Horner's征阳性;Ⅱ级:提尾悬空时左前肢曲屈、内收;Ⅲ级:自主运动时向偏瘫侧(左侧)划圈。脑缺血后,上述Ⅰ~Ⅲ级三项体征均出现的大鼠,才视为造模成功,进入下一步试验。
2.4 电镜标本观察 再灌注24 h后,将动物断头,迅速取右脑,将其修成1 mm×1 mm×1 mm小块,用2.5%戊二醛的0.1 mol/L磷酸缓冲液固定,丙酮梯度脱水、环氧树脂浸透包埋,超薄切片,厚50 nm,醋酸铀染色观察线粒体及核膜变化。
2.5 SOD和MDA的测定 2.5.1 样本处理 大鼠脑缺血-再灌注至24 h后,迅速断头取右脑,在冰盘中以脑组织(mg):生理盐水(ml)=10∶1的比例,在盛有冰块的器皿中用玻璃匀浆器碾磨成脑匀浆,4℃3000 r/min离心机离心20 min,取上清液于~30℃以下保存待测。
2.5.2 SOD测定 采用黄嘌呤氧化酶发光法。
2.5.3 MDA的测定 用硫代巴比妥酸法(TAB)测定。
2.6 数据分析和统计处理 所有数据均经计算机运用SPSS软件处理,组间采用方差分析,组内采用独立样本检验。所有结果以均值标准差表示,差异有统计学意义(P<0.05)。
3 结果
3.1 线粒体电镜观察 假手术组神经元胞质内线粒体较多,呈圆形或椭圆形,内嵴排列整齐、清晰,粗面内质网散在分布,表面有密集的核糖体附着,核膜结构完整(图1);缺血2 h再灌注24 h,电镜下神经细胞内细胞器明显减少,胞浆内线粒体肿大,嵴变短或减少、消失,内质网也扩张,其上的核糖体脱失,胞浆中糖原减少,自噬泡增多,核膜不完整或缺失(图2);EGB干预组核膜结构与正常组无明显差别,线粒体稍有轻度肿胀,与缺血-再灌注组比较明显减轻(图3)。
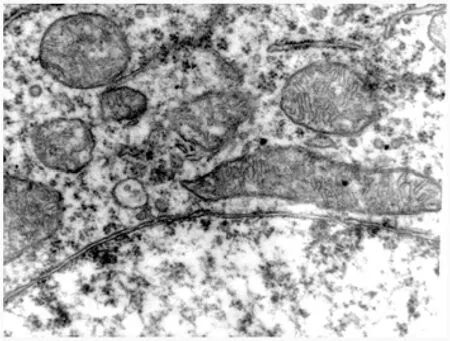
图1 假手术组线粒体电镜像20 k
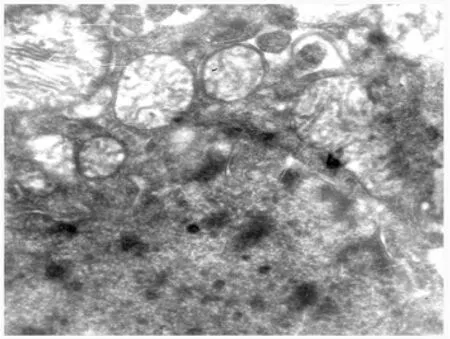
图2 模型组线粒体电镜像20 k
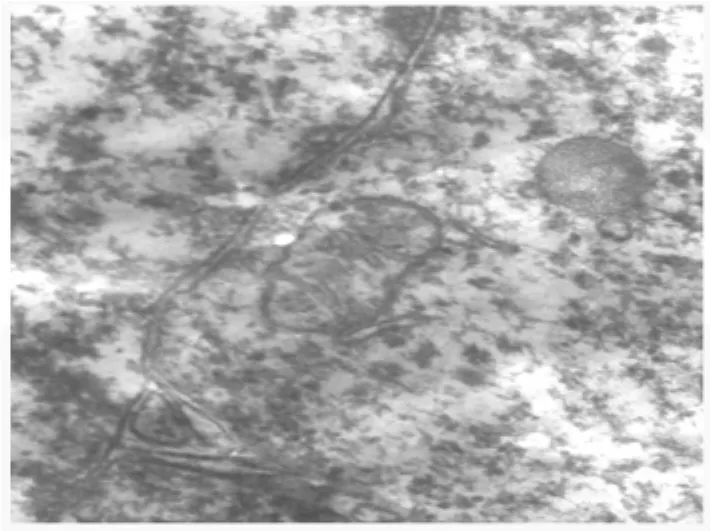
图3
3.2 SOD和MDA水平的变化(见表1)。
表1 大鼠SOD和MDA水平的变化(±s)
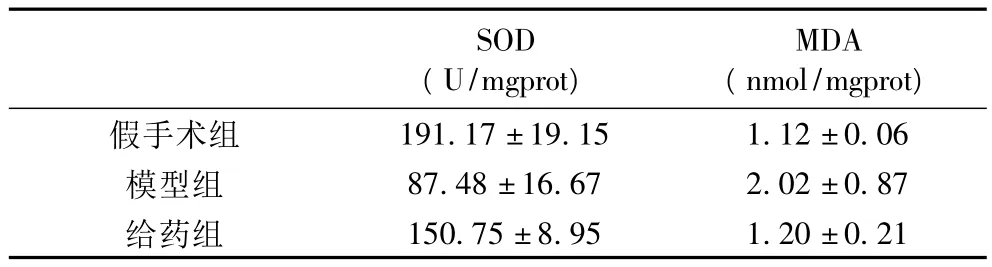
表1 大鼠SOD和MDA水平的变化(±s)
注:给药组与假手术组相比,P<0.05;与模型组相比,P<0.05
SOD(U/mgprot)MDA(nmol/mgprot)假手术组150.75±8.95 1.20±0.21 191.17±19.15 1.12±0.06模型组 87.48±16.67 2.02±0.87给药组
4 讨论
线粒体是细胞氧化磷酸化反应的主要部位,再灌注时,线粒体氧化磷酸化功能障碍,损伤的电子传递链成为氧自由基的重要来源。缺血、缺氧使ATP含量减少,Ca2+进入线粒体增多,使线粒体功能受损,细胞色素氧化酶系统功能失调,以致进入细胞内的氧经单电子还原而形成的氧自由基增多,而经4价还原生成的水减少。有学者[7]认为Ca2+进入线粒体可使锰-超氧化物歧化酶减少,对自由基的清除能力降低,进而使自由基含量增加。氧自由基主要包括超氧自由基(O-2·)、过氧化氢(H2O2)、羟自由基(HO·)和单线态氧等。O-2·等活性氧的主要毒性作用是直接损伤细胞膜,使多不饱和脂肪酸过氧化,也使具有膜结构的内质网、溶酶体、线粒体等结构破坏,导致一系列功能紊乱,从而诱导某些疾病的发生[8]。
脂质过氧化作用形成的脂氢过氧化物,在过氧化条件下易分解生成MDA以及新的自由基等。MDA能带着原自由基的损伤潜能[9],从它生成的部位扩散到其他细胞成份,甚至能从细胞逸出,带着自由基的损伤潜入到其他细胞,引起细胞损伤[10]。
生物体为了防止这些毒性效应,形成了一个完整的抗氧化防御系统。机体中的抗氧化酶主要有SOD和各种过氧化物酶。SOD可催化O-2·生成H2O2和O2,减少O-2·对组织的损伤。SOD被认为是人体内消除 O-2·毒性效应的最重要保护酶,其可减少O-2·对细胞内含巯基的蛋白质的损伤,防止酶失活。SOD可干扰吞噬细胞生成的O-2·有利于损伤的修复。
本研究发现,大鼠脑缺血再灌注后,其脑组织内SOD活性明显下降,而MDA含量却明显升高,线粒体损伤较严重。可能是脑缺血再灌注后,脑内缺氧、脂质过氧化作用加强所致。提示,脑缺血再灌注后可使脑抗氧化能力降低。另外,本研究发现,EGB治疗组脑组织内SOD活性较模型组明显增加,而MDA的含量明显下降,线粒体损伤较轻。这可能是由于EGB通过改善细胞氧化磷酸化反应,使SOD活性增强,对自由基的清除能力增强,进而使自由基含量降低,从而对缺血-再灌损伤的脑组织起到保护作用。
[1]陈芬芳,汤永红.Bcl-2与脑缺血-再灌注损伤关系的研究进展.医学信息(上旬刊),2011,24(2):821-822.
[2]黄昕艳,张道春,陈丽.纳洛酮对大鼠局灶性脑缺血-再灌注损伤后的脑保护作用.心血管康复医学杂志,2008,17(2):162-164.
[3]Nagasawa H,Kogure K.Correlation between cerebral blood flow and histologic changes in a new rat model of middle cerebral artery occlusion.Stroke,1989,20:1037-1043.
[4]汪家龙,刘才栋.实验性急性脑缺血模型及其研究进展.解剖科学进展,1999,15(3):212-214.
[5]马常升,马文领.插线法制备大鼠局灶性脑缺血-再灌注模型的研究.解剖学杂志,1999,22(3):209-213.
[6]Kuluz JW,Prado RJ,Dietrich D,et al.The effect of nitric oxide synthase inhibition on infarct volume after reversible focal ischemia in conscious rats.Stroke,1993,24:2023.
[7]陈晔,王文宇,王致喻,等.局部缺血猫脑的透射电镜观察.中国神经精神疾病杂志,1991,17:139.
[8]Bulkley G B.Free radical-mediated reperfusion injury:a selective r eview.Br J Cancer,1987,55:66-78.
[9]Esterbauer H.Aldehydic products of lipid peroxidation.In Free Rad icals,Lipid Peroxidation and Cancer.London:Acadenlic Press,1982:101-128.
[10]Halliwell B and Gufferidge J M C.Free radicals in biology and medicine.Oxford Clarendon Press,1989:196-226.
