改良TRIzol法提取肿瘤细胞琼脂克隆的总RNA
2012-11-21宋利强
沈 景,宋利强
中国医学科学院 北京协和医学院 基础学院病理系,北京 100005
·技术与方法·
改良TRIzol法提取肿瘤细胞琼脂克隆的总RNA
沈 景,宋利强
中国医学科学院 北京协和医学院 基础学院病理系,北京 100005
TRIzol;琼脂克隆形成实验;RNA提取;多糖
琼脂克隆形成实验是肿瘤研究领域中一种重要的体外实验,可用于筛选转化细胞、评价肿瘤细胞药物敏感性[1]等。有研究表明,琼脂克隆形成实验筛选的肿瘤细胞具有肿瘤干细胞的特性[2],有更强的致瘤性和转移能力[3]。因而肿瘤细胞琼脂克隆的基因表达分析,对研究肿瘤干细胞的基因表达特征、分子标志及耐药机制有重要意义。但提取的琼脂克隆RNA被琼脂糖严重污染,琼脂糖又阻碍逆转录反应的进行[4-5],使所提RNA难以用于基因表达分析。本实验将F9细胞与琼脂糖凝胶混合以模拟琼脂克隆,以建立有效去除琼脂糖污染、提取高质量RNA的方法,并通过提取M5076琼脂克隆的RNA进行验证。
材料和方法
材料F9小鼠畸胎瘤细胞株购自中国医学科学院细胞中心;M5076小鼠卵巢网状细胞肉瘤细胞株由美国癌症研究所赠送; PBS、细胞培养基及血清购自Hyclone公司; TRIzol 总RNA提取试剂、低熔点超纯琼脂糖购自上海英骏公司;反转录试剂盒购自Promega公司。
F9细胞总RNA的提取将对数生长期的F9细胞收集至离心管,约4×107细胞沉淀与1.5 g 1%的琼脂糖凝胶混合,加入13 ml TRIzol裂解细胞,取其中12 ml分装入12个无RNA酶的 1.5 ml离心管,分成对照组、PBS预处理组、焦碳酸二乙酯(diethylpyrocarbonate, DEPC)水预处理组和0.2 mol/L醋酸钾溶液预处理组,每组3管。对照组直接用TRIzol提取RNA;其他3组每管缓慢加入1/4体积预冷至4℃的相应预处理液,-80℃放置30 min, 4℃、12 000×g离心10 min后取上清,再按TRIzol说明书进行提取。
软琼脂克隆形成实验将M5076单细胞悬液接种于6孔板的双层琼脂培养基中,底层、上层琼脂糖浓度分别为0.6%和0.5%。每孔加入0.5 ml含17%马血清的1640培养基,隔天换液,于 CO2培养箱中培养42 d[6]。
M5076细胞琼脂克隆RNA的提取将琼脂克隆挑出,加入5倍体积的TRIzol裂解细胞,分装入无RNA酶的 1.5 ml离心管。每管加入1/4体积预冷至4℃的PBS,-80℃放置30 min, 4℃、12 000×g离心10 min后取上清,按TRIzol说明书进行提取。
RNA纯度和质量鉴定检测RNA紫外吸收特性,以A260/A280评估蛋白质污染、A260/A230评估多糖及酚类污染;甲醛变性胶电泳检测RNA有无降解; RT-PCR检测RNA能否用于逆转录反应,扩增的基因为GAPDH,引物序列为:上游引物:5’-ACCACAGTCCATGCCATCAC-3’;下游引物 : 5’-TCCACCACCCTGTTGCTGTA-3’。 PCR反应条件为:95℃变性30 s, 68℃复性30 s, 68℃延伸90 s, 35个循环后72℃延长10 min,于4℃保存。
统计学处理采用SPSS 13.0统计软件对实验数据进行两组独立样本t检验,检验标准为Plt;0.05。
结 果
F9细胞RNA纯度和完整性对照组RNA样品中,琼脂糖与RNA共沉淀导致RNA沉淀难于溶解,加热助溶后又形成凝胶,只得到少量的RNA溶液。对照组、各预处理组的A260/A280均大于1.8;对照组A260/A230为0.76±0.20,各处理组均大于2.0;对照组A260/A230与PBS组、DEPC水组、醋酸钾溶液组相比,差异均有统计学意义(P=0.001,P=0.009,P=0.038)。变性胶电泳显示,各预处理组均得到了清晰的28S、18S核糖体RNA条带,其亮度比约为2∶1;醋酸钾溶液处理组有基因组DNA污染及RNA降解;DEPC水处理组亦有少量基因组DNA污染(图1)。
M5076琼脂克隆RNA纯度和完整性M5076细胞琼脂克隆3个重复样品总 RNA的A260/A280分别为1.97、1.97、1.96,均大于1.9;A260/A230为2.25、2.26、2.3,均大于2.2。变性胶电泳显示, 28S和18S 核糖体RNA条带清晰,亮度约为2:1(图2)。
RT-PCR检测M5076琼脂克隆RNA的生物活性总RNA反转录为cDNA 后,通过PCR扩增了451bp的GAPDH基因片段(图3)。
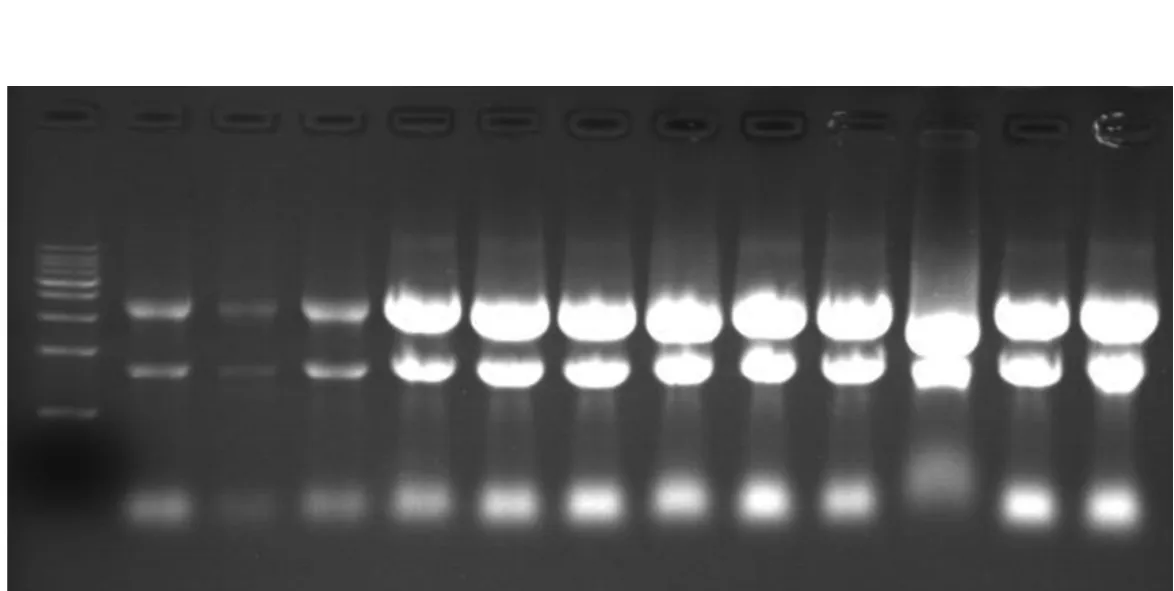
1:对照组;2:PBS预处理组;3:焦碳酸二乙酯水预处理组;4:醋酸钾溶液预处理组图1 F9细胞对照组和各处理组RNA电泳

1、2、3为3个重复样品图2 M5076琼脂克隆总RNA电泳

1、2、3为3个重复样品图3 RT-PCR扩增的GAPDH基因片段
讨 论
根据干细胞领域的理论,琼脂培养基中生长的细胞克隆,一旦转到普通平皿中培养即发生分化而失去干细胞特性[7],基因表达特征随之改变。因而,直接提取琼脂克隆的RNA做基因芯片、逆转录 PCR等基因表达分析,对研究肿瘤干细胞的基因表达特征具有重要意义。提取琼脂克隆RNA的难点,在于琼脂糖能与RNA共沉淀[4],商业化试剂盒均无法将其有效去除[8]。
F9细胞模拟琼脂克隆实验中, PBS去除琼脂糖污染的效果比DEPC水、醋酸钾溶液为好,因此本实验建立了一种通过PBS稀释TRIzol细胞裂解液、-80℃冷冻、低温高速离心等手段去除琼脂糖污染的方法,提取了M5076肿瘤细胞琼脂克隆的高质量RNA,并以RT-PCR方法验证了所提RNA能够用于后续的逆转录反应。本方法将为肿瘤细胞琼脂克隆的基因表达研究提供有力的工具,对干细胞、肿瘤干细胞领域的研究提供帮助,也对某些富含多糖植物的RNA提取有一定的启示。
[1]Salmon SE, Hamburger AW, Soehnlen B. Quantitation of differential sensitivity of human-tumor stem cells to anticancer drugs [J]. N Engl J Med, 1978, 298(24):1321-1327.
[2]Dou J, Pan M, Wen PL, et al. Isolation and identification of cancer stem-like cells from murine melanoma cell lines [J]. Cell Mol Immunol, 2007, 4(6):467-472.
[3]Li L, Price JE, Fan D,et al. Correlation of growth capacity of human tumor cells in hard agarose with theirinvivoproliferative capacity at specific metastatic sites [J]. J Natl Cancer Inst, 1989, 81(18):1406-1412.
[4]Falcão VDR, Tonon AP, Oliveira MC, et al. RNA isolation method for polysaccharide rich algae: agar producing Gracilaria tenuistipitata [J]. J Appl Phycol, 2008, 20(1):9-12.
[5]Li B, Wang B, Tang K, et al. A simple and convenient approach for isolating RNA from highly viscous plant tissue rich in polysaccharides[J].Colloids Surf B Biointerfaces, 2006, 49(2):101-105.
[6]Li X, Pan Y, Fan R, et al. Adenovirus-delivered CIAPIN1 small interfering RNA inhibits HCC growthinvitroandinvivo[J]. Carcinogenesis, 2008, 29(8):1587-1593.
[7]Xudong S, Jerry G, Wade B. Anchorage-independent culture maintains prostate stem cells [J]. Dev Biol, 2007, 312(1):396-406.
[8]Chunming W, Jinghua H, Feng Z, et al. RNA extraction from polysaccharide-based cell-laden hydrogel scaffolds [J]. Anal Biochem, 2008, 380(2):333-334.
沈 景 电话:010-65295992,电子邮件:sdshenjing@163.com
R-331
B
1000-503X(2012)02-0190-03
10.3881/j.issn.1000-503X.2012.02.017
2011-03-28)
