B超联合骨桥蛋白和CA125检测在卵巢癌早期诊断中的价值
2012-11-20樊江波张格林高艳娥
樊江波, 张格林, 吴 静, 高艳娥
(西安交通大学医学院第二附属医院妇产科, 西安 710004;*通讯作者,E-mail:fanjiangbo2004@163.com)
卵巢癌是对妇女危害严重、治疗效果差的恶性肿瘤,发病率仅次于子宫颈癌和子宫内膜癌而列居女性生殖器官恶性肿瘤第3位,但却位列妇科恶性肿瘤死亡原因的首位[1]。因其发病隐匿,部位深,妇科检查不易触及,早期通常无明显症状,且易发生腹腔转移,约80%的患者就诊时已是晚期,而晚期患者的5年生存率仅为15%-25%,相比之下,早期卵巢癌患者的5年生存率接近90%。据统计,在中国,卵巢癌每年新发病人数为19.2万,死亡人数却高达11.4万[2]。因此,早期诊断是提高卵巢癌患者5年生存率的关键。
如何早期诊断和提高恶性肿瘤的治愈率,一直是医学工作者努力的目标。提高恶性肿瘤治愈率的关键是早期发现及早期治疗。卵巢癌传统的肿瘤标志物如CA125敏感性及特异性不高,阳性预测值低。B超是目前现有的卵巢癌早期筛查方法中公认为最有意义的方法之一,但对卵巢囊性病变的超声诊断必须紧密结合病史及其他实验室检查,以减少误诊。骨桥蛋白(osteopontin,OPN)作为肿瘤转移机制的重要参与者,可作为卵巢癌的新的标志物用于卵巢癌的早期诊断和病情预测[3-5],其在卵巢癌中的表达、外周血浓度及受体水平,均可作为无创性肿瘤筛查的指标。因此,寻找一些早期发现恶性肿瘤的筛查途径是非常重要的,也是肿瘤学界的重点攻关课题。学者们认为几种肿瘤标志物联合检测可提高卵巢癌早期诊断的阳性率。
1 资料与方法
1.1 一般资料 选取西安交通大学医学院第二附属医院2008-01~2011-06妇产科门诊及住院卵巢肿瘤患者70例,其中30例诊断为卵巢癌(实验组),年龄30-67岁,平均(44.5±10.8)岁,40例诊断为卵巢良性肿瘤(对照组),年龄28-63岁,平均(41.8±9.7)岁,均经病理确诊。两组患者在年龄、文化程度、婚姻职业及地域分布等方面比较差异无统计学意义(P>0.05),具有可比性。病例选择排除了合并其他恶性肿瘤、妇科炎症、结核、肝肾功能异常及内科合并症等疾病者。所有患者手术前均行血清CA125、OPN水平检测及B超检查。其中卵巢癌组患者临床按FIGO分期标准分为Ⅰ期5例、Ⅱ期6例、Ⅲ期10例和Ⅳ期9例。组织分化程度:低分化13例,中分化10例,高分化7例。
1.2 血清检测方法 以上各组患者均在清晨采集患者空腹静脉血5 ml,以枸橼酸钠抗凝,2 500 r/min离心5 min后,取血清检测。
1.2.1 OPN测定 用 ELISA法进行血清 OPN测定,试剂盒购自美国BEPEC-BIOPHARMA公司,严格遵守说明书操作。洗板机:BIO-RAD1575(美国)。酶标仪:BIO-RAD550(美国)。按照试剂盒的说明 OPN 临界值为30.0 ng/ml,OPN 测定值>30.0 ng/ml为阳性。
1.2.2 CA125测定 采用电化学发光方法定量测定CA125含量。仪器:罗氏Elecsys2010全自动电化学模块(德国)。试剂盒:Roche Diagnostics GmbH罗氏原装进口试剂(德国)。临界值:血清CA125临界值为35.0 U/ml,CA125 测定值> 35.0 U/ml为阳性。
1.3 超声检查方法 超声显像使用美国GE公司LOGIQ5型超声诊断仪,探头频率3.5 MHz,所有患者均经腹部或经阴道B超常规检查子宫、附件,作纵、横、斜向扫描,显示肿块后,详细描述其大小、形态、内部回声及周围器官的关系,有无腹水,并做出图像诊断。
1.4 统计学分析 使用SPSS11.5软件,两组样本均数比较采用独立样本t检验,两个样本率比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 卵巢良恶性肿瘤B超的特点 B型超声检测肿块的形态、部位、大小,提示肿瘤性状如囊性、囊实性或实性,囊内有无乳头以及鉴别腹水及结核性包裹积液等,但对于小于1 cm的实性包块不易测出。卵巢癌的典型超声特点:以囊实性和实性回声为主;具体图像可呈多样性,表现为回声不规则;肿瘤壁薄厚不均、不规则且包膜不完整,表面粗糙,可有向囊内或壁外生长之实性团块;肿块内部回声紊乱强弱不均,其内可见乳头声影,多为双侧病变,分房者多见,常伴有腹水征回声(见图1)。卵巢良胜肿瘤的超声特点:一侧或双侧附件无回声区,大小不一,以囊性病变为主;形态规则,包膜完整,壁薄、内壁光滑,多为单房,也可有多个分隔,以单侧多见;边界清楚之无回声至低回声区,有时可见均匀分布的强回声光点或集中的增强回声区(畸胎瘤);无腹水征及腹腔结节(见图2)。本实验组30例卵巢癌患者经B超诊断21例,敏感度为70.0%,特异度为92.5%。
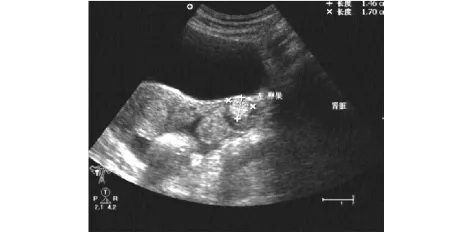
图1 卵巢癌患者超声图像(浆液性囊腺癌,囊内实性团块伴有腹水)Fig 1 Ultrasonic imaging of ovarian cancer
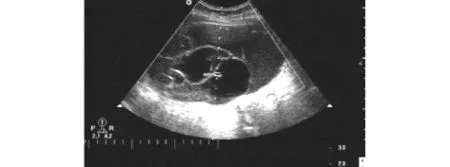
图2 卵巢良性肿瘤患者超声图像(黏液性囊腺瘤,壁薄、光滑,有分隔)Fig 2 Ultrasonic imaging of benign ovarian cancer
2.2 血清OPN、CA125测定水平的比较 卵巢良性肿瘤组和卵巢癌组血清OPN水平统计比较具有统计学差异(P<0.01,见表1)。卵巢良性肿瘤组和卵巢癌组血清CA125水平也具有统计学差异(P<0.01,见表1)。
2.3 B超联合OPN、CA125检测对卵巢癌的诊断价值 本实验应用B超检查、血清OPN和CA125三种检测方法对卵巢癌患者进行检测,进行了敏感性、特异性的比较。30例卵巢癌患者中,血清OPN检测阳性24例,阳性率80.0%;血清CA125检测阳性23例,阳性率76.7%;B超检测阳性22例,阳性率73.3%;三者联合检测阳性29例,阳性率96.7%。
在本实验中,OPN的敏感性为80.0%,CA125检测卵巢癌的敏感性76.7% ,B超检查的敏感性为73.3%,OPN+CA125+B超联合检测的敏感性为96.7%,OPN+CA125+B超联合检测较 CA125、OPN及B超单独检测敏感性高(P<0.05,见表2)。同时统计分析发现三者联合检测与单独检测间特异性无统计学差异(P>0.05,见表2)。
表1 卵巢肿瘤患者血清OPN、CA125变化(±s)Tab 1 Serum levels of OPN and CA125 in ovarian cancer(±s)
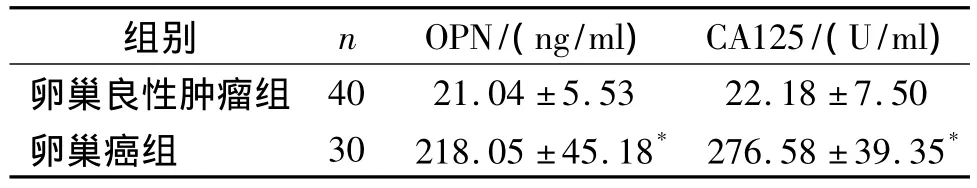
表1 卵巢肿瘤患者血清OPN、CA125变化(±s)Tab 1 Serum levels of OPN and CA125 in ovarian cancer(±s)
与卵巢良性肿瘤组比较,*P<0.01
卵巢癌组 30 218.05±45.18 276.58±39.35
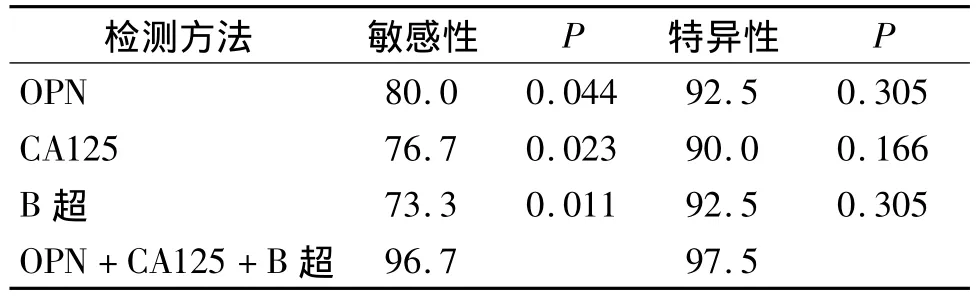
表2 卵巢癌三种检测方法的敏感性和特异性 (%)Tab 2 Sensitivities and specialites of three detection methods for ovarian cancer (%)
3 讨论
女性一生罹患卵巢癌的几率大约为1.4%(或1/70),目前还未寻找出早期诊断卵巢癌的有效方法[6]。如何提高卵巢癌的早期诊断及早期处理,已成为改善卵巢癌患者生存质量的关键。目前临床上检测卵巢癌的方法有限,常用的检测指标如CA125等,因其敏感性及特异性不高,单独诊断卵巢癌有一定的局限性。已有学者们研究发现几种肿瘤标志物联合检测可提高卵巢癌早期诊断的阳性率[7-8]。因此,寻求多种方法联合检查,有助于卵巢癌的早期诊断。B超检查在盆腔附件肿块的检查中具有非常重要作用。通过彩色多普勒超声检查,能确定卵巢及其新生组织血流变化,根据所测卵巢的大小、形态、血流和血管分布早期发现卵巢病变,有助于诊断。尤其经阴道超声,探头接进盆腔内结构,可应用较高频率的探头,图像质量得到明显改进,有利于小病变及血流的检出。在恶性肿瘤中,因新生血管形成比较多,多普勒检查的搏动指数(PI)及阻力指数(RI)检测对直径>2 cm卵巢肿瘤有一定诊断意义,但对<2 cm卵巢肿瘤的筛查有效性还不明确[9]。本实验组30例卵巢癌患者经B超诊断22例,敏感度为73.3%,特异度为92.5%。由此可见超声诊断必须紧密结合病史及其他实验室检查,以减少漏诊及误诊。CA125是存在于胚胎发育过程体腔上皮细胞的大分子糖蛋白。卵巢癌患者CA125可以进入体循环,通过检测患者血清中CA125的含量,可以作为卵巢癌临床诊断的一种指标[10]。目前临床上检测易产生假阳性,主要原因是因为在许多良性病变如子宫内膜异位症、子宫肌瘤、盆腔炎、良性卵巢囊肿、早期妊娠、结核性腹膜炎及有腹水或胸水的良恶性病变如肝硬化、胰腺癌、乳腺癌、膀胱癌、肝癌和肺癌均可导致CA125升高。生理条件下,如月经期或妊娠期也会有CA125水平的升高[11],因此其不能单独作为早期筛查的指标。另外CA125与浆液性卵巢癌密切相关,而与黏液性等其他卵巢肿瘤则不相关[12],使其应用具有一定的局限性。尚需进一步寻找新的卵巢癌早期预警或者诊断的生物学指标。
OPN是一种分泌型钙结合磷酸化糖蛋白,与许多肿瘤的发生、发展、转移、预后有关[13,14]。大量实验证明,OPN广泛表达于人体不同肿瘤组织并参与肿瘤的形成,在恶性肿瘤患者的肿瘤组织和血液中的表达水平高,与肿瘤患者的筛选、病情预测和预后判断方面有着重要的联系[15,16]。OPN 作为肿瘤转移机制的重要参与者,可作为卵巢癌的新的标志物用于卵巢癌的早期诊断和病情预测,其在卵巢癌中的表达、外周血浓度及受体水平,均可作为无创性肿瘤筛查的指标。
卵巢癌公认的标志物是CA125,但用于早期诊断和监测预后时敏感性和特异性较低。因此目前倾向于采用多种血清肿瘤标志物联合检测,以提高诊断的特异性和灵敏性。Schorge等[17]研究发现90%的复发性卵巢癌中的OPN升高先于CA125(平均领先3个月)。因此有学者认为,OPN在监测复发性卵巢癌方面可能是CA125的有益补充[18]。本实验研究OPN在卵巢癌患者血清中的表达情况,同时联合检测CA125,以期寻找临床上早期诊断卵巢癌并判断其预后的可靠指标。同时联合B超检查有望提高卵巢癌的早期筛查率。
由于卵巢癌无典型症状及临床表现,且位于盆腔深部,一般的检查方法难于发现。目前还未找到特异性和敏感性均高的能作为卵巢癌筛查的满意指标。在本实验中,CA125检测卵巢癌的敏感性76.7%,OPN的敏感性为80.0%,B超检查的敏感性为73.3%,CA125联合 OPN检测的敏感性为86.7%,OPN+CA125+B超联合检测的敏感性为96.7%;OPN+CA125+B超联合检测较 CA125、OPN及B超单独检测敏感性高(P<0.05)。同时统计分析发现三者联合检测与单独检测间特异性无统计学差异(P>0.05)。说明联合检测 CA125和OPN可以提高卵巢癌的诊断率。血清OPN、CA125检测及B超检查对于诊断卵巢癌均有一定的价值,但也有各自的局限性。三者联合应用可减少漏诊和误诊,提高术前诊断的阳性率,对医生的治疗也有更进一步的帮助。所以,可以认为血清OPN、CA125检测及联合B超检查有可能进一步早期诊断卵巢癌,且方便经济无创,是理想可行的诊断方法。
[1]Sood AK,Abu-Rustum NR,Barakat RR,etal.Fifth international conference on ovarian cancer:challenges and opportunities[J].Gynecol Oncol,2005,97(3):916-923.
[2]Whitehouse C,Solomon E.Current status of the molecular characterization of the ovarian cancer antigen CA125 and implications for its use in clinical screening[J].Gynecol Oncol,2003,88(12):152-157.
[3]Wai PY,Kuo PC.The role of osteopontin in tumor metastasis s[J].J Surg Res,2004,121(2):228-241.
[4]Marroquin CE,Downey L,Guo H,etal.Osteopontin increases CD44 expression and cell adhesion in RAW 264.7 murine leukemia cells[J].Immunol Lett,2004,95(1):109-112.
[5]Zohar R,Suzuki N,Suzuki K,etal.Intracellular osteopontin is an inte-gral component of the CD44-ERM complex involved in cell migration[J].Cell Physiol,2000,184(1):118-130.
[6]Jemal A,Siegel R,Ward E,etal.Cancer statistics,2008[J].CA Cancer J Clin,2008,58:71-96.
[7]Kim K,Visintin I,Alvero AB,etal.Development and validation of a protein-based signature or the detection of ovarian cancer[J].Clin Lab Med,2009,29:47-55.
[8]Lu D,Kuhn E,Bristow RE,etal.Comparison of candidate serologic markers for type Ⅰ and type Ⅱ ovarian cancer[J].Gynecol Oncol,2011,122(3):560-566.
[9]Testa AC,Ajossa S,Ferrandina G,etal.Does quantitative analysis of three-dimensional power Doppler angiography have a role in the diagnosis of malignant pelvic solid tumors?A preliminary study[J].Ultrasound Obstet Gynecol,2005,26(1):67-72.
[10]MeierW,BaumgartnerL,Stieber P,etal.CA125 based diagnosis and therapy in recurrent ovarian cancer[J].Anticancer Res,1997,17(4B):3019-3020.
[11]栾晓蕊.卵巢癌早期诊断的血清肿瘤标记物研究进展[J].国际妇产科学杂志,2009,36(6):458-461.
[12]Van Altena AM,de Hullu JA,Massuger LF.CA 125 expression pattern,prognosis and correlation with serum CA 125 in ovarian tumor patients[J].Gynecol Oncol,2007,107(2):355-356.
[13]Hirana M,Takahashi F,Takahashi K,etal.Osteopontin overproduced by tumor cells acts as a potent angiogenic factor contributing to tumor growth[J].Cancer Lett,2003,198(2):107-117.
[14]Hwang J,Na S,Lee H,etal.Correlation between preoperative serum levels of five biomarkers and relationships between these biomarkers and cancer stage in epithelial ovarian cancer[J].JGynecol Oncol,2009,20(3):169-175.
[15]Koopmann J,Fedarko NS,Jain A,etal.Evaluation of osteopontin as biomarker for pancreatic adenocarcinoma[J].Cancer Epidemiol Biomarkers Prev,2004,13(3):487-491.
[16]Boldrini L,Donati V,DellO'modarme M,etal.Prognostic significance of osteopontin expression in early-stage non-small-cell lung cancer[J].Br J Cancer,2005,93(4):453-457.
[17]Schorge JO,Drake RD,Lee H,etal.Osteopontin as an adjunct to CA125 in detecting recurrent ovarian cancer[J].Clin Cancer Res,2004,10(10):3474-3478.
[18]Ye B,Skates S,Mok SC,etal.Proteomic based discovery and characterization of glycosylated eosinophil derived neurotoxin and COOH terminal osteopontin fragments for ovarian cancer in urine[J].Clin Cancer Res,2006,12(2):432-441.
