Fas/FasL途径在海水诱导大鼠肺组织细胞凋亡中的作用
2012-11-20李艳燕刘中洋金发光
韩 峰, 罗 颖, 李艳燕, 刘中洋, 金发光*
(1第四军医大学唐都医院呼吸内科, 西安 710038;2第四军医大学基础部病理与病理生理学教研室;*通讯作者,E-mail:jinfag@fmmu.edu.cn)
淹溺是全世界重要的公共卫生研究课题,而海水淹溺更是海战、海难和海上作业的意外死亡主要原因之一。海水具有复杂的化学成分和高渗特性,海水淹溺所致急性肺损伤(seawater drowning-induced acute lung injury,SWD-ALI)致伤重、病情进展快[1]。淹溺发生后,肺血管-上皮屏障功能丧失继而导致低氧血症和酸中毒是SWD-ALI肺损伤的主要原因,肺泡上皮和内皮细胞的损伤程度决定病情的进展和疾病的预后。近年来,越来越多的研究表明,上皮细胞和内皮细胞凋亡是急性肺损伤重要的致病机制[2]。本实验旨在通过建立海水淹溺动物模型,观察凋亡有关指标的变化,探讨海水是否通过Fas/FasL途径导致肺组织细胞凋亡,为临床治疗提供一定的理论依据。
1 材料与方法
1.1 实验动物 180-220 g雄性 Sprague-Dawley(SD)大鼠24只(第四军医大学实验动物中心提供),随机分为3组:正常对照组、2 h海水组和4 h海水组,每组各8只。
1.2 主要试剂 Fas、FasL抗体购自美国Abcam公司,caspase-3抗体购自美国Bioworld公司,辣根过氧化物酶标记的兔抗鼠二抗(武汉博士德公司),AnnexinⅤ-FITC/PI试剂盒(美国BD公司),ECL增强化学发光剂(美国Pierce公司)。人工海水根据中国国家海洋局第三海洋研究所海洋生化研究室提供的我国东南沿海海水主要成分配制[3]:NaCl 26.518 g/L,MgSO43.305 g/L,MgCl22.447 g/L,CaCl21.141 g/L,NaHCO30.202 g/L,KCl 0.725 g/L,NaBr 0.083 g/L;pH 8.2,相对密度 1.05,渗透压 1 300 mmol/L。其他试剂均为国产或进口分析纯。
1.3 动物模型制备 参照文献[4]方法并给予适当调整:20%乌拉坦5 ml/kg腹腔注射麻醉,麻醉后仰卧固定大鼠于动物手术台上。2个海水处理组大鼠使用1 ml注射器轻插入气管至隆突1.5-2 cm处,大鼠头侧与桌面保持约30°角,在4 min内匀速注入海水(4 ml/kg)。于海水致肺损伤2 h,4 h将大鼠处死,迅速开胸提取标本。
1.4 肺湿干比检测 取大鼠左肺,吸干表面水分和血液后准确称湿重,置60℃烤箱内72 h称干重,计算肺组织湿干重比值(W/D)。
1.5 肺组织形态学观察 取右上肺组织于4%甲醛中予以固定,经脱水、透明,常规石蜡包埋切片,HE染色,光镜下观察肺组织病理学变化。
1.6 流式细胞仪检测肺组织细胞凋亡 取部分右肺下叶组织后立即制备成单细胞悬液,1 000×g离心5 min,弃上清,重悬细胞,然后用 AnnexinⅤ-FITC及PI染色,流式细胞仪上机分析检测细胞凋亡率。
1.7 Western blotting检测 Fas、FasL 和caspase-3 蛋白表达 大鼠右肺下叶制备组织匀浆,常规裂解提取蛋白,12%聚丙烯酰胺凝胶电泳,PVDF半干法转膜,10%脱脂奶粉室温封闭,然后分别加入Fas抗体(1∶300)、FasL 抗体 (1∶300)、caspase-3 抗体(1∶500)及内参 β-actin 抗体(1∶5 000),4 ℃ 过夜。TBST摇床洗膜,再加入辣根过氧化物酶标记的二抗(1∶5 000)室温下孵育2 h,增强化学发光法(ECL)显色,胶片显影和定影。将胶片进行扫描,利用凝胶图像分析系统检测各目标条带的灰度值,并计算目的蛋白与β-actin的灰度比。
1.8 统计学分析 采用SPSS13.0统计软件进行实验数据分析。数据以±s表示,多组间比较采用单因素方差分析,组间两两比较采用Dunnett-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 肺组织W/D检测结果 2 h和4 h海水组W/D比值显著高于正常对照组,差异有统计学意义(见表1)。
表1 各组大鼠肺组织W/D比值(±s)Tab 1 Comparison of lung wet-to-dry weight ratio among three group(±s)
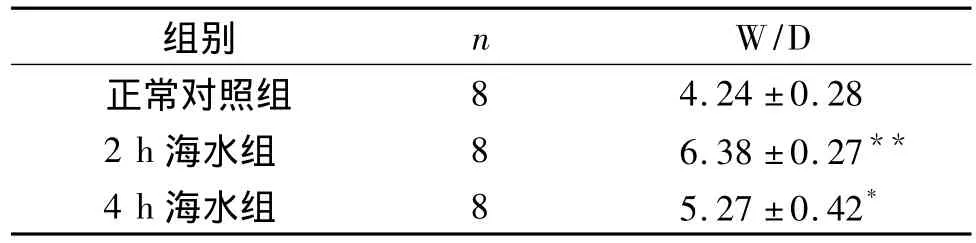
表1 各组大鼠肺组织W/D比值(±s)Tab 1 Comparison of lung wet-to-dry weight ratio among three group(±s)
与正常对照组比较,**P<0.01,*P<0.05
4 h海水组 8 5.27±0.42*
2.2 肺组织病理变化 镜下见正常对照组大鼠肺组织正常,结构清晰,肺泡腔及间质内仅见少量炎性细胞;2个海水处理组肺组织结构紊乱,肺泡间隔增厚,肺泡腔出血和渗出,炎性细胞浸润,且4 h海水组比2 h海水组病理变化更为明显(见图1,见第239页)。
2.3 肺组织细胞凋亡分析 流式结果显示,海水致肺损伤后,与正常对照组相比,2个海水处理组细胞凋亡率显著增高,差异有统计学意义(P<0.01,见图2和表2)。
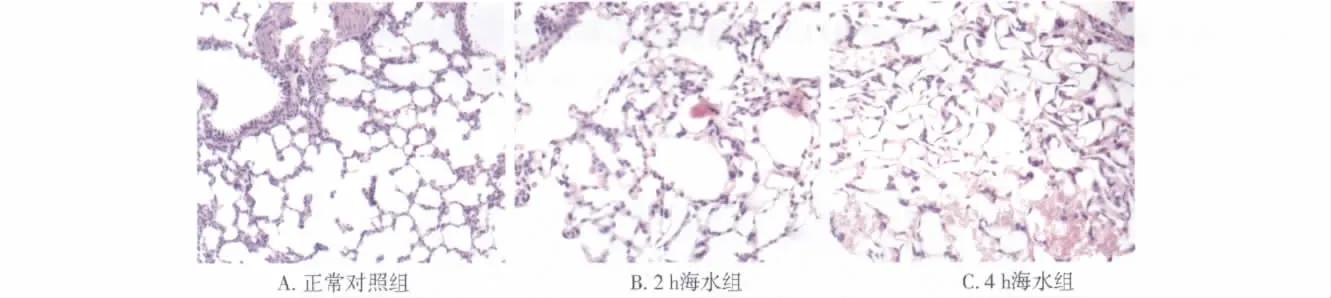
图1 大鼠肺组织病理学变化(HE染色,×200)Fig 1 Morphological changes of rat lung tissue in three groups(HE staining,×200)
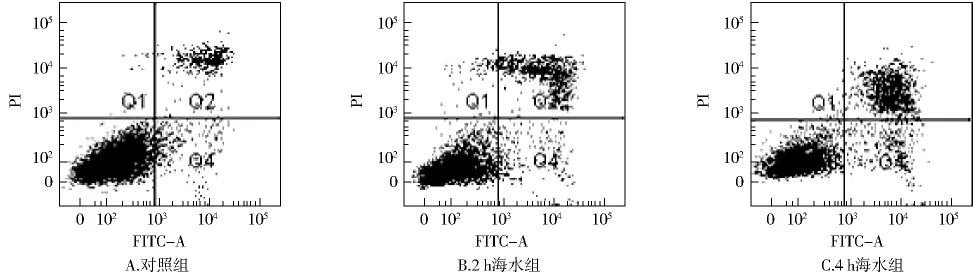
图2 流式细胞术检测各组大鼠肺组织细胞凋亡率Fig 2 Cell apoptosis rate of lung tissues in rats by FCM
表2 各组大鼠肺组织细胞凋亡率变化(±s)Tab 2 Changes of lung tissue cell apoptosis rate in the rats of each group(±s)

表2 各组大鼠肺组织细胞凋亡率变化(±s)Tab 2 Changes of lung tissue cell apoptosis rate in the rats of each group(±s)
与正常对照组比较,*P<0.01
2 h海水组 8 21.2±1.74 4 h海水组 8 29.3±2.25*
2.4 肺组织Fas、FasL和caspase-3蛋白表达的变化
海水干预后,大鼠肺组织中 Fas、FasL和活化caspase-3蛋白表达明显升高,表明海水确实可以引起大鼠肺组织Fas、FasL和活化caspase-3蛋白表达上调,见图3和表3。

图3 Western blotting检测Fas、FasL和caspase-3蛋白表达Fig 3 Expression of Fas,FasL and caspase-3 examined by Western blotting
表3 各组大鼠肺组织Fas、FasL和caspase-3蛋白表达的变化(±s)Tab 3 Protein expression of Fas,FasL and caspase-3 in the rat lungs(±s)

表3 各组大鼠肺组织Fas、FasL和caspase-3蛋白表达的变化(±s)Tab 3 Protein expression of Fas,FasL and caspase-3 in the rat lungs(±s)
与正常对照组比较,**P<0.01,*P<0.05
4 h海水组 1.150±0.097** 1.263±0.137** 0.973±0.151**
3 讨论
急性肺损伤(acute lung injury,ALI)是由直接或间接损伤因素引起的临床综合征,肺组织细胞凋亡与ALI的发生有着密切的关系。SWD-ALI作为一种特殊的急性肺损伤,在发病机制上与其他类型的ALI相似。本实验以大鼠为模型,通过病理学观察、流式细胞术及Western blotting等方法证实海水可导致肺组织细胞凋亡,凋亡的诱导与Fas/FasL信号途径有关。
ALI病理生理学机制非常复杂,其组织学上以肺内皮和上皮细胞损伤、中性粒细胞浸润、透明膜形成和肺泡水肿及出血为特征[5]。SWD-ALI主要是肺泡Ⅰ型和Ⅱ型上皮和肺毛细血管内皮细胞受损,肺间质水肿,造成肺通气和弥散障碍,发生低氧血症和代谢性酸中毒[6]。本实验中2个海水处理组肺组织湿干重比值(W/D)明显增加,说明海水灌注可造成大鼠肺水肿;HE染色结果表明,海水注入大鼠肺内后,2 h时已造成严重的肺组织损伤,随着时间的推移,这种损伤进行性加重,4 h时较前更加显著,说明只要海水刺激存在,肺组织病理学改变将不可逆地持续发生。
凋亡(apoptosis)是指细胞自杀机制被活化而引发的一种以细胞固缩为主要形态学改变的程序性细胞死亡。细胞凋亡参与了ALI的发病过程。ALI的发病机制涉及两种与凋亡有关的理论,包括上皮细胞的过度凋亡、中性粒细胞的聚集和凋亡延迟[5],而上皮的凋亡可能对ALI的病情发展具有基础性作用和决定性的影响。本实验流式结果显示,SWDALI发生时,肺组织细胞凋亡明显增加,且与海水作用时间和肺组织病理学变化平行,说明海水对肺组织的损伤与细胞凋亡密切相关。
细胞凋亡通过外源性的死亡受体通路和内源性的线粒体通路激活[7]。研究表明,死亡受体通路在ALI的发生发展中起着至关重要的作用[8]。Fas属于肿瘤坏死因子超家族成员,FasL是Fas的天然配体,二者结合可以形成凋亡诱导复合物,启动凋亡信号的转导,活化caspase-8,引起细胞凋亡。本实验结果显示,海水导致大鼠肺组织细胞凋亡的同时,Fas和FasL蛋白表达较正常对照组明显增加,并且随海水暴露时间的延长更为显著。caspase-3是细胞凋亡过程中最关键的执行分子之一[9],我们的实验同样发现,在海水干预后,大鼠肺活化caspase-3的蛋白表达也是增加的,且4 h时比2 h显著。以上这些分子的变化趋势与流式检测的细胞凋亡率变化是完全一致的。因此,本实验证实,Fas/FasL介导的死亡受体信号途径的调控是肺组织细胞凋亡的重要分子机制。
综上所述,本研究初步探讨了SWD-ALI的发病机制与凋亡之间的关系,为从细胞凋亡入手对SWD-ALI进行干预和治疗提供了新的解释。但由于生物体的复杂性,关于SWD-ALI时细胞凋亡的确切机制还有待进一步深入研究。
[1]段蕴铀,张新红.海水淹溺型急性肺损伤的研究现状[J].解放军医学杂志,2009,34(7):812-814.
[2]Lu Q,Harrington EO,Rounds S.Apoptosis and lung injury[J].Keio JMed,2005,54(4):184-189.
[3]段蕴铀,胡慧军,潘晓雯,等.不同氧疗方式对兔海水淹溺肺水肿的治疗作用[J].中国急救医学,2004,24(5):339-342.
[4]Ding X,Duan Y,Peng C,etal.Dexamethasone treatment attenuates early seawater instillation-induced acute lung injury in rabbits[J].Pharmacol Res,2006,53(4):372-379.
[5]Galani V,Tatsaki E,Bai M,etal.The role of apoptosis in the pathophysiology of Acute Respiratory Distress Syndrome(ARDS):An up-to-date cell-specific review[J].Pathol Res Pract,2010,206(3):145-150.
[6]王关嵩,张志远,钱桂生.溺海肺损伤的发病机制和治疗的研究进展[J].中国急救医学,2008,28(3):262-266.
[7]Khosravi-Far R,Esposti MD.Death Receptor Signals to Mitochondria[J].Cancer Biol Ther,2004,3(11):1051-1057.
[8]Matsuda N,Yamamoto S,Takano K,etal.Silencing of fas-associated death domain protects mice from septic lung inflammation and apoptosis[J].Am JRespir Crit Care Med,2009,179(9):806-815.
[9]De Paepe ME,Mao Q,Chao Y,etal.Hyperoxia-induced apoptosis and Fas/FasL expression in lung epithelial cells[J].Am J Physiol Lung Cell Mol Physiol,2005,289(4):L647-659.
