新型杯[5]芳烃衍生物的合成及发光行为
2012-11-20赵玉亮狄崇慧刘雪静
赵玉亮,狄崇慧,刘雪静
(枣庄学院 化学化工与材料科学学院,山东 枣庄 277160)
0 引言
杯芳烃及其衍生物与稀土配合物的荧光特性因在荧光免疫分析和发光材料开发上有着广泛的应用前景而倍受重视[1,2].迄今为止,人们合成的能够敏化稀土离子发光的杯芳烃衍生物可分为两大类:一类是非水溶性的[3~7],这些杯芳烃只能在有机溶剂体系中敏化稀土的荧光,限制了其在分析化学等领域的应用;另一类是以磺化杯芳烃为代表的水溶性杯芳烃衍生物[8~10],可以在水溶液中与稀土离子形成高效能量传递的发光体系,但由于分子中磺酸基的影响,使进一步修饰受到一定的限制.本文考察了乙酸修饰的杯芳烃衍生物L在水溶液中与稀土铽(Ⅲ)离子形成配合物的荧光行为.结果表明,L在水中有一定的溶解度,并且能够与铽(Ⅲ)离子进行有效的能量传递,形成发光体系;L在较宽的pH范围内荧光强度几乎不变.因此,该体系在分析化学领域具有潜在的应用价值.杯芳烃衍生物的合成路径如下.
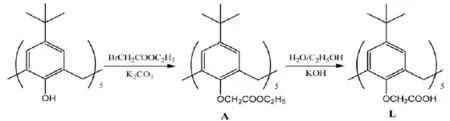
1 实验部分
1.1 试剂
化合物A由文献[11]方法合成,经熔点、核磁共振、质谱分析确证.
L的合成:在125mL三口烧瓶中加入1.0克(0.8 mmol)化合物 A、1.12克(20 mmol)氢氧化钾及50mL乙醇:水(1:1,V/V);加热回流4小时;冷却后向体系中缓慢加入40mL 5%HCl,过滤;沉淀用水洗涤,干燥后用丙酮/水重结晶,得针状晶体0.79克(90%).ESI-Msm/z:1099.83(M-);元素分析 理论 C65H80O15:H,7.32%,C,70.89%,实测:H,7.31%,C,70.91%;1H NMR(CDCl3)δ:1.06(单峰,45H),3.41(单峰,10H),4.46(单峰,10H),7.0(单峰,10H).
稀土硝酸盐由质量分数为99.99% 的氧化稀土与稀硝酸反应制备,稀土含量由EDTA标定;在硼砂2盐酸缓冲溶液中测定稳定常数,用KNO3调节离子强度.
1.2 仪器
Shimadzu UV 22401 PC紫外2可见分光光度计;JASCO FP2750荧光分光光度计,激发和发射狭缝宽均为10nm;pHS2P I酸度计.
2 结果与讨论
2.1 L与Tb3+配合物的荧光行为
按1∶1的L与Tb3+摩尔比配制配合物的水溶液,用盐酸和氢氧化钠溶液调节溶液的pH值.在278 nm最大波长激发下记录不同pH值时Tb3+在491nm的荧光发射强度,结果如图1所示.从图1可以看出,L·Tb3+配合物在pH<4时荧光很弱;当pH在4~8时,荧光强度发

图1 溶液pH值对L·Tb3+配合物荧光行为的影响Fig.1 Effect of pH on the fluorescence intensity of L·Tb3+[L]= [Tb3+]=1 ×10-5mo l/L;Ex=278 nm;Em=491 nm.
生突跃性的变化,当pH在8~10之间其荧光强度几乎不变;当 pH>10时,荧光强度迅速下降.这一现象显然与羧基上质子的解离程度有关,在pH值很低时,杯芳烃下沿5个羧基主要以-CH2COOH形式存在,羧基上的氧原子与Tb3+配位能力很弱;在pH>4时,羧基逐步解离以-CH2COO-形式存在,5个带负电荷的氧原子以及与杯芳烃骨架相连的5个氧原子均可以与Tb3+配位,从而形成有效的能量传递,体系荧光强度迅速增大,至pH>8时溶液中L完全解离为-CH2COO-形式,与Tb3+配合物浓度不再随pH增加而增大,使得荧光强度基本保持不变;当pH>10时,溶液中OH-的竞争使与L配位的Tb3+数量剧减,甚至生成Tb(OH)3沉淀,体系荧光迅速下降.
为确定L与Tb3+的络合比,用Job’s连续变量发测定了配合物的摩尔比,如图2所示.

图2 Job连续变量法测定L与Tb3+配位比Fig.2 A Job plot of the complex of L with Tb3+in aqueous solution[L]+[Tb3+]=1 ×10-5mo l/L,Ex=278 nm;Em=491 nm;pH=9
从图中可以看出L与Tb3+形成的是1:1的配合物,这一结果与乙酸修饰的磺化杯[4]芳烃[9]相一致;参照文献[3]方法,以 278nm 波长激发,考察 L·Tb3+配合物在甲醇中的荧光发射光谱,结果如图3中 A所示,在491、546、587、620nm出现特征荧光发射光谱,分别对应于 Tb3+的5D4→7F5、5D4→7F6、5D4→7F4、5D4→7F3跃迁,其中以 546nm 处的强度最大;保持L和Tb3+的浓度不变,逐渐增加溶剂中水的比例,发现随着水的加入,体系的荧光强度急剧下降,这是由于Tb3+发生f→f* 电子跃迁时,溶剂化层中的水分子对Tb3+的能量具有吸收作用,使Tb3+发光的量子产率减小,荧光寿命缩短,强度降低;当水的含量大于20%,体系的荧光强度相对保持稳定,变化较小;同时水二级瑞利散射也随之增强,当水的含量为20%时,可以观察到Tb3+于546nm的特征光谱与水分子二级瑞利散射形成的肩峰;当水的含量大于30%,546nm的特征光谱完全观察不到;而L·Tb3+配合物的水溶液的荧光光谱,几乎观察不到546、587、620nm处的特征峰.

图3 溶剂对L·Tb3+配合物荧光行为的影响Fig.3 spectra of emission of L·Tb3+in different solventA:[L]= [Tb3+]=5 ×10-6mol/L in MeOH B:[L]= [Tb3+]=1 ×10-5mol/L in H2O
2.2 L·Tb3+配合物的稳定性
在pH=9的缓冲溶液中,保持L2的浓度为1×10-5mol/L,随着Tb3+浓度的增加,溶液在270nm和278nm处的吸光度随之增加,最后达到一稳定平台,如图4所示;根据曲线拟合[12]得到配合物的稳定常数LogKs=4.60,利用荧光滴定方法获得的稳定常数与之很好地吻合.据此稳定常数计算,当溶液中L2和Tb3+的浓度均为1×10-5mol/L时,形成配合物的浓度仅为2.5×10-6mol/L;而Tb(OH)3的Ksp=2.2×10-22;因此,当溶液的pH值增大到8.5时,OH-开始与Tb3+配位,溶液处于两种配体配位竞争的平衡中;而当pH>10时,OH-在这一平衡中占优势,L和Tb3+形成配合物的浓度随pH上升而下降,表现为体系的荧光迅速减弱.与乙酸修饰的磺化杯[4]芳烃[9]相比,前者在弱碱性水溶液中,上缘的磺酸基以负离子形态存在,负电荷之间强烈的排斥作用造成分子构象发生改变,下缘由8个氧原子构成的配位空腔被压缩,氧原子于Tb3+更接近,有利于配位键的形成和能量的传递;因而前者与Tb3+形成的配合物更稳定,其水溶液荧光更强.

图4 L(1×10-5mol/L)与不同浓度Tb3+作用时溶液的吸光度Fig.4 The absorption spectra of L(1 ×10-5mol/L)in the presence of various concentrations of Tb3+a—k[Tb3+]×105mo l/L:0,0.1,0.3,0.5,2,4,10,20,30,50,80.pH=9
以278nm激发L·Eu3+水溶液,并没有检测到Eu3+特征荧光,这与稀土离子d轨道的能级有关;向体系中添加与Eu3+能级相匹配的邻菲邻菲罗啉,用邻菲罗林的最大吸收波长321nm激发,同样没有检测到 Eu3+特征荧光.当改用乙腈作溶剂进行相同的实验时,检测到Eu3+特征荧光,如

图5 L·Eu3+配合物在乙腈中的发射光谱Fig.5 spectra of emission of L·Eu3+in CH3CN
图5中B所示;位于596,620处出现了2个强度不同的发射峰,分别属于Eu3+离子的5D0→7F1和5D0→7F2跃迁;控制实验显示,体系中不含L或邻菲罗林都检测不到Eu3+特征荧光;至于在溶液中邻菲罗林与Eu3+的作用方式及能量传递途径,需要进一步的研究来确证.
[1]李文连.稀土有机配合物发光研究的新进展[J].化学通报,1991,(8):3-11.
[2]Sabbatini N.,Guardigli M.,M ecati A.et al..Encapsulation of lanthanide ions in calixarene receptors.A strongly luminescent terbium(3+)complex[J].J.Chem.Soc.,Chem.Commun.,1990:878-879.
[3]Steemers F.J. ,Mori S. ,Reinhoudt D.N.et al..New Sensitizer-Modified Calix[4]arenes Enabling Near-UV Excitation of Complexed Luminescent Lanthanide Ions[J].J.Am.Chem.Soc.,1995 ,117:9408 -9414.
[4]Liu Y.,Zhang N. ,Zhao B.T.et al..Spectroscopic behavior on the formation complex of three double - armed calix[4]arene derivatives with lanthanoid nitrates in acetonitrile[J].Spectrochimica Acta Part A ,2002 ,58:2889-2895.
[5]Hebbink G.A.,Klink S.I.,Alink P.G.B.O.et al..Visible and near- infrared light emitting calix[4]arene - based ternary lanthanide complexes[J].Inorganica Chimica Acta,2001,317:114-120.
[6]Dutton P.J.,Conte L..Terbium Luminescence in Langmuir?Blodgett Films of Octafunctionalized Calix[4]resorcinarenes[J].Langmuir,1999,15,613-617.
[7]Ziessel R.,Charbonniere L.J..Lanthanide probes for luminescence microscopy and anion sensing[J].Jounal of Alloys and Compounds,2004,374:283 -288.
[8]Steemers F.J.,Meuris H.G.,Verboom W.et al..Reactions of N-(Ethoxycarbonyl)-3-halo-3-(halomethyl)azetidines with DBU.The Halogen Dance[J].J.Org.Chem. ,1997 ,62:4229-4234.
[9]张宁,赵邦屯,刘育.水溶性杯[4]芳烃衍生物与稀土铽[Ⅲ]离子形成配合物的荧光行为[J].高等学校化学学报,2002.23(8):1533-1535.
[10]Zhanga N.,Tanga S.H.,Liu Y..Luminescence Behavior of A Water Soluble Calix[4]arene Derivative Complex with Terbium Ion(III)in Gelation Solution[J].Spectrochimica Acta Part A ,2003,59:1107-1112.
[11]Arnaud - Neu F.,Fuangswasdi S.,Notti A.et al.Angew.Calix[5]arene - Based Molecular Vessels for Alkylammonium Ions[J].Chem.Int.Ed.,1998,37(1/2):112 -114.
[12]尤长城,赵彦利,刘育.竞争包结法研究β-环糊精及其两种衍生物对一些手性脂肪族客体分子的识别作用[J].高等学校化学学报,2001,22(2):218-222.
