金莲花中荭草苷和牡荆苷对D-半乳糖致衰老小鼠肝、肾、脑组织的抗氧化作用
2012-11-20袁丹华屈海琪杨国栋王书华河北北方学院药学系河北张家口075000
袁丹华 屈海琪 蒋 伟 杨国栋 安 芳 王书华 (河北北方学院药学系,河北 张家口 075000)
金莲花是毛茛科植物金莲花的干燥花及花蕾,有清热解毒,消肿明目的功效,临床上主要用于上呼吸道感染、扁桃体炎、急性肠炎、泌尿系统感染等。现代药理研究发现金莲花主要有效成分为黄酮类化合物〔1〕,前期研究表明,金莲花黄酮中含量较高的是荭草苷和牡荆苷〔2〕,金莲花总黄酮及其单体荭草苷和牡荆苷具有体外抗氧化、抑菌、抗肿瘤等作用〔3~6〕,药代动力学研究表明荭草苷与牡荆苷在不同种属动物组织的分布均没有差异,肾脏中浓度最高,其次是肝,脑中含量最少〔7,8〕。有关金莲花黄酮荭草苷和牡荆苷的体内抗氧化作用尚未见报道,通过比较荭草苷和牡荆苷的体内抗氧化作用,以期筛选出抗衰老作用最佳药物的构效关系,为抗衰老药物的研究提供新的动力。
1 材料与方法
1.1 药品和试剂 野生金莲花采自河北省张家口沽源,经我院药物研究所鉴定为短瓣金莲花 ;荭草苷和牡荆苷(自制,经1H-NMR和HPLC鉴定纯度98.9%);D-半乳糖(D-gal),分析纯,上海试一化学试剂有限公司;牛血清蛋白,分析纯,郑州益康有限公司;硫酸奎宁,分析纯,上海齐奥化工有限公司;5,5-双硫代对硝基苯甲酸,分析纯,上海试一化学试剂有限公司;还原性谷胱甘肽,纯度≥99%,国药集团化学试剂有限公司;磷酸钠,分析纯,天津化工有限公司;钼酸铵,分析纯,天津化工有限公司邻苯三酚,分析纯,上海邦辰试剂有限公司;生理盐水,石家庄第四制药厂;超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶GSH-Px、丙二醛(MDA)测定试剂盒,均购买自南京建成生物工程研究所。
1.2 动物 健康的昆明种小鼠120只(雌雄各半),河北北方学院动物中心提供(许可证号:SCXK京2004-0001),分笼饲养,室温18~25℃。
1.3 仪器 U-3900紫外可见分光光度计(日本);ME235S十万分之一电子天平(日本);DK-8型电热恒温水槽(上海精密实验设备有限公司);低温高速离心机(赛多利斯公司);HQ-60型旋涡混合器(北方同正生物技术发展公司)。
1.4 实验方法
1.4.1 造模方法 采用D-gal致亚急性衰老法,正常组注射等体积生理盐水,造模时间为8 w,每天称重1次,依据末次称重的克数调整给药剂量。
1.4.2 模型验证 造模第6周和第8周分别选取正常组和造模组小鼠(备用)8只,摘眼球采血,分离血清,测定总抗氧化能力(T-AOC)、SOD含量,以验证小鼠衰老情况。第8周末,造模组小鼠指标与正常组相比具有统计学意义,显示模型复制成功。
1.4.3 药物配制 荭草苷和牡荆苷溶液的配制:N,N-二甲基甲酰胺∶吐温-80∶生理盐水 =1∶1∶20。
1.4.4 给药与分组 造模成功后,实验分为模型组、正常组、维生素E对照组、荭草苷和牡荆苷高、中、低各三个剂量组,各治疗组从第9周开始每日上午分别口服灌胃给药,模型组和正常组给等体积的生理盐水,每日一次。确定荭草苷和牡荆苷高、中、低剂量分别为 40、20、10 mg/kg,维生素 E 对照组每日20 mg/kg。每日称重一次,依据小鼠每次的体重调整给药剂量,给药时间8 w。
1.5 观察指标与方法
1.5.1 小鼠一般状态的观察 观察各组小鼠一般状态,如摄食、饮水情况、体重、活动度、毛色、光泽度变化等方面,并相互进行比较。
1.5.2 小鼠组织中 SOD、CAT、GSH-Px、MDA的测定 给药8 w后小鼠断头处死,冰浴条件下迅速取出肾、肝、脑组织,精确称量,用生理盐水制成10%的组织匀浆液,离心得上清液。取1.0 ml的上清液,加入1.0 ml乙醇-氯仿混合液,震荡2 min,4 000 r/min离心5 min以除去蛋白质,取上清液按试剂盒说明操作,测定SOD、CAT、GSH-Px的活性及MDA。
2 结果
2.1 金莲花中荭草苷和牡荆苷对D-gal致衰老小鼠一般形态的影响 正常组小鼠饮食正常,活泼好动、毛发光亮、浓密,皮肤弹性良好。模型组小鼠在造模后,逐渐表现出少动,行动迟缓,喜蜷缩,毛色发黄,尤其是腹部毛发逐渐变得无光泽、稀疏并渐有脱毛现象,皮肤松弛,弹性下降。而各治疗组在服用相应的药物后,总体状态好于模型组。
2.2 荭草苷和牡荆苷对D-gal致衰老小鼠肾肝脑组织中SOD、CAT、GSH-Px、MDA的影响结果 见表1、表2。与正常组相比,模型组小鼠肾、肝、脑组织中SOD、CAT、GSH-Px含量明显降低,MDA明显升高,具有显著性差异(P<0.01)。与模型组相比,荭草苷和牡荆苷各治疗组均具有提高小鼠组织 SOD、CAT、GSH-Px的作用和降低MDA的作用,具有显著性差异(P<0.05,P<0.01)。与维生素E对照组相比,荭草苷和牡荆苷中、低剂量组提高小鼠肝、脑、肾组织SOD、CAT、GSH-Px的作用和降低MDA的作用较弱,具有显著性差异(P<0.05),高剂量组与维生素E组相比无显著性差异。荭草苷中、低剂量组提高小鼠肾、肝、脑组织中SOD、CAT、GSH-Px的作用和降低MDA的作用高于牡荆苷中、低剂量组,具有显著性差异(P<0.05),荭草苷与牡荆苷的高剂量组无显著性差异。
表1 各组肝、肾、脑组织SOD、CAT水平( s,n=10)
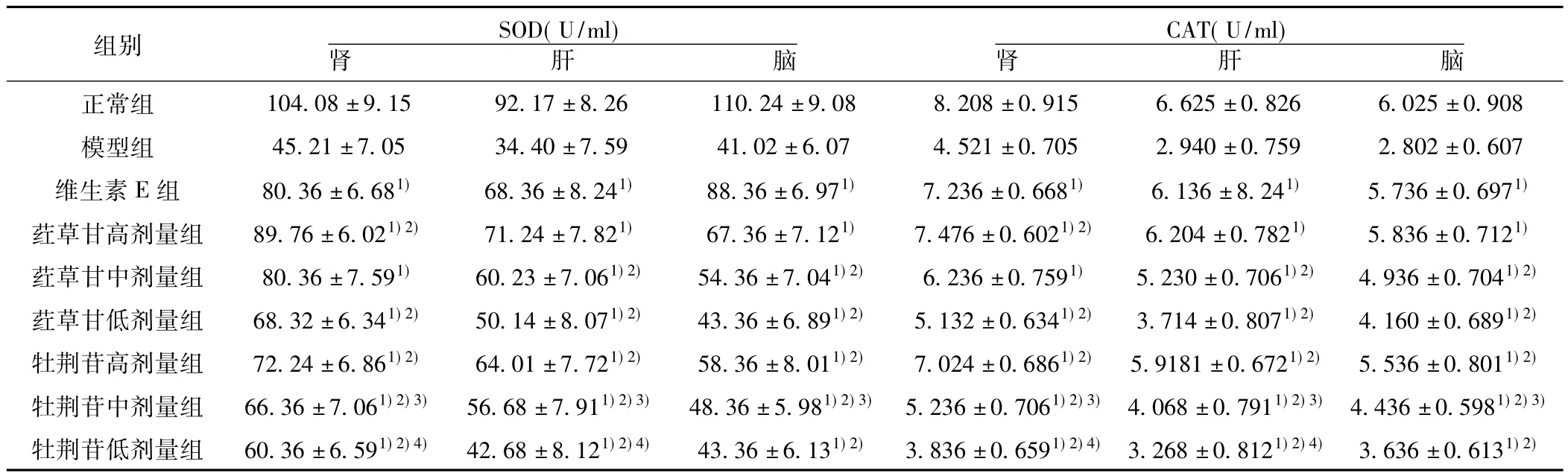
表1 各组肝、肾、脑组织SOD、CAT水平( s,n=10)
与模型组比较:1)P<0.01,与维生素E组比较:2)P<0.05;与荭草甘中剂量组比较:3)P<0.05;与荭草甘低剂量组比较:4)P<0.05,下表同
组别 SOD(U/ml)肾肝脑CAT(U/ml)肾肝脑.915 6.625±0.826 6.025±0.908模型组 45.21±7.05 34.40±7.59 41.02±6.07 4.521±0.705 2.940±0.759 2.802±0.607维生素E组 80.36±6.681) 68.36±8.241) 88.36±6.971) 7.236±0.6681) 6.136±8.241) 5.736±0.6971)荭草甘高剂量组 89.76±6.021)2) 71.24±7.821) 67.36±7.121) 7.476±0.6021)2) 6.204±0.7821) 5.836±0.7121)荭草甘中剂量组 80.36±7.591) 60.23±7.061)2) 54.36±7.041)2) 6.236±0.7591) 5.230±0.7061)2) 4.936±0.7041)2)荭草甘低剂量组 68.32±6.341)2) 50.14±8.071)2) 43.36±6.891)2) 5.132±0.6341)2) 3.714±0.8071)2) 4.160±0.6891)2)牡荆苷高剂量组 72.24±6.861)2) 64.01±7.721)2) 58.36±8.011)2) 7.024±0.6861)2) 5.9181±0.6721)2) 5.536±0.8011)2)牡荆苷中剂量组 66.36±7.061)2)3) 56.68±7.911)2)3) 48.36±5.981)2)3) 5.236±0.7061)2)3) 4.068±0.7911)2)3) 4.436±0.5981)2)3)牡荆苷低剂量组 60.36±6.591)2)4) 42.68±8.121)2)4) 43.36±6.131)2) 3.836±0.6591)2)4) 3.268±0.8121)2)4) 3.636±0.6131)2)正常组 104.08±9.15 92.17±8.26 110.24±9.08 8.208±0
表2 各组肝、肾、脑组织GSH-Px、MOA水平( s,n=10)

表2 各组肝、肾、脑组织GSH-Px、MOA水平( s,n=10)
组别 GSH-Px(U/ml)肾肝脑MDA(U/ml)肾肝脑4 14.52±3.26 8.48±2.37模型组 18.39±1.65 17.98±1.15 8.37±1.43 29.68±2.36 24.25±2.54 15.97±3.36维生素E组 32.10±2.041) 30.51±1.671) 14.25±2.071) 18.53±3.271) 17.52±3.141) 10.26±2.011)荭草甘高剂量组 33.42±1.961) 29.88±1.161) 13.34±1.691) 19.10±3.091) 16.35±2.581) 11.22±3.761)荭草甘中剂量组 30.24±1.041) 26.32±1.181)2) 12.40±1.371)2) 21.56±2.541) 18.71±2.021) 12.25±2.631)荭草甘低剂量组 26.21±1.941)2) 22.93±1.201)2) 10.56±2.141)2) 24.65±3.651)2) 20.32±4.011)2) 13.69±3.591)2)牡荆苷高剂量组 32.46±1.021) 27.57±0.941) 13.02±2.031) 20.46±2.581) 17.34±3.611) 11.97±3.241)牡荆苷中剂量组 25.26±1.651)2)3) 23.16±1.061)2)3) 11.93±1.971)2) 22.87±3.521)2) 19.24±2.971) 13.01±3.061)牡荆苷低剂量组 20.64±1.291)2)4) 19.94±1.681)2)4) 10.96±1.211)2) 25.36±2.831)2) 21.04±2.431)2) 13.89±2.521)2)正常组 34.56±1.12 32.46±1.10 16.58±2.05 15.17±3.6
3 讨论
D-gal亚急性衰老模型是研究抗衰老药物的经典模型。D-gal在醛糖还原酶的作用下生成半乳糖醇,而后者不能被细胞进一步代谢,进而造成细胞代谢紊乱,破坏并消耗机体抗氧化物质,并不断产生自由基,导致组织细胞受损,使细胞肿胀、功能障碍,从而造成实验性亚急性衰老模型。
在正常代谢情况下,机体产生和清除自由基处于一种动态平衡中。内源性的清除自由基的酶系有SOD、CAT、GSH-Px等,外源性的清除剂有维生素E、维生素C以及从植物提取出的黄酮类等化合物。T-AOC主要维持内环境活性氧自由基的动态平衡,清除浓度过高的活性氧自由基,使机体处于相对稳定的状态,它可代表抗氧化酶促系统和非酶促系统的变化。SOD可以催化超氧阴离子自由基的歧化反应,产生破坏能力相对较低的H2O2,而CAT和 GSH-Px能将H2O2分解成H2O和O2,减轻或阻断脂质过氧化作用的一级引发作用,保护机体免受过氧化氢的侵害,延缓细胞的衰老,从而预防自由基导致的疾病的发生〔9,10〕。根据自由基学说,适当补充外源性自由基清除剂,增强肌体自由基防御系统能力,即可达到抗衰老的目的。MDA是氧自由基引起细胞脂质过氧化损伤的终产物,是极其活泼的交联剂,能与蛋白质、核酸等交联,从而使其变性甚至失活,MDA可反映机体内过氧化程度,间接反映出细胞的受损程度〔11〕。
本实验结果表明荭草苷和牡荆苷在提高机体内SOD、CAT、GSH-Px的活性方面发挥较好的作用,且荭草苷和牡荆苷均能降低组织内的MDA的含量,提示荭草苷和牡荆苷可能通过直接清除体内氧自由基,激活抗氧化酶系的防御系统等作用,提高机体的抗氧化能力,减少自由基对机体的损伤,从而起到延缓衰老的作用。其中荭草苷中、低剂量组提高机体抗氧化酶和降低组织MDA的作用分别比牡荆苷中、低剂量组的作用强,这与文献所说B环上连有一个酚羟基的黄酮抗氧化性比B环上具有邻二酚羟基的黄酮抗氧化活性要弱些相一致〔12〕。高剂量组与维生素E作用相当。
从中医理论角度上说,肾藏象在中医脏腑中占有重要的地位,所谓肾气绝,则不尽其天命而死也;天寿过度,气脉常通,而肾气有余也〔13〕。肾在抗衰老作用中起着巨大的作用,金莲花黄酮类单体药代动力学理论证明金莲花黄酮单体荭草苷和牡荆苷,在肾中浓度最高,可见金莲花黄酮类单体具有很大的研究价值,也为进一步研究的抗氧化作用打下了坚实的基础。本文通过对荭草苷和牡荆苷的药理学研究,从中医的角度证明其具有提高机体的抗氧化抗衰老的能力。
1 李良千.毛茛科金莲花亚科植物的地理分布〔J〕.植物分类学报,1995;33(6):535-7.
2 曲彩红,颜 娟,田嘉铭,等.HPLC测定金莲花中三种黄酮苷的含量〔J〕. 中成药,2010;32(3):162-4.
3 颜 娟,胡海娜,田嘉铭,等.金莲花中总黄酮抗氧作用的研究〔J〕.时珍国医国药,2010;26(2):20-2.
4 杨国栋,饶 娜,田嘉铭,等.金莲花中荭草苷和牡荆苷的抗氧作用研究〔J〕.时珍国医国药,2011;22(9):110-1.
5 孙 黎,刘 芳,刘 华,等.金莲花黄酮对人乳腺癌细胞作用的研究〔J〕.中国老年学杂志,2010;29(9):1098.
6 孙 黎,罗 强,张 力,等.金莲花黄酮对A549细胞生长及凋亡的影响〔J〕. 中国老年学杂志,2011;131(2):82-3.
7 曲彩红.金莲花中荭草苷兔体内药代动力学研究〔D〕.河北北方学院.优秀硕士学位论文,2010.
8 颜 娟.金莲花中牡荆苷兔体内药代动力学研究〔D〕.河北北方学院.优秀硕士学位论文,2010.
9 Wang H,Joseph JA.Structure-activity relationships of quercet in antagonizing hydrogenperoxide-induced calciumdysregulat ion in PC 12 cells〔J〕.Free Radical Biol Med,1999;27(5-6):683-94.
10 桑 琛,李明学.衰老自由基学说和运动对抗自由基损伤的作用〔J〕. 吉林体育学院学报,2007;23(7):80-1.
11 Gawel S,Wardas M,Niedworok E,et al.Malondialdehyde(MDA)as a lipid peroxidation marker〔J〕.Wiad Lek,2004;57(9-10):453-5.
12 李顺成.衰老实质及中医方药延缓衰老机理研究思路〔J〕.中国中西医结合杂志,1993;13(6):1371-3.
13 程 革.金匾肾气丸延缓衰老作用的理论和实验研究〔D〕.南京中医药大学,2008.
