重组人生长停滞特异性蛋白6对缺氧/复氧原代心肌细胞及H9c2细胞损伤的影响
2012-11-20符江琳刘承云华中科技大学同济医学院附属协和医院老年科湖北武汉442000
符江琳 刘承云 徐 晓 (华中科技大学同济医学院附属协和医院老年科,湖北 武汉 442000)
生长停滞特异性蛋白6(Gas6)的受体酪氨酸激酶亚家族成员,除表达于多种肿瘤细胞外,还广泛存在于哺乳动物的心脑血管组织中〔1,2〕。以往认为Gas6因子及其受体作用主要抑制肿瘤细胞凋亡,近年来Gas6抑制非肿瘤细胞凋亡的研究日益增多〔3,4〕,最新研究显示在肝脏缺血再灌注损伤中,Gas6对肝细胞起保护作用〔5〕,但目前关于Gas6对心肌细胞凋亡影响的报道少见。我们前期实验已发现Gas6及其受体基因均高表达于缺血再灌注大鼠心脏组织中。抑制心肌细胞凋亡对于保护围心脏手术、急性心肌梗死及慢性心衰等常见老年病患者有着重大意义。本实验初步探讨外源Gas6(rhGas6)对缺血再灌注诱导的心肌细胞损伤是否有保护作用,为常见老年病提供可能的临床心肌保护治疗思路。
1 材料与方法
1.1 细胞来源 新生1~3 d的Wistar大鼠(华中科技大学同济医学院动物中心提供)。H9c2细胞系购于武汉博士德公司。
1.2 主要试剂 重组人Gas6(R&D公司),AnnexinV/PI凋亡试剂盒(AntiGene公司),DMEM高糖和低糖型培养基(Gibco公司),混合Ⅱ型胶原酶(Sigma公司),胎牛及小牛血清(杭州四季青公司),乳酸脱氢酶检测试剂盒及Caspase-3活性检测试剂盒(南京建成有限公司),5-Brdu(武汉博士德公司),其他试剂均为国产分析纯。
1.3 实验方法
1.3.1 原代心肌细胞分离及H9c2细胞系培养 参阅相关文献中方法〔6〕,取出生1~3 d的Wistar乳鼠,无菌条件下取心脏组织,剥离非心肌组织,冰浴PBS漂洗3~4次后,剪成1 mm3组织碎块,加入5倍体积的0.05%胰蛋白酶及0.025%胶原酶1∶1混合消化液,37℃ 水浴消化4~5次,收集上清细胞,加入等体积的20%小牛血清的高糖DMEM培养液终止消化,200目滤网过滤细胞悬液,1 000 r/min离心10 min,弃上清,加入含10%胎牛血清的高糖DMEM培养基制成细胞悬液培养,37℃、5%CO2培养箱中孵育90 min,取悬液接种于培养板培养,取培养3 d的呈单层网状结构,搏动频率达100次/min左右心肌细胞进行实验。H9c2细胞系以(1~2)×104/ml接种于50 ml培养瓶中,用含10%胎牛血清的高糖DMEM培养基,37℃、5%CO2培养箱(95%空气)中培养,2~3 d用0.25%胰酶消化传代1次,接种于培养板中,取对数生长期细胞,密度达 90%进行实验。
1.3.2 心肌细胞H/R模型的构建及实验分组 参照Pi等〔7〕方法稍加改进,无血清低糖DMEM培养基,事先用氮气充分饱和30 min,流量为2 L/min,使溶解氧分压从20 kPa降至4 kPa。将上述细胞培养基快速置换掉细胞培养板中的含血清的高糖培养基,并将细胞培养板置入密闭装置内,充满氮气,37℃,原代心肌细胞培养3 h后将培养基换为正常培养基,37℃、5%CO2培养箱(95%空气)复氧3 h。H9c2细胞系培养2 h后将培养基换为正常培养基,复氧3 h。分别取正常培养的原代心肌细胞及H9c2细胞系随机分3组:①正常组;37℃、5%CO2培养箱(95%空气)正常培养;②缺氧/复氧组(H/R组);按照上述构建模型培养;③缺氧/复氧+rhGas6组(rhGas6组);于缺氧前15 min在无血清低糖培养基中加入终浓度为100 ng/ml的重组人rhGas6,构建模型。每个组含6个样本。
1.3.3 心肌细胞形态学观察 在倒置显微镜下观察心肌细胞形态及自发搏动情况。
1.3.4 MTT法测定心肌细胞活力 取原代心肌细胞及H9c2细胞,将细胞密度分别调至1×105/ml、1×104/ml,取 200 μl/孔接种于96孔培养板中,2~3 d后随机分组对应处理后,每孔加入20 μl MTT(5 mg/ml),继续正常培养4 h后,1 000 min×5 min离心后弃上层培养液,每孔加入 DMSO 0.15 ml,震荡10 min后,酶标仪检测各孔吸光度A值(检测波长为570 nm)。细胞存活率=实验组吸光值/对照组吸光值×100%。
1.3.5 乳酸脱氢酶(LDH)的检测心肌细胞损伤程度 原代心肌细胞及H9c2细胞分别以(1~2)×106/ml、(2~4)×105/ml密度接种于6孔培养板中,2~3 d后随机分组对应处理后,各组6孔板中培养液,依照试剂盒说明书,反应后利用721分光光度计检测A值,根据A值按说明书公式计算出LDH活力。
1.3.6 Caspase-3活性检测 取处理过的各组6孔板,先将细胞培养液收集于离心管中,用0.25%的胰酶消化贴壁细胞,收集于对应的离心管中,按照Caspase-3活性检测试剂盒说明书步骤,用酶标仪测定各组的A405值,样品的A405扣除空白对照组A405,即为Caspase-3催化产生的pNA的吸光值。根据测定出的标准曲线,算出对应酶活力单位(UI)(每组6个复孔)。
1.3.7 AnnxinV-FITC/PI双标法检测心肌细胞凋亡 取处理过的各组6孔板,先将可能含有漂浮凋亡细胞的各组培养液分别收集于流式管中,用胰酶消化贴壁细胞,并收集于对应的流式管中,4℃、1 000 r/min离心5 min,用冰预PBS洗涤2次,然后用200 μl结合缓冲液重悬细胞。加入5 μl AnnexinV-FITC,避光室温反应15 min,再加入10 μl PI避光室温反应5 min或者4℃反应30 min,加入250 μl PBS,立即上机检测。经流式细胞仪分析结果。
2 结果
2.1 心肌细胞生长情况及心肌细胞搏动频率 分离纯化原代乳鼠心肌细胞接种于培养板中,倒置显微镜下观察,4 h后心肌细胞开始贴壁生长,12 h后逐渐伸展由圆形变为梭形。24 h后90%细胞贴壁呈梭形,少数单个细胞呈现不同频率的自发性搏动,搏动频率为60~80次/min。48 h后细胞逐渐向四周扩展呈星型,90%波动明显,频率大概在90~100次/min。72 h后,正常l组细胞生长良好、成簇生长,搏动明显且节律规则;H/R组细胞伪足缩短或消失、折光性下降、搏动频率(35±7)次/min较正常组(94±3)次/min明显下降(P<0.05);与H/R组相比,rhGas6组细胞生长较好,搏动频率增加(78±6)次/min,差异具有统计学意义(P<0.05);而rhGas6组较正常组细胞搏动频率改变不明显。
2.2 各组心肌细胞存活率的比较 比较原代乳鼠心肌细胞及H9c2细胞各组OD值,与正常组比较,H/R组细胞损伤严重,细胞活力明显降低,两组比较差异有明显的统计学意义;rh-Gas6组与H/R组相比细胞活力明显升高(P<0.05),但与正常组比较差异无统计学意义(P>0.05)。见表1。
2.3 LDH活力测定的比较 在原代心肌细胞及H9c2细胞中,H/R组较正常组、rhGas6组 LDH释放明显增加,H/R+rh-Gas6组与H/R组相比,差异有明显统计学意义(P<0.05),但与正常组比较差异无统计学意义(P>0.05)。见表1。
2.4 Caspase-3活性检测 正常组细胞Caspase-3活性较低;H/R组活性较正常组增加;rhGas6组活性较H/R组减低(P<0.05)。见表2。
2.5 各组细胞凋亡率的比较 rhGas6组、正常组凋亡率明显低于H/R组(P<0.05),rhGas6组与正常组凋亡率差异无统计学意义。见表2。
表1 原代心肌细胞及H9c2细胞各组细胞存活率和LDH活性变化( s,n=6)
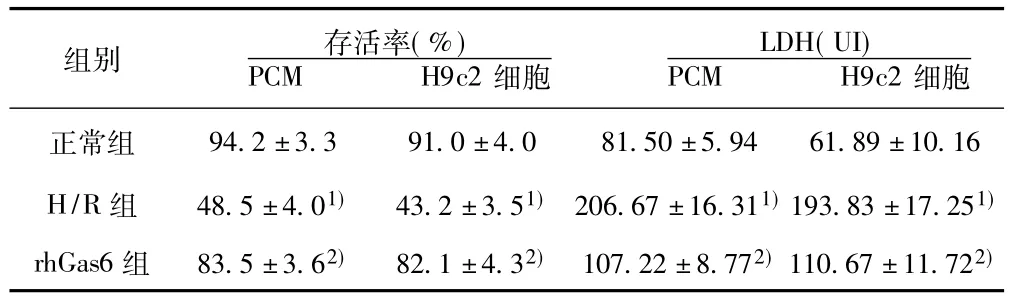
表1 原代心肌细胞及H9c2细胞各组细胞存活率和LDH活性变化( s,n=6)
与正常组比较:1)P<0.05;与H/R组比较:2)P<0.05,下表同
LDH(UI)PCM H9c2组别 存活率(%)PCM H9c2细胞94.2±3.3 91.0±4.0 81.50±5.94 61.89±10.16 H/R组 48.5±4.01)43.2±3.51)206.67±16.311)193.83±17.251)rhGas6组 83.5±3.62)82.1±4.32)107.22±8.772)110.67±11.722)细胞正常组
表2 原代心肌细胞及H9c2细胞各组细胞Caspase-3变化( s,n=6)
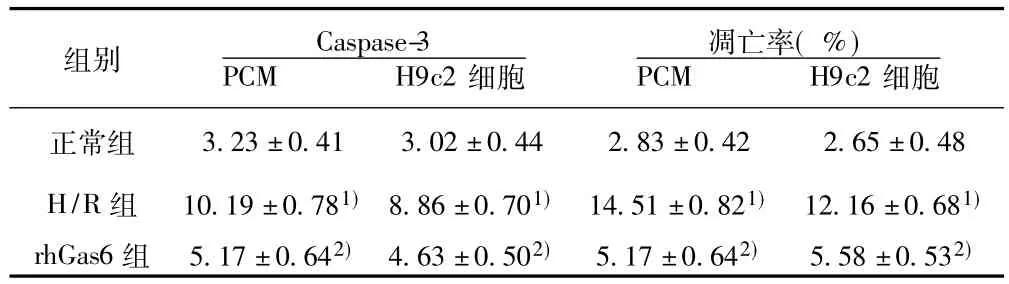
表2 原代心肌细胞及H9c2细胞各组细胞Caspase-3变化( s,n=6)
3.23±0.41 3.02±0.44 2.83±0.42 2.65±0.48 H/R组 10.19±0.781) 8.86±0.701) 14.51±0.821) 12.16±0.681)rhGas6组 5.17±0.642) 4.63±0.502) 5.17±0.642) 5.58±0.532)细胞正常组组别 Caspase-3 PCM H9c2细胞凋亡率(%)PCM H9c2
3 讨论
细胞凋亡在急性心肌梗死、急慢性心力衰竭及糖尿病心肌病等众多心血管疾病中发挥着重要的病理生理学作用,尤其在急性心肌梗死早期再灌注治疗中,细胞凋亡不但影响心肌的梗死面积,还促成心脏结构的重构〔8〕。虽然凋亡的发生是不可逆的,但有大量研究表明细胞凋亡受一些生长因子或炎性细胞因子的调节,同时干扰或中断引起凋亡的信号传导途径,可能对治疗心血管疾病有重要的临床意义。
Gas6因子能与多种肿瘤细胞表面表达的Axl受体结合发挥多种生物学效应,如调节细胞存活、增殖、迁移、黏附和吞噬等作用。近些年研究发现,Gas6能够抑制多种非肿瘤细胞的凋亡,尤其在高糖诱导的血管平滑肌细胞凋亡、缺血的大脑皮层诱导的神经元细胞凋亡及肝脏缺血再灌注损伤中,Gas6起着显著的保护作用〔3~6,9〕。这些都预示着Gas6可能在老年人常见心脑血管疾病中有一定的保护作用。
以往研究显示Gas6可能通过以下主要途径抑制细胞凋亡:①抑制Caspase-3活性。多种药物以及细胞因子介导的抗细胞凋亡作用中,Caspase-3 都充当着重要角色〔10,11〕。因而Caspase-3活性的测定成为相关疾病基础研究和药物干预效果评价的重要指标。已有研究表明Gas6可通过降低促凋亡蛋白Caspase-3活性,保护血清剥夺诱导的人脐静脉内皮细胞凋亡〔5〕。且在他汀类药物通过Gas6介导的存活通路阻止血管钙化过程中,Caspase-3活性也明显降低,凋亡的血管平滑肌细胞数目减少〔12〕;②激活抗凋亡蛋白 NF-κB、Bcl-2,通过激活NF-κB的死亡受体途径介导。在不少肿瘤细胞中,Gas 6能诱导NF-κB结合活性和转录活性以及使Bcl-2蛋白水平的快速而短暂的升高〔13〕。③抑制细胞钙内流。早有报道,在β淀粉样蛋白诱导的原代大鼠皮层神经元凋亡过程中,Gas6可以抑制L型钙通道,达到神经保护作用。
我们前期的研究显示Gas6及其受体基因高表达于缺血再灌注大鼠心肌组织,提示Gas6可能有心肌保护作用。本实验提示Gas6可能通过减少细胞膜通透性来提高心肌细胞存活率及抑制Caspase-3活化发挥抗细胞凋亡作用,进而减少心肌损伤。另外本实验利用混合胶原酶及5-Brdu分离并培养原代心肌细胞,基本剔除了Gas6对心肌成纤维细胞的作用因素。更重要的是利用体外培养的H9c2心肌细胞系,排除了体内各种体液因素对实验的干扰。
前人及我们的研究均显示Gas6能够抑制非肿瘤细胞的凋亡,但Caspase-3作为多种胞内凋亡信号转导的下游通路,Gas6具体是如何通过调节上游网络信号通路抑制心肌细胞凋亡,有待进一步研究。我们分别在原代乳鼠心肌细胞和H9c2细胞系这两种不同的心肌细胞中,验证了Gas6可以减少缺血再灌注诱导的心肌细胞损伤,通过抑制Caspase-3活性减少细胞凋亡,这可能为今后老年患者的缺血性心脑血管疾病的防治提供新的治疗思路。
1 Lemmon MA,Schlessinger J.Cell signaling by receptor tyrosine kinases〔J〕.Cell,2010;141(7):1117-34.
2 Marc Tjwa LM,Esther Lutgens.Pleiotropic role of growth arrest-specific gene 6 in atherosclerosis〔J〕.Curr Opin Lipidol,2009;20(5):386-92.
3 Cavet ME,Smolock EM,Ozturk OH,et al.Gas6-Axl receptor signaling is regulated by glucose in vascular smooth muscle cells〔J〕.Arterioscl Throm Vas,2008;28(5):886-91.
4 Ganopolsky JG,Abid MR,Aird WC,et al.GAS6-induced signaling in human endothelial cells is mediated by FOXO1a〔J〕.J Thromb Haemost,2008;6(10):1804-11.
5 Llacuna L,Barcena C,Bellido-Martin L,et al.Growth arrest-specific protein 6 is hepatoprotective against murine ischemia/reperfusion injury〔J〕.Hepatology,2010;52(4):1371-9.
6 Yao LL,Wang YG,Cai WJ,et al.Survivin mediates the anti-apoptotic effect of delta-opioid receptor stimulation in cardiomyocytes〔J〕.J Cell Sci,2007;120(Pt 5):895-907.
7 Pi Y,Goldenthal MJ,Marín-García J.Mitochondrial involvement in IGF-1 induced protection of cardiomyocytes against hypoxia/reoxygenation injury〔J〕.Mol Cell Biochem,2007;301(1-2):181-9.
8 Scarabelli TM,Knight R,Stephanou A,et al.Clinical implications of apoptosis in ischemic myocardium〔J〕.Curr Probl Cardiol,2006;31(3):181-264.
9 Shankar SL,O'Guin K,Kim M,et al.Gas6/Axl signaling activates the phosphatidylinositol 3-kinase/Akt1 survival pathway to protect oligodendrocytes from tumor necrosis factor alpha-induced apoptosis〔J〕.J Neurosci,2006;26(21):5638-48.
10 万 磊,李菊香,洪 葵,等.NADPH氧化酶亚单位nox-1在心肌细胞急性缺氧复氧损伤时的变化及心肌营养素-1的作用〔J〕.中国病理生理杂志,2009;25(11):2113-7.
11 张 颖,肖 谦.Ghrelin对高糖诱导心肌细胞凋亡的影响〔J〕.中国老年学杂志,2010;30(6):757-60.
12 Son BK,Kozaki K,Iijima K,et al.Statins protect human aortic smooth muscle cells from inorganic phosphate-induced calcification by restoring Gas6-Axl survival pathway〔J〕.Circ Res,2006;98(8):1024-31.
13 Li Y,Ye X,Tan C,et al.Axl as a potential therapeutic target in cancer:role of Axl in tumor growth,metastasis and angiogenesis〔J〕.Oncogene,2009;28(39):3442-55.
