TLR4、MyD88mRNA在胆脂瘤型中耳炎中的表达
2012-11-20杨珍珍张莉萍
杨珍珍 张莉萍
(山西医科大学第二医院,山西 太原 030001)
尽管中耳胆脂瘤的成因及其上皮的来源仍存在很多争议,但基本达成共识的是胆脂瘤的形成与机体为防御慢性炎症而产生的一系列异常免疫应答有关。免疫反应的异常是造成胆脂瘤持续发展和骨质破坏的内在重要因素[1,2]。Toll样受体(toll.1ikereceptors,TLRs)是先天性免疫模式识别受体(pattern recognition receptor,PRR)之一,通过识别病原微生物及其细胞壁产物的特殊结构即病原相关分子模式(pathogen associated molecularpatterns,PAMPs)迅速激活天然免疫系统[3]。现Szczepanski等[4]研究发现TLR(TLR-2,TLR-3,TLR-4)在胆脂瘤微环境中表达丰富,提示TLR4可能参与胆脂瘤型中耳炎的发病。本实验拟用RT-PCR法观察中耳胆脂瘤组织中TLR4的变化及其下游传导分子MyD88的表达,进一步探讨TLR4信号转导途径在中耳胆脂瘤发病中的作用。
1 材料与方法
1.1 标本
中耳炎组标本组织来自山西医科大学第二医院耳鼻咽喉-头颈外科住院患者35例(男13例,女22例,年龄16~62岁)平均37.12岁,耳流脓史1个月~30年,平均5.14年;听骨无破坏者8例,破坏1个8例,破坏2个13例,破坏3个6例。在术中取标本时根据显微镜下所见上皮下基质炎性反应的程度,取样分为炎症组和非炎症组,其中炎症组13份,非炎症组12份。对照组为正常外耳道皮肤组织10例,亦取自中耳术中。上述所有标本在显微镜下仔细剔除胆脂瘤鳞屑及其他坏死组织,置于一80℃冰箱保存,用作RT-PCR检测。所有患者术前均行颞骨高分辨CT检查,术后病理活检均证实为后天继发性胆脂瘤。
1.2 主要试剂与仪器
RT-PCR相关试剂(TAKARA公司).引物合成(深圳华大基因研究所),引物序列如表1。PCR扩增仪为STRATAGENE公司产品。

表1 3种基因的引物序列及产物基因
1.3 总RNA制备和逆转录
取组织50mg,加入1mL Trizol,超声匀浆。加入200μL氯仿,剧烈振荡混匀30s,于4℃ 12000rpm离心5min,将上清液移入另一EP管中,加入等体积异丙醇,室温放置5min,4℃ 12000rpm离心5min以沉淀RNA,用70%乙醇1mL洗涤沉淀2次,4℃ 12000rpm离心2min,EP管底部可得RNA沉淀,用50μL 0.1%DEPC水溶解后可作为反转录的模板。cDNA合成按Rever Tra Ace-a-逆转录酶试剂盒说明完成。
1.4 实时定量PCR
PCR反应体系为:FastStart Universal SYBR Green Master (ROX)10μL,上游引物(15uM)0.5μL,下游引物(15uM)0.5μL,cDNA 2μL,无DNAse和RNAse的水7μL,共20μL。PCR 反应条件:94℃预变性10min,活化Tag酶;94℃15s,60℃60 s,45个循环结束。荧光定量PCR读取CT(cycle threshold)值。
1.5 统计学方法
用2-ΔΔCT法处理实时荧光定量RT-PCR数据,采用SPSSl3.0 for windows软件包处理获得的数据,以Explore过程对数据进行探索性分析,由于实验组标本值2-ΔΔCT不符合正态分布,以非参数秩和检验进行统计分析。结果以中位数和最大最小值范围来表示,以P<0.05认为差异有统计学意义。
2 结 果
2.1 TLR4水平的改变
炎症组TLR4平均2-ΔΔCT值分别为0.689(0.200,2.050),非炎症组TLR4平均2-ΔΔCT值分别为0.291(0.020,0.990),正常对照组TLR4、平均2-ΔΔCT值分别为0.163(0.001,0.990)。见图1。
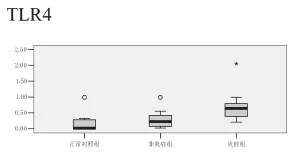
图1 炎症组、非炎症组、正常对照组TLR4 mRNA的表达
2.2 MyD88水平的改变
炎症组为MyD88平均2-ΔΔCT值0.777(0.320,1.84);非炎症组MyD88平均2-ΔΔCT值为0.320(0.01,0.990),正常对照组MyD88平均2-ΔΔCT值为0.224(0.002,0.990),见图2。
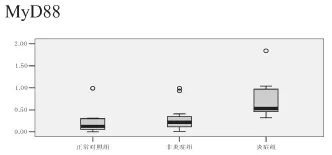
图2 炎症组、非炎症组、正常对照组MyD88 mRNA的表达
3 讨 论
慢性化脓性中耳炎是耳鼻咽喉科一个常见的疾病,胆脂瘤型中耳炎是中耳慢性化脓性炎的一个类型,发病率占慢性化脓性中耳炎的20%,它主要以上皮细胞增生、角化上皮脱屑堆积为特征,虽然其不产生与恶性肿瘤同样的无限增殖,但它可以引发骨破坏,激发蚀骨,侵略性地侵蚀中耳及内耳的结构,引起严重的颅内并发症,如并不少见的永久性的听力损失、 前庭功能障碍等,严重危害人类健康。大多数学者把胆脂瘤骨质破坏的机制解释为慢性炎性作用的结果。Suzuki等[5]发现,胆脂瘤囊的破裂可引起局部炎症和骨质破坏,并伴随着相同部位小脓肿的形成,他们还观察到穿孔部位有明显的炎性细胞浸润和上皮增殖,说明了胆脂瘤骨质破坏与炎症之间的联系。
马鑫[6]等研究发现,胆脂瘤原发部位的差别对于胆脂瘤的侵袭性没有明显影响,主要是伴发炎性反应的轻重对于胆脂瘤的预后以及侵袭性有明显影响,胆脂瘤周围炎性反应越重,侵袭性越强。基于以上,了解胆脂瘤的炎症反应机制,尤为重要。
1997年,Medzhitov等[7]首次在人类细胞表现了Toll样受体,TLR的发现对免疫学的发展产生了积极而深远的影响。TLR最突出的生物学功能是促进细胞因子的合成与释放,引发炎性反应。已经有研究发现在胆脂瘤微环境中,有大量TLR4的表达,本研究根据显微镜下观察胆脂瘤上皮下基质,将中耳胆脂瘤组分为炎症组和非炎症组,发现在炎症程度强的组织中,有大量的TLR4表达,而在炎症程度相对较弱的胆脂瘤组织中,有TLR4的表达,但明显少于炎症组;相比较胆脂瘤组,正常对照组仅有微量表达。
TLR4识别配体后发生二聚化,二聚体的刺激信号通过胞内Toll/IL-1 R区(Toll/IL-1 R domain,TIR)传递给下游的信号分子经过一系列蛋白级联反应和磷酸化作用,产生炎性反应[8]。目前发现TLR4信号通路有2条:一条为MyD88依赖信号途径,另一条为MyD88非依赖信号途径。在MyD88依赖途径中,TLR4寡聚化后募集含TIR(Toll-interleukin-1receptor)结构域的接头蛋白TIRAP (TIP domain-containing adaptor protein)和MyD88。然后MyD88下游的接头蛋白IRAK4(IL-1 receptor-associated kinase-4)、TRAF6(TNF report-associated factor 6)和TAKl(TGFβ-activated kinase 1)被募集并活化,而TAKl激活IKK-NF-κB通路和MAPK通路,最终导致前炎性因子的表达[9]。本实验研究发现,同TLR4一样,MyD88在炎症组中有大量表达,非炎症组次之,正常对照组有微量表达。说明在胆脂瘤发生、发展过程中,TLR4-MyD88信号转导途径可能参与了炎性反应。
本实验结果显示在胆脂瘤中耳炎过程中,胆脂瘤组织内TLR4、MyD88的表达量随着炎症程度的加重而增多。这有助于对人天然免疫和获得性免疫启动的认识,并进一步了解TLR4传导通路在胆脂瘤型中耳炎发病机制中的作用。而且可以为该病的免疫治疗提供理论依据。如:在胆脂瘤发病早期(慢性化脓性中耳炎)时就进行免疫干预治疗,阻止或延缓疾病的发展。
[1]Albino AP,Kimmelman CP,Parisier SC.Cholesteatoma: a molecular and cellular puzzle1[J].Am J Otol,1998,19(3):266-272.
[2]林刃舆,迟放鲁.中耳胆脂瘤形成机理的研究进展[J].国外医学耳鼻咽喉科学分册,2001,25(3): 153-156.
[3]Janssens S,Beyaert R.Role of Toll-like receptors in pathogen recognition[J].Clin Microbiol Rev,2003,16(4):637-646.
[4]Szczepanski M,Szyfter W,Jenek R,et al.Toll-like receptors2,3and4(TLR2,TLR3andTLR4)are expressed in the microenvironment of human acquired cholesteatoma[J].Eur Arch Otorhinolaryngol,2006,263(7):603-607.
[5]马鑫,余力生,夏瑞明.不同部位胆脂瘤侵袭性免疫组化的比较[J].中华耳鼻咽喉头颈外科杂志,2006,41(8):574-578.
[6]Suzuki C,Ohtani I.Bone destruction resulting from rup ture of a cholesteatoma sac: temporal bone pathology[J].Otol Neur otol,2004,25(5): 674-677.
[7]Medzhitov R,Preston-Hurlburt P,Janeway CA.A human homoLogue of the Drosophila Toll protein signal sactivation of adaptiveimmunity[J].Nature,1997,388(6640):394-397.
[8]Lu YC,Yeh WC,Ohashi PS.LPS/TLR4 signal transduetion p pathway[J].Cytokine,2008,42(2):145-151.
[9]黄宏耀,梁冯,宁勇.Toll样受体介导的信号转导通路及其与炎症和肿瘤的天系[J].湖北中医学院学报,2008,12(4):34-36.
