血浆NO 在阿尔茨海默病患者中的表达及意义
2012-11-20邱晨红孙沁怡谢红娜
彭 誉 周 华 邱晨红 孙沁怡 王 锋 谢红娜 赵 中
影响阿尔茨海默病(Alzheimer disease,AD)临床诊断的因素较多,难度较大,特别是早期诊断,目前临床上对AD 的主要诊断依靠临床症状、神经影像学及神经心理学。2011年4 月发布的AD 最新诊断标准即NIA-AA 诊断标准[1~3]将脑脊液生物标记物纳入AD 诊断中。腰穿为有创检查,对于有认知功能下降的患者依从性较差,故AD 患者血浆生物学指标寻找是目前研究的重点。一氧化氮(nitric oxide,NO)是神经系统中重要的信号分子,当其水平较高时可导致线粒体功能障碍、凋亡通路的激活等,介导神经毒性,参与与AD 发病相关的β淀粉样蛋白(Aβ)沉积、tau蛋白异常磷酸化等特征性病理改变[4~6]。本研究旨在探讨血浆NO 在AD 患者中的表达及临床意义。
1 对象与方法
1.1 研究对象 于2011年1月-2012年3月入住本院神经内科治疗的AD 患者中抽取48例为研究对象,其中男23例(47.9%),女25例(52.1%),年龄61~83岁,平均年龄(69.32±5.53)岁,文化程度为文盲10 例(20.8%),小 学16 例(33.3%),中学、中专14例(29.2%),大学及以上8例(19.7%),MMSE评分(13.9±2.3)分,病程3~10年,平均病程(4.20±1.21)年。AD 诊断均符合美国精神障碍诊断与统计手册第4版(Diagnostic Statistical Manual 4 th edition,DSM—IV)中AD 诊断标准,简易精神状态检查量表(Mini.Mental State Examination,MMSE)评分<24 分,哈金斯基缺血指数(HIs)评分(2.4±0.6)分,日常生活量表(ADL)评分(29.1±3.4)分,临床痴呆量表(CDR)评分(1.5±0.6)分,总体衰退量表(GDS)评分为三级以上,并根据患者临床表现、神经系统检查、精神检查、头部CT 和MRI检查以及其他相关实验室检查排除其他系统疾病和有毒物质等所引起的痴呆。
取同期在本科治疗的VD 患者41例以及同期体检无认知功能障碍老年人37 例为对照组。VD组男25 例(61.0%),女16 例(39.0%),年龄64~87岁,平均年龄(75.95±8.42)岁,文化程度为文盲9例(22.0%),小学13 例(31.7%),中学、中专12例(29.3%),大学及以上7 例(17.0%),MMSE 评分(18.3±1.9)分,病程2~8年,平均病程(4.52±0.93)年,所有患者均符合DSM.IV 中血管性痴呆的诊断标准,蒙特利尔认知评估量表(Montreal Cognitive Assessment,MoCA)评分<26 分,ADL评分(19±0.6)分,CDR 评分(0.6±0.1)分,GDS评分为二、三级,病史、临床表现、神经系统检查、精神检查、头部CT 或MRI检查均提示存在脑血管病和局灶性神经系统体征。NC 组37例,其中男19 例(51.4%),女18例(48.6%),年龄62~83岁,平均年龄(71.06±5.87)岁,文化程度为文盲8 例(20.9%),小学11例(30.0%),中 学、中专11例(30.0%),大学及以上7 例(19.1%),MMSE 评分>24分,MoCA>26分,无精神疾病史和精神病家族史,平时体健,近期体检正常。
1.2 方法
1.2.1 血液标本的采集及NO 水平的测定
清晨抽取空腹静脉血2 ml,肝素抗凝,1 500 r/min离心10 min,完全分离血浆,保存于-80℃冰箱待测。采用兔抗人NO ELISA 试剂盒(美国AdlitteramDiagnostic Laboratories)检测血浆NO水平,检测步骤严格按照说明书操作。
1.2.2 神经心理学量表检查
使用国内外公认的痴呆初筛量表MMSE评定。MMSE共分11项,包括时间定向、地点定向、即刻记忆、注意和计算、近记忆检查、物体命名、语言复述、语言理解、阅读理解、句子书写以及图形描画等11项内容,共计30 分。划分痴呆标准:文盲≤17分,小学≤20分,中学≤22分,大学≤23分,凡是达不到此分值的,均认为其有程度不等的认知功能损害,即文盲<18 分,小学<21分,初中及以上<25分,测试时间约10 min。
1.2.3 统计学处理
采用SPSS13.0统计软件。实验数据采用均数±标准差(±s)表示,定量资料比较采用t检验,定性资料比较采用χ2检验,相关性分析采用Pearson相关分析和多元线性回归分析。P<0.01为差异具有统计学意义。
2 结 果
2.1 相关指标水平
AD 组和对照组的年龄和性别构成差别均不明显(P>0.05)。AD 组和VD 组患者在性别、年龄、受教育年限以及吸烟、糖尿病、高血压病、高脂血症、脑卒中史等方面比较无明显差异(P>0.05,表1),具有可比性。
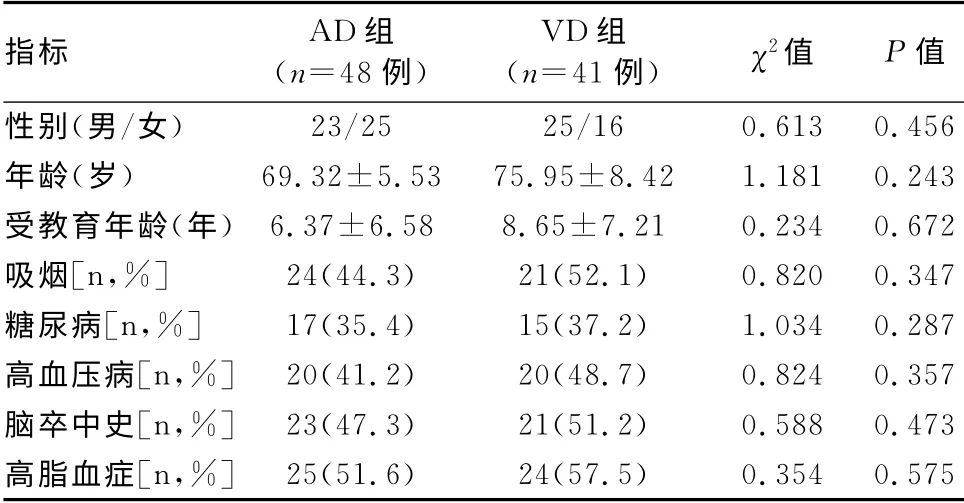
表1 AD 组、VD 组患者基本临床特征
2.2 AD组、VD组、NC组患者血浆NO水平的比较在校正性别、年龄、吸烟、受教育程度以及既往疾病史等变量后AD 组患者血浆NO 水平[41.01±16.40]umol/L 明 显 高 于NC 组[16.00±6.63]umol/L(P<0.01)以及VD 组患者血浆NO 水平[21.28±6.71]umol/L(P<0.01)(表2)。
2.3 AD 患者血浆NO 水平与MMSE 分值的相关性
对AD 组患者血浆NO 水平和MMSE 评分进行相关性分析后发现,AD 组患者血浆NO 水平和MMSE得分呈负相关(r=-0.194,P<0.01)。从图1可见,有1例患者(左下角)MMSE 评分和NO水平均较低,明显偏离直线,考虑为偏离较大的变量值(图1)。

表2 AD 组、VD 组、NC组血浆NO 水平比较(μmol/L)

图1 AD 患者血浆NO 水平与MMSE分值的相关性
2.4 AD 患者NO 水平与各个认知领域的相关性
对AD 患者各个认知领域的分值与血NO 水平进行多元线性回归分析发现,血浆NO 水平与患者记忆力、定向力、注意力和计算能力呈负相关(P<0.05),而与命名能力、语言流畅能力、视空间执行能力和抽象概括能力等无相关性(表3)。
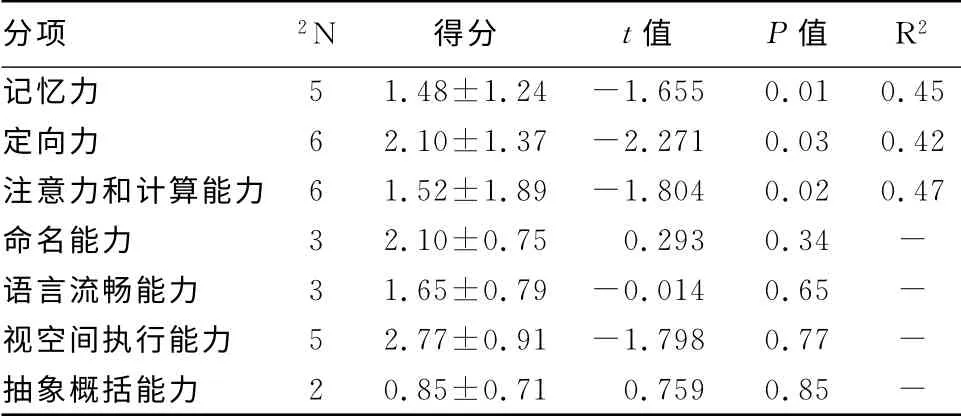
表3 AD 患者NO 水平与各个认知领域评分的回归分析
3 讨 论
No是神经系统中的重要信号分子。在AD 的形成过程中NO 水平的增高与学习记忆减退密切相关,如果NO 释放过量,它在AD 的神经毒性作用远远超过其保护作用[4]。实验表明,AD 模型组大鼠较正常组脑组织NO 水平显著升高。高水平的NO 是一种神经毒害因子,除作为自由基以及与超氧阴离子结合形成超氧亚硝酸盐产生直接毒性外,还可使递质释放异常,产生神经元兴奋毒性及炎症性损害,广泛参与神经系统的损伤过程[7]。用组织化学的方法已经证实,神经元的损伤可引起大脑皮质、海马等许多脑区中一氧化氮合酶(NOS)表达增加[8]。NOS催化分子氧与左旋硝基精氨酸生成NO。NOS表达增加或活性增加可引起NO 过量生成。过多的NO 可直接影响机体铁代谢、能量代谢和蛋白质功能,对基因产生毒性作用,导致细胞凋亡,直接参与AD 的病理过程。
本研究结果显示,AD 患者NO 水平显著高于对照组(P<0.01)和VD 组(P<0.01),同时也可作为阿尔茨海默病与血管性痴呆鉴别诊断的生物学指标,这与国外文献报道一致[9,10],这可能是因为自由基能导致NOS 增加,进而导致血浆NO 水平升高[11]。同时本研究还首次发现AD 患者NO 水平与MMSE评分呈负相关,即AD 患者血浆NO 水平越高,MMSE分值越低,提示NO 水平的改变可以反映AD 患者认知功能损害的程度。推测其机制可能为:(1)阿尔茨海默病的发病机制与氧化应激密切相关,当机体受到感染、疾病或环境等的影响时机体氧化水平超过抗氧化水平,活性氧簇(reactive oxygen species,ROS)和活性氮簇(reactive nitrogen species,RNS)等高活性的分子就会大量堆积,而高水平的NO 参与β淀粉样蛋白的神经毒性作用,导致AD 的产生[4,12];(2)研究显示,AD 患者存在明显的内侧颞叶结构病变,包括海马结构、杏仁核和海马旁回,而这些位置的糖代谢效率较高,对氧的需求最高,线粒体氧化磷酸化的同时能产生大量的氧自由基和氮自由基,而上述结构清除自由基和抗氧化能力较差,而这些部位是脑认知功能重要的结构基础,其损害程度与认知功能下降幅度相关[13]。当各种危险因素导致上述部位损害时,损害愈重,认知功能下降愈明显,NO 水平升高也越显著。
通过对AD 患者各个认知领域的分值与血浆NO 水平进行多元线性回归分析后发现,这些患者记忆功能、注意力、计算能力和定向力的损害情况与NO 的表达水平呈负相关,这可能由于AD 患者的记忆功能、注意力、计算能力和定向力损害较为明显(14),且呈进行性加重,所以与NO 的水平变化趋势存在相关性。至于是否存在其他机制,尚需进一步研究。
此外,图1还可以看到有1个观察点明显偏离直线,提示这些患者虽认知功能损害严重,但NO的水平并未升高,与上述结论不完全相符,考虑其原因可能为部分患者可能为合并AD 的混合性痴呆,有研究发现,AD 患者NO 水平表达下降[15],所以对于混合性痴呆患者,NO 水平可能与认知功能损害程度不一致。
总之,NO 作为神经系统中的重要信号分子,在AD 患者血浆中表达增加,且与记忆功能、注意力、计算能力和定向力的损害有关,可以反映AD 患者的脑损伤程度。血浆NO 水平的测定有可能作为观察AD 患者认知功能损害程度的生化指标,同时亦可作为阿尔茨海默病与血管性痴呆鉴别诊断的生物学指标,对于AD 诊断具有重要意义。
1 Sperling RA,Aisen PS,Beckett LA,et al.Toward defi ning the preclinical stages of Alzheimer’s disease:Recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease.Alzheimers Dement,2011,7(3):280-292.
2 Albert MS,DeKosky ST,Dickson D,et al.The diagnosis of mild cognitive impairment due to Alzheimer's disease:Recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease.Alzheimers Dement,2011,7(3):270-279.
3 Ch telat G,Villemagne VL,Bourgeat P,et al.Relationship between atrophy and beta-amyloid deposition in Alzheimer disease.Ann Neurol,2010,67(3):317-324.
4 Luth HJ,Holzer M,Gartner U,et al.Expression of endothelial and inducible NOS-isoforms is increased in Alzheimer's disease,in APP23 transgenic mice and after experimental brain lesion in rat:evidence for an induction by amyloid pathology.Brain Res,2001,913(1):57-67.
5 Magran J,Rosen KM,Smith RC,et al.Intraneuronal beta-amyloid expression downregulates the Akt survival pathway and blunts the stress response.J Neurosci,2005,25(47):10960-10969.
6 Medeiros R,Prediger RS,Passos GF,et al.Connecting TNF-alpha signaling pathways to iNOS expression in a mouse model of Alzheimer's disease:relevance for the behavioral and synaptic deficits induced by amyloid beta protein.J Neurosci,2007,27(20):5394-5404.
7 Malinski T.Nitric oxide and nitroxidative stress in Alzheimer's disease.J Alzheimers Dis,2007,11(2):207-218.
8 Stepanichev MY,Onufriev MV,Yakovlev AA,et al.Amyloidbeta(25-35)increases activity of neuronal NO-synthase in rat brain.Neurochem Int,2008,52(6):1114-1124.
9 Vural H,Sirin B,Yilmaz N,et al.The Role of Arginine-Nitric Oxide Pathway in Patients with Alzheimer Disease.Biol Trace Elem Res,2009,129(1-3):58-64.
10 Sinem FK,Dildar E,Gökhan BM,et al.The Serum Protein and Lipid Oxidation Marker Levels in Alzheimer's Disease and Effects of Cholinesterase Inhibitors and Antipsychotic Drugs Therapy.Current Alzheimer Research,2010,7(5):463-469.
11 Parks J,Smith KTS,Trimmer PA,et al.Neurotoxic Abeta peptides increase oxidative stress in vivo through NMDA-receptor and nitric-oxide-synthase mechanisms,and inhibit complex IV activity and induce a mitochondrial permeability transition in vitro.J Neurochem,2001,76(4):1050-1056.
12 Sultana R,Perluigi M,Butterfield DA.Oxidatively modified proteins in Alzheimer's disease(AD),mild cognitive impairment and animal models of AD:role of Abeta in pathogenesis.Acta Neuropathol,2009,118(1):131-150.
13 Jagust S W,Pmitron emission temography and magnetic re9Dllance in 1agingin the diagnosis and prediction of dementia.Alzheimers Dement,2006,2(1):36-42.
14 Loewenstein DA,Acevedo A,Agron J,et al.Cognitive profiles in Alzheimer's disease and in mild cognitive impairment of different etiologies.Dement Geriatr Cogn Disord,2006,21(5-6):309-315
15 Corzo L,Zas R,Rodr guez S,et al.Decreased levels of serum nitric oxide in different forms of dementia.Neurosci Lett,2007,420(3):263-267.
