动脉粥样硬化性脑梗死患者血清C反应蛋白及血浆MMP-9的表达及意义
2012-11-20吴玉芬
周 珂 吴玉芬
脑梗死是高致死性和高致残性的疾病,其发生、发展是多因素共同作用的结果,近年来发现炎症机制在脑梗死中起着重要的作用。动脉粥样硬化也是一种慢性炎症性疾病[1],炎性活动可导致斑块的不稳定破裂,触发急性脑梗死的发生,故炎性标志物CRP及炎症反应的产物MMP-9在介导血栓形成以及动脉硬化斑块的破裂过程中的作用不容忽视,本研究旨在通过检测血清hs-CRP、血浆MMP-9的水平变化来探讨其在脑梗死患者发病过程中的作用和临床意义。
1 对象与方法
1.1 研究对象 病例组为本院神经内科住院的动脉粥样硬化性脑梗死患者35 例,其中男24 例,女11例,平均年龄(64.46±8.22)岁。符合全国第四届脑血管病学术会议修订的诊断标准[2],经头颅CT 或MRI检查确诊大动脉供血区脑梗死,均排除感染、肿瘤、近期手术或创伤、慢性结缔组织病等病史。选择同期年龄、性别相匹配的体检健康者20例为对照组,均排除心脑血管疾病史和肿瘤、感染、免疫性疾病,其中男11例,女9例,平均年龄(60.75±8.03)岁。
1.2 方法
1.2.1 胶乳增强免疫比浊法测定血清hs-CRP 水平 病例组患者于入院第2 d清晨空腹抽静脉血3 mL,注入乙二胺四乙酸抗凝管中,室温下静置0.5~1 h后离心,分离血清,-20 ℃冰箱保存,采用酶联免疫吸附法(ELISA)对血清hs-CRP 水平进行测定,ELISA 试剂盒购于北京华夏科海药用检验试剂开发研制有限责任公司。同时测定对照组的hs-CRP水平。
1.2.2 用ELISA 法检测血浆MMP-9的水平 脑梗死患者于入院后第2 d清晨抽空腹静脉血5 ml离心取上清液,标本-20 ℃保存,采用ELISA 法检测MMP-9水平,试剂盒购于武汉博士德试剂公司。同时测定对照组的MMP-9的水平。
1.2.3 颈动脉内膜中层厚度(IMT)的测定 采用LOGO-600彩色多普勒超声诊断仪,探头频率7.5 MHz;患者取仰卧位,二维观察血管走向、管腔内径、管壁厚度、有无斑块等情况;测定部位在颈动脉球部近端1 cm 总颈动脉段处,颈动脉分叉部以及球部远端1 cm 颈内动脉段后壁处,左右各3 个点,各测量3次,取平均值为颈动脉内膜中层厚度
(IMT)。
1.2.4 NIHSS评分 由一名专科医师根据美国国立卫生研究院卒中量表(NIHSS)进行神经功能缺损评分。
1.2.5 血脂指标的测定 用全自动生化分析仪测定血清胆固醇(TC)、甘油三脂(TG)、低密度脂蛋白(LDL)水平。
1.2.6 统计学处理
2 结 果
2.1 病例组与对照组hs-CRP、MMP-9、IMT、NIHSS、血脂指标的比较 病例组血清hs-CRP 水平(3.89±1.87)高于对照组(1.75±1.09),病例组血浆MMP-9 的水平(303.31±98.69)高于对照组(221.46±87.46),均有明显差异(P<0.05)(表1)。
2.2 直线相关分析 CRP 与MMP-9水平呈正相关(r=0.593,P<0.05),MMP-9与NIHSS评分呈正直线相关(r=0.442,P<0.05),CRP水平与NIHSS评分亦呈正相关(r=0.523,P<0.05)(表2、3)。
表1 病例组与对照组各项指标的比较(±s)
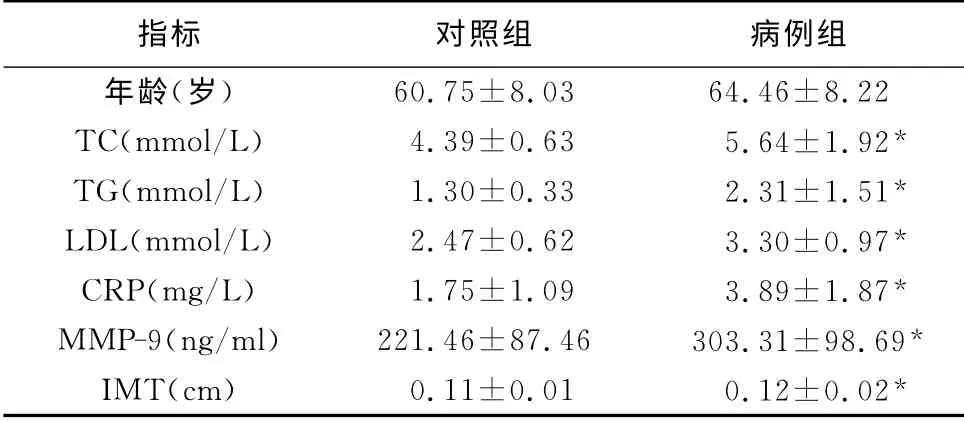
表1 病例组与对照组各项指标的比较(±s)
注:与对照组比较,*P<0.05
指标 对照组 病例组年龄(岁) 60.75±8.03 64.46±8.22 TC(mmol/L) 4.39±0.63 5.64±1.92*TG(mmol/L) 1.30±0.33 2.31±1.51*LDL(mmol/L) 2.47±0.62 3.30±0.97*CRP(mg/L) 1.75±1.09 3.89±1.87*MMP-9(ng/ml) 221.46±87.46 303.31±98.69*IMT(cm) 0.11±0.01 0.12±0.02*
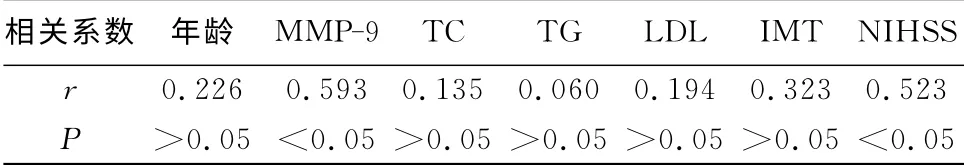
表2 病例组高敏C反应蛋白与其他指标的相关关系

表3 病例组MMP-9与其他指标的相关关系
3 讨 论
脑梗死是一种多因素疾病,动脉粥样硬化是其主要原因之一。动脉粥样硬化是一种炎性疾病,是脑梗死的重要病理基础。动脉粥样硬化包括动脉内膜的增厚、斑块的形成,动脉的狭窄。近年来无症状颈动脉粥样硬化研究(ACAS)等大规模研究发现动脉硬化斑块的性质比斑块所致的管腔狭窄更重要,斑块形成是动脉粥样硬化的典型标志,而管腔狭窄则是动脉粥样硬化进展的一个晚期表现[3],这提示人们对动脉粥样硬化斑块的不稳定性在脑梗死致病机制中的作用进行更深入的研究。
C反应蛋白(CRP)是一种急性时相反应蛋白,因其产生迅速,半衰期长,可以反复监测,在炎症性疾病的诊断中具有非常重要的价值。高敏C 反应蛋白(hs-CRP)是指测定CRP的过程中采用了更为灵敏的检测方法,是一种评估低水平炎症的方法。Vlaicu等从动脉粥样硬化的血管内膜找到C 反应蛋白,证明它存在于粥样硬化病变中[4]。本研究显示动脉粥样硬化型脑梗死组的hs-CRP水平高于对照组,表明了hs-CRP 可能参与了脑梗死的病理过程。有研究表明CRP 是敏感的炎症指示器及动脉粥样硬化的标志物,也是不稳定性动脉硬化疾病发生的危险信号,血清CRP水平与动脉粥样硬化的严重性相关[5]。炎症急性期激活的粒细胞和巨噬细胞可产生IL-6 等,其刺激肝脏产生CRP,同时也可刺激巨噬细胞产生MMP-9,促使血小板聚集,促进动脉硬化及斑块不稳定性发展。CRP 可能与动脉粥样斑块的不稳定性有联系,其机制可能与通过激活补体途径参与炎症反应,甚至促发斑块破裂及局部血栓形成、调节血管紧张性和通透性而影响神经元的能量供应以及加重组织及神经元的损伤。IMT增厚是动脉粥样硬化的早期阶段,Lorenz等进行的大样本研究表明CRP只与动脉粥样硬化早期IMT水平有关系,控制年龄,性别和心血管相关危险因素后CRP水平与进展的动脉粥样硬化的IMT 不相关[6]。本实验也显示脑卒中患者CRP 的水平与IMT 厚度无相关性。新近研究表明hs-CRP可能是脑梗死的独立预测因子,Denooijer等人研究认为CRP直接诱导内皮细胞的凋亡及单核细胞产生TNF-α、IL-1β、MMP-9等炎性介质,这些因素促进动脉粥样硬化斑块的破裂,促进脑梗死的发生[7]。一些前瞻性的研究结果显示,炎性标志物水平的增高,尤其是C 反应蛋白(CRP)增高的个体,其未来脑卒中的危险性大大增加,CRP水平的增高预示着缺血性脑卒中患者的预后不良。本实验相关性分析显示,血清hs-CRP 与神经功能损伤程度评分呈直线相关,hs-CRP水平越高,神经功能损伤程度越重,这与国内外报道一致。
基质金属蛋白酶(MMP)是一大类细胞外基质(ECM)降解酶,MMP-9又称明胶酶B,它与动脉粥样硬化及缺血性脑血管病关系密切,近年研究表明动脉粥样硬化的每个时期都有MMP 的参与。Ian等根据动脉硬化斑块病人有无症状及出现时间分成4个亚组,测定MMP-9 的水平,行TCD 检测微血栓,术后斑块进行组织学检查[8]。本研究结果发现,微血栓患者斑块中的MMP-9 的水平较高,组织学检查中斑块内出血、破裂、溃疡的患者斑块中的MMP-9的水平也高,证实MMP-9是斑块的不稳定性的标志,在斑块破裂触发缺血事件中有重要作用。Fugimura等人的研究观察缺血大鼠MMP-9 的表达,并用Evans蓝外渗法观察血脑屏障的改变,结果表明血脑屏障(BBB)通透性增加[9]。Kelly PJ等人的研究显示在脑梗死早期增强的氧化应激与MMP-9的表达有密切的关系,使用合成的MMPs抑制剂可以不同程度地抑制以上改变[10]。
本实验结果显示脑梗死组血浆MMP-9的水平较对照组明显升高(P<0.05),有统计学差异,且血浆MMP-9的水平与NIHSS评分相关,表明MMP-9可能参与了脑梗死的病理过程,且MMP-9可反映病情的严重程度,这与之前的报道类似。MMP-9是斑块不稳定性的指标,其与IMT 的关系研究较少,本实验显示两者无明显相关性,MMP-9 与NIHSS评分有关,IMT 与NIHSS评分无关,表明在动脉粥样硬化性脑梗死中斑块的不稳定性比斑块引起的狭窄更重要。
本研究发现CRP 与MMP-9 的水平呈直线正相关,CRP水平越高,MMP-9的水平越高。研究表明AoiCRP可直接诱导内皮细胞的凋亡及单核细胞产生TNF-α,IL-1β等炎性介质,继而增加MMP-9的产生,而内皮细胞凋亡和MMP-9 产生增加了动脉粥样硬化斑块的不稳定性,可促进动脉粥样硬化斑块的破裂[3,7]。
炎性机制在动脉粥样硬化性脑梗死中起着重要的作用,通过研究动脉粥样硬化脑梗死血清CRP及血浆MMP-9的水平,认识两者间的内在联系,可为运用炎症因子的拮抗剂治疗脑梗死提供新的理论依据。
1 Yehuda S,Yaniv S,Dror H.Atherosclerosis as an infectious,inflammatory and autoimmune disease.Trends in Immunology,2001,22:293-295.
2 中华神经外科学会.各类脑血管疾病诊断要点.中华神经科志,1996,29(6):379-380.
3 Aoi N,Masatoshi K,Hiroto U,et al.C-reactive protein induces endothelial cell apoptosis and matrix metalloproteinase-9 production in human mononuclear cells:Implications for the destabilization of atherosclerotic plaque.Atherosclerosis,2008,196(1):129-135.
4 Vlaicu H,Rus F,Niculescu,et al.Immunoglobulins and complement components in human aortic atherosclerotic intima.Atherosclerosis,1985,55(1):35-50.
5 Hashimoto H,Kitagawa K,Hougaku H,et al.Relationship between C-reactive protein and progression of early carotidatherosclerosis in hypertensive subjects.Stroke,2004,35(7):1625-1630.
6 Lorenz MW,Karbstein P,Markus HS,et al.High-sensitivity Creactive protein is not associated with carotid intima-media progression:the carotid atherosclerosis progression study.Stroke,2007,38(6):1774-1779.
7 De-Nooijer R,Verkleij C,Thusen J,et al.Lesional over expression of matrix metallo-proteinase-9 promotes intraplaque hemorrhage inadvanced lesions but not at earlier stages of atherogenesis.Arterioscler Thromb Vasc Biol,2006,26(2):340-346.
8 Ian M,Loftus M,Ross N,et al.Increased Matrix Metalloproteinase-9 activity in unstable carotid plaques a potential role in acute plaque disruption.Stroke,2000,31:40-47.
9 Fujimura M,Gasche Y,Fujimura Y,et al.Early appearance of activated matrixmetall-oproteinase-9 and blood-brain barrier disruption in mice after focal cerebral ischemia and reperfusion.Brain Res,1999,842(1):92-100.
10 Kelly P,Morrow J,Ning M,et al.Oxidative stress and matrix metalloproteinase-9in acute ischemic stroke -The biomarker evaluation for antioxidant therapies in stroke (BEAT-stroke)study.Stroke,2008,39(3):100-104.
