自发性颈内动脉夹层分离致缺血性脑卒中6例临床分析
2012-11-17胡银宝刘训灿王守春
胡银宝, 姜 超, 刘训灿, 王守春
颈内动脉夹层分离(Internal carotid artery dissection,ICAD)发病率低,临床少见,容易误诊和漏诊,导致严重残疾甚至危及生命。本文回顾性总结6例引起缺血性脑卒中的自发性缺血性颈内动脉夹层分离(Spontaneous dissection of the internal carotid artery,sICAD)患者的临床资料,结合相关文献,探讨其临床特征及治疗方法,为这类疾病的正确诊治提供依据。
1 临床资料
1.1 一般资料 选自我院神经内科2008年1月~2010年4月住院的sICAD患者共6例,均为男性,年龄为42~67岁,平均年龄49岁。均经DSA(Digital subtraction angiography,DSA)证实。既往高血压病史4例,糖尿病病史1例,血脂异常1例,烟酒嗜好3例。
1.2 临床表现 急性或亚急性起病。6例患者均以局灶性神经功能缺损症状就诊。其中1例以反复TIA起病,后进展为脑卒中,并行静脉溶栓后症状基本恢复正常,但几小时后再次发病不缓解。
全组仅1例出现典型的“三联征”,即患侧头颈痛、horner综合征及脑或视网膜缺血症状。其他5例仅存在“三联征”中的1或2个症状。缺血主要表现为颈内动脉系统受累所致脑梗死或TIA的症状,如一侧偏瘫或面舌瘫、偏身感觉障碍等。其中伴有头颈部疼痛5例(83.3%),horner综合征1例(16.7%)。
1.3 影像学结果 本组均为单侧ICAD(左侧4例,右侧2例),仅累及C1段3例;自C1撕裂至C2段2例;自C1撕裂至C4段1例。6例头部MRI均表现为颈内动脉区脑缺血改变,3例MRI可见流空血管腔周围出现环形或新月形高信号(见图1);4例头部MRA示颅内血管未见异常;患者均行颈部MRA检查,其中2例原始像在颈内动脉部位可见无血流的圆形低信号区,该区比正常管腔小,周围有半月形的高信号区,但回报均为颈内动脉狭窄;1例行颈部CTA检查高度怀疑ICAD。全组行颈部彩超均提示低流速高阻力血流信号改变,发现真假腔者仅1例。DSA检查中,2例呈真假“双腔”,3例呈“鼠尾征”或“线样征”(见图2),1例表现为颈内动脉分叉上2cm串珠样狭窄改变。
1.4 治疗及随访结果 自出现症状到行DSA检查的时间,除1例急诊就诊,在入院当天即行DSA检查外,其余病例在出现症状后1~3个月内得到确诊并给予治疗。5例行血管内治疗,其中对1例合并椎动脉重度狭窄的患者同时行椎动脉支架置入术,对1例整段颈内动脉较长夹层形成的急诊患者行3枚支架串联置入治疗,2例置入串联支架2枚,1例置入支架1枚(见图3)。术后均予以联合抗血小板聚集治疗。另1例症状轻且累及C4段的sICAD患者,仅行抗凝后续抗血小板保守治疗。
经血管内治疗的患者,治疗后狭窄的血管恢复正常管径,造影显示狭窄处、假性动脉瘤或双腔消失。1例行内科保守的患者治疗后症状也缓解。所有患者在发病后8个月~1年进行随访,均行颈部彩超及TCD检查病变处未见明显狭窄。用改良的Rankin Scale(Modified Rankin Scale,mRS)作为脑卒中预后的评分,经过积极治疗,mRS评分由病初(3.40±1.64)分提高到随诊时的(2.31 ±1.97)分。
2 讨论
ICAD是中青年脑卒中的主要原因之一。由于部分ICAD症状不典型,其确切的发病率目前尚难以确定,据统计该病发病率约为2.6~3/10万。Arnold等[1]报道欧洲平均发病年龄为44~46岁。本文报道6例患者中均无明显外伤史,故均为sICAD。其中既往4例高血压病史,1例糖尿病病史,1例血脂异常,3例烟酒嗜好。以上动脉粥样硬化的高危因素可能参与了sICAD的发生过程[2]。
典型的ICAD三联征是患侧头痛、面或颈痛和horner综合征及数小时或数天出现脑或视网膜缺血症状。但不足<1/3的患者有“三联征”,若“三联征”中有2个症状存在,则强烈支持ICAD诊断[3]。据Donas等报道,CAD常见的临床症状中头颈痛占80%,霍纳氏综合征占25%,TIA和脑梗死占56%[4]。本组中仅1例表现为典型的ICAD“三联征”,其他5例仅存在“三联征”中的1或2个症状,同时症状缺乏特异性,故仅依靠临床表现来诊断颈动脉夹层比较困难。颅内段颈动脉夹层还可以有同侧颅神经麻痹、蛛网膜下腔出血等。本研究的6例患者夹层多发生在颅外段颈内动脉,仅1例累及C4段,但无颅神经麻痹症状,也无蛛网膜下腔出血。
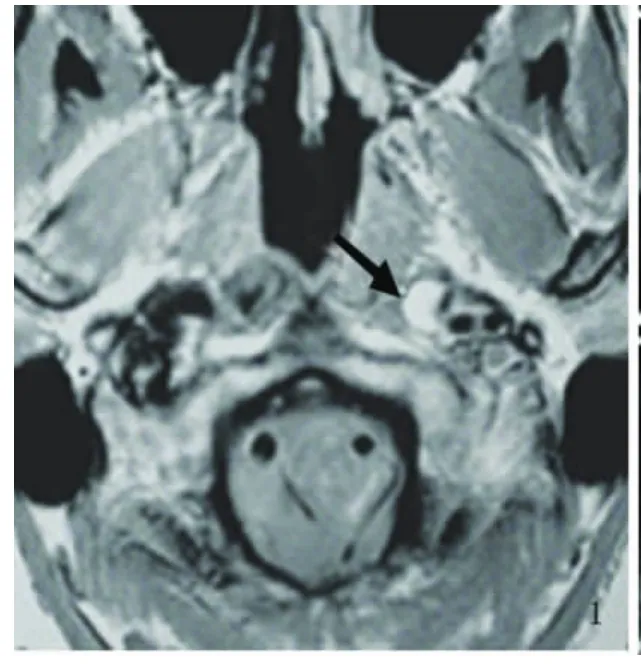
图1 左侧颈内动脉MRI-T1呈新月型动脉夹层的血肿
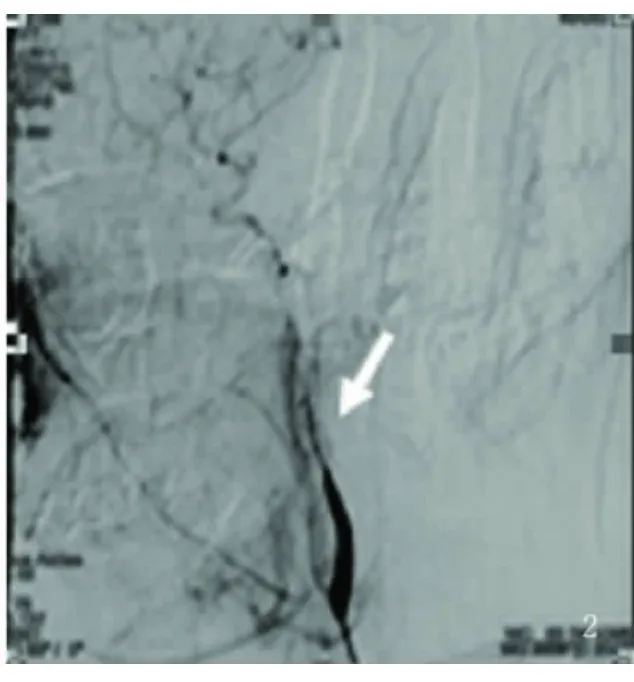
图2 DSA颈内动脉夹层分离受累血管呈“鼠尾征”改变
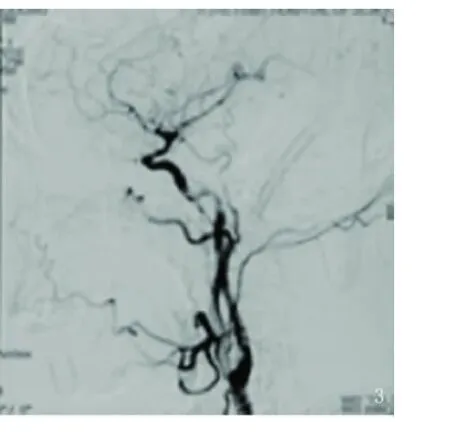
图3 DSA颈内动脉夹层分离支架置入术后,远端血管通畅
DSA是诊断sICAD的金标准。DSA能直观显示血管腔变化和相应的不规则的动脉壁,其特征性表现为内膜瓣或双腔,常见的征象为颈内动脉锥形狭窄(“鼠尾征”或“线样征”)、火焰状闭塞和动脉瘤等[5]。本文报道中2例呈真假“双腔”,3例呈“鼠尾征”或“线样征”,1例颈内动脉分叉上2cm串珠样狭窄改变。DSA的缺点是它看不到壁内血肿,而典型MRI征象表现为流空血管腔周围出现环形或新月形高信号;脂质抑制MRI显示血管腔内明亮的新月征。MRA则可以显示夹层的真假双腔和内膜瓣。本研究3例可见受累血管壁内血肿、新月征,2例颈部MRA原始图像在颈内动脉部位可见无血流的圆形低信号区,该区比正常管腔小,周围为半月形的高信号区,因此 MRI联合MRA检查,将增加ICAD的敏感性与特异性。CTA则可更好的显示出内膜瓣、真假双腔及线样征。本组1例颈部CTA提示颈内动脉局部呈不规则扩张,扩张段与颈内动脉虹吸段连接处较狭窄。颈部CT强化横切面示扩张段内可见“V”形充盈缺损。该患者颈部CTA诊断与DSA诊断也相符合。此外,6例头部MRI均表现为脑缺血改变,4例颅内血管检查未见异常,这也进一步证实了sICAD所致的脑卒中是由于颈部血管病变导致的。由于sICAD多发生在颈内动脉分叉后2~3cm以上,颈部血管彩超诊断夹层存在困难,本组仅1例发现膜样结构形成的真假双腔。
目前sICAD治疗包括药物治疗、血管内治疗和外科治疗3种方法。抗凝和抗血小板聚集治疗是常用的药物治疗方法。本研究1例症状较轻且夹层累及C4段的患者,经抗凝后续单药抗血小板治疗,症状缓解无复发。Jensen等[6]认为,对无症状的ICAD可首先进行抗凝和抗血小板聚集治疗,当血流动力学改变存在卒中危险,或存在抗凝、抗血小板聚集药物治疗禁忌证时,则考虑采取血管内和外科治疗。Schirmer等[7]报道缺少充分侧枝循环代偿的低灌注的ICAD患者单独抗凝是不够的,支架置入是安全有效的治疗方法。本组6例均采用单药或联合抗血小板治疗,其中5例联合血管内支架成形术治疗,术后定期的颈部彩超及TCD联合血管评估无再狭窄;1例经静脉溶栓治疗后再次复发患者,急诊支架治疗后症状完全缓解,显示支架治疗较内科治疗具有独特优势。
[1]Arnold M,Kappeler L,Georgiadis D,et al.Gender differences in spontaneous cervical artery dissection [J].Neurology,2006,67(6):1050-1052.
[2]张 娟,胡立文,汪 颜.复发性青年脑卒中与颈动脉夹层动脉瘤(附1例报道)[J].中风与神经疾病杂志,2008,25(4):482-483.
[3]Flis CM,Jtiger HR,Sidhu PS.Carotid and vertebral artery dissection:clinical aspects,imaging features and endovascular treatment[J].Eur Radiol,2007,17(3):820-834.
[4]Donas KP,Mayer D,Guber I,et al.Endovascular repair of extracranial carotid artery dissection:current status and level of evidence[J].Vasc Interv Radiol,2008,19(12):1693-1698.
[5]Provenzale JM.Dissection of the internal carotid and vertebral arteries:imaging features[J].AJR Am J Roentgenol,1995,165(5):1099-1104.
[6]Jensen MB,Chacon MR,Alen A.Cervicocerebral arterial dissection[J].Neurologist,2008,4(1):34-42.
[7]Schirmer CM,Atalay B.Endovascular recanalization of symptomatic flow-limiting cervical carotid dissection in an isolated hemisphere[J].Neurosurg Focus,2011,30(6):16.
