超声波辅助提取藜蒿多酚工艺优化及抗氧化活性研究
2012-11-15涂宗财叶云花
涂宗财,张 露,王 辉,叶云花,刘 玮
(1.南昌大学食品科学与技术国家重点实验室,江西南昌330047;2.江西师范大学,江西南昌330022)
超声波辅助提取藜蒿多酚工艺优化及抗氧化活性研究
涂宗财1,2,张 露1,王 辉1,叶云花2,刘 玮1
(1.南昌大学食品科学与技术国家重点实验室,江西南昌330047;2.江西师范大学,江西南昌330022)
以藜蒿为原料,采用超声波辅助法提取藜蒿多酚,研究其最佳提取工艺及体外抗氧化活性。结果表明:超声波辅助提取藜蒿多酚的最佳条件为:液固比20∶1(mL/g),提取次数2次,乙醇浓度30%(v/v),超声功率200W,提取时间80min,提取温度80℃,在此条件下,多酚得率为1.858%±0.023%。体外抗氧化实验表明:藜蒿多酚粗提液(PAST)的抗氧化能力随多酚浓度的增加而增强,当多酚浓度大于148.80μg/mL时,PAST对DPPH·的清除能力高于BHA而与没食子酸相当;还原能力顺序为:没食子酸>PAST>BHA,在实验浓度范围内,PAST的还原能力相当于BHA的1.24~1.33倍。
藜蒿,多酚,超声波,提取,抗氧化活性
近年来,多酚类物质的生物活性及其对人体的保健防病作用日益受到人们的关注。许多流行病和实验研究发现,多酚类物质具有抗癌、降血压、清除自由基、延缓机体衰老、减缓或抑制脂质氧化和阻碍有毒氧化产物的形成等作用[1-2]。由于高血压、糖尿病、心脏病等疾病在人群中发病率逐年增加,天然的无毒抗氧化资源的开发成为科学工作者急需解决的问题。藜蒿(Artemisia selengnesis Turcz)是菊科蒿属植物,又名蒌蒿、狭叶艾,是以根茎和嫩茎供食的一种野生蔬菜,性凉、味甘、叶性平,具有清热解毒、平抑肝火、祛风湿、消炎和镇咳等功效[3]。药理研究证明,藜蒿具有保护肝脏[4]、抗真菌[5]、抗肿瘤和提高免疫[6]等功能。但从藜蒿中提取多酚类物质以及酚类粗提液的抗氧化活性的相关研究很少,本实验采用超声波辅助醇提法,从藜蒿中提取多酚,研究料液比、提取次数、乙醇浓度、超声温度、超声时间和功率对多酚得率的影响,通过正交实验得出最佳提取工艺,并测定藜蒿多酚粗提液的DPPH·清除能力和还原能力,为进一步研究藜蒿的药理和保健作用提供参考。
1 材料与方法
1.1 材料与仪器
藜蒿 于2011年4月采集于鄱阳湖,经江西省农科院鉴定;无水乙醇、Folin-Ciocalteu试剂、BHA、无水Na2CO3、FeCl3、K3[Fe(CN)6]等 均为分析纯,购于天津永大化学试剂有限公司;没食子酸(分析标准品,>99%) 购于阿拉丁;DPPH 购于sigma公司。
KQ5200DE数控超声波清洗器 昆山市超声仪器有限公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限公司;JD200-3B电子分析天平 沈阳龙腾电子有限公司;V-1001旋转蒸发仪 上海爱朗仪器有限公司;HH-4数显水浴锅 国华电器有限公司。
1.2 实验方法
1.2.1 粗提液中总酚含量测定 采用Folin-Ciocalteau法,参照M Madhava Naidu[7]的实验方法略加修改,于760nm处测定吸光值,以没食子酸的质量浓度(μg/mL)为横坐标,以吸光值(A)为纵坐标绘制标准曲线,得曲线回归方程:Y=0.0112X+0.0068,R2=0.9994。
1.2.2 工艺流程[8-9]准确称取2.0g藜蒿粉末,加乙醇超声提取,离心,收集上清液,沉淀中再加入等浓度等体积的乙醇浸提,离心,合并上清液(浸提次数=提取次数-1),浓缩,定容至100mL,取适量样品溶液,按1.2.1测提取液中总多酚含量并计算得率。
1.2.3 单因素实验 以藜蒿多酚得率为指标,研究液固比(15∶1、20∶1、30∶1、40∶1、50∶1、60∶1)、提取次数(1、2、3、4)、乙醇浓度(30%、40%、50%、60%、70%、80%)、超声功率(80、120、160、180、200W)、超声温度(40、50、60、70、80℃)、超声时间(0.5、1.0、1.5、2.0、2.5、3.0h)对藜蒿多酚得率的影响。
1.2.4 正交实验 分析单因素实验结果,确定对藜蒿多酚得率影响较大的4个因素,用L9(34)因素水平表进行正交实验(表1)重复三次。以藜蒿多酚得率为指标,得出超声波辅助提取藜蒿多酚的最佳工艺并对最佳工艺进行验证。

表1 L9(34)正交实验因素水平Table 1 Factors and levels of L9(34)orthogonal design
1.2.5 抗氧化性实验
1.2.5.1 藜蒿多酚样品的制备 在最佳工艺条件下提取藜蒿多酚,定容至100mL后测总酚浓度,得藜蒿多酚粗提液(PAST),备用。
1.2.5.2 DPPH·清除能力实验[10]以0.372mg/mL的没食子酸和BHA为标准对照,取2.0mL不同浓度(11.16~186.00μg/mL)的样品溶液于比色管中,加入2.0mL 2×10-4mol/L DPPH溶液,充分混合后避光反应30min,最后于510nm处测吸光值Ai。用无水乙醇调零,重复三次,每次平行测两次,计算清除率(IDPPH)。

式中:Acontrol:2.0mL无水乙醇和2.0mL DPPH的吸光值;Aj:2.0mL样品溶液和2.0mL无水乙醇的吸光值。
1.2.5.3 还原能力实验[11-12]向含有不同浓度(7.74~ 29.76μg/mL)样品的1.5mL 0.2mol/L、pH6.6的磷酸盐缓冲溶中加入1.5mL铁氰化钾溶液,摇匀,50℃反应20min后加入1.5mL三氯乙酸溶液终止反应,再加入3.0mL去离子水和0.6mL FeCl3溶液,摇匀后于700nm处测吸光值。重复三次,每次平行测两次,取平均值。
2 结果与讨论
2.1 单因素实验结果分析
2.1.1 料液比对藜蒿多酚得率的影响 液固比对藜蒿多酚得率的影响如图1所示,由图可知,液固比为30∶1时多酚得率最高(1.19%±0.03%),其次为20∶1,由于溶剂提高10倍,多酚得率仅增加0.85%,考虑到乙醇的用量和后续加工工序,最佳液固比确定为20∶1。

图1 液固比对多酚得率的影响(平均值±SD,n=6)Fig.1 Effect of liquid/solid ratio on polyphenol yield(mean±SD,n=6)
2.1.2 提取次数对藜蒿多酚得率的影响 提取次数对藜蒿多酚得率的影响如图2所示,随着提取次数的增加,多酚得率呈现先上升后下降的趋势,提取3次时得率达最大,为1.13%±0.07%。实验发现,提取次数越多,上清液颜色越深,静置后生成的沉淀越多,这可能会使部分多酚被沉淀吸附导致多酚损失。由于提取2次后提取次数增加对多酚得率影响不大甚至出现下降,考虑到成本、耗时和样品纯度的综合因素,提取次数确定为2次。

图2 提取次数对多酚得率的影响(平均值±SD,n=6)Fig.2 Effect of extraction time on polyphenol yield(mean±SD,n=6)
2.1.3 乙醇浓度对藜蒿多酚得率的影响 乙醇浓度对藜蒿多酚得率的影响如图3所示,随乙醇浓度上升,多酚得率先上升后下降,在40%时有最高得率1.30%± 0.03%;当浓度大于40%时,得率随乙醇浓度的增加而降低。实验发现,上清液低温保藏过夜后均有深绿色沉淀生成,且乙醇浓度越高,沉淀物越多,这可能与溶剂的极性和提取物的溶解性有关,初步确定乙醇浓度为40%。
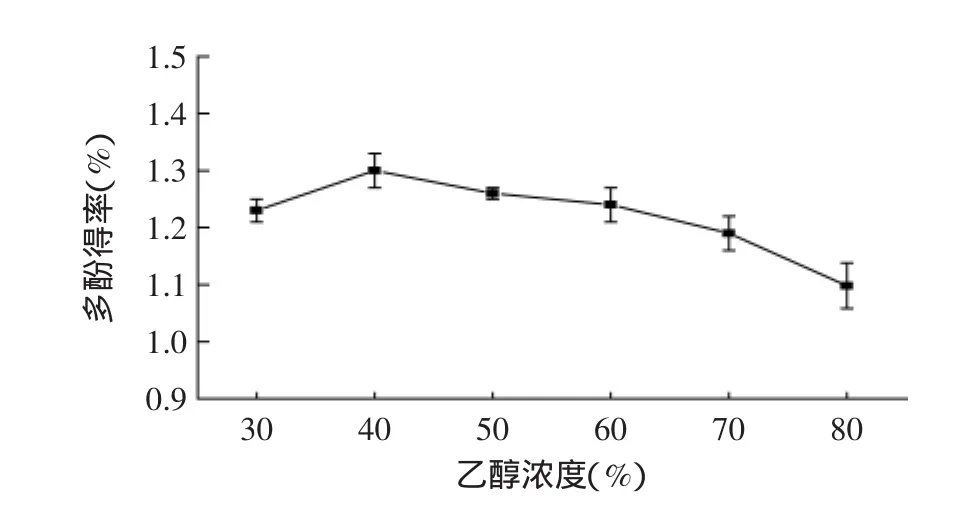
图3 乙醇浓度对多酚得率的影响(平均值±SD,n=6)Fig.3 Effect of ethanol concentration on polyphenol yield(mean±SD,n=6)
2.1.4 超声功率对藜蒿多酚得率的影响 超声功率对藜蒿多酚得率的影响如图4所示,超声功率为180W时,多酚得率最大,为1.40%±0.01%;当超声功率大于180W时,得率有微弱的下降。这可能是因为多酚具有热不稳定性,易氧化分解[13],超声波产生的瞬时高温使部分热不稳定的目标提取物分解而使多酚得率下降,因此,超声功率初步确定为180W。

图4 超声功率对多酚得率的影响(平均值±SD,n=6)Fig.4 Effect of ultrasonic power on polyphenol yield(mean±SD,n=6)
2.1.5 超声温度对藜蒿多酚得率的影响 超声温度对多酚得率的影响如图5所示,温度对多酚得率的影响很大,多酚得率随提取温度的增加而增加,但温度升高使能量消耗增大、成本增加,且在70℃之后,温度增加10℃得率仅提高2.3%。综合考虑仪器操作条件及能耗,提取温度定为70℃。

图5 超声温度对多酚得率的影响(平均值±SD,n=6)Fig.5 Effect of ultrasonic temperature on polyphenol yield(mean±SD,n=6)
2.1.6 超声时间对藜蒿多酚得率的影响 超声时间对多酚得率的影响如图6所示,随超声时间的增加多酚得率先提高后下降。一般来说,提取时间越长,溶解出的胞内物越多,但多酚不稳定,热处理时间越长越易氧化分解,使总酚含量下降[14],且使提取液中杂质含量升高,所以超声时间定为1.0h。

图6 超声时间对多酚得率的影响(平均值±SD,n=6)Fig.6 Effect of ultrasonic time on polyphenol yield(mean±SD,n=6)
2.2 正交实验

表2 L9(34)正交实验及极差分析结果Table 2 L9(34)trial schemes and range analysis results
正交实验结果如表2所示,各因素的极差顺序为:RC>RD>RA>RB,即实验因素对多酚得率影响的主次顺序为:超声时间>超声温度>乙醇浓度>超声功率,由直观分析可知,最佳因子组合为:A1B3C3D3,所以超声波辅助提取藜蒿多酚的最佳工艺为:液固比20∶1(mL/g),提取次数2次,乙醇浓度30%(v/v),超声功率200W,提取时间80min,提取温度80℃,在此条件下藜蒿多酚的得率为1.863%。验证性实验多酚得率为1.858%±0.023%。
2.3 DPPH·清除能力实验
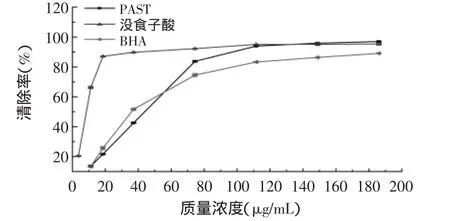
图7 PAST、没食子酸和BHA对DPPH·的清除能力(平均值±SD,n=6)Fig.7 DPPH·scavening ability of ASTP,gallic acid and BHA(mean±SD,n=6)
PAST、没食子酸、BHA对DPPH·的清除能力如图7所示,由图可知,随三种物质在反应液中浓度的增加,其对DPPH·的清除能力逐渐增强。当样品浓度大于111.6μg/mL时,PAST对DPPH·的清除能力高于BHA;浓度高于148.80μg/mL时,PAST对DPPH·的清除能力与没食子酸相当(P<0.05);多酚浓度为186.00μg/mL时,DPPH·的清除率达97.00%±0.23%,因此藜蒿多酚具有很强的自由基清除能力,可成为开发抗氧化药物的一种潜在资源。
2.4 还原能力实验
在反应体系中混合物吸光值的变化能指示出样品的还原能力高低,吸光值越大样品的还原能力越强,表明样品的抗氧化活性越好[12]。由图8可知,实验样品的还原能力与样品浓度之间存在明显的正向线性关系,多酚浓度越高,样品的还原能力越强,三种样品的还原能力为:没食子酸>PAST>BHA(P<0.01),在实验浓度范围内(7.74~29.76μg/mL),PAST的还原能力为BHA的1.24~1.33倍。因此藜蒿多酚是一种良好的抗氧化剂。

图8 PAST、没食子酸和BHA的还原能力(n=6)Fig.8 Reducing power of PAST,gallic acid and BHA(mean±SD,n=6)
3 结论
3.1 超声波辅助提取藜蒿多酚的最佳提取条件为:液固比20∶1(mL/g),提取次数2次,乙醇浓度30%(v/v),超声功率200W,提取时间80min,提取温度80℃。此时,藜蒿多酚的得率为1.863%,验证实验多酚得率为1.858%±0.023%。
3.2 体外抗氧化性研究表明,藜蒿多酚粗提液对DPPH·的清除能力和还原能力均随多酚浓度的增加而增强,当多酚浓度大于111.6μg/mL时,粗提液对DPPH·的清除能力高于BHA;浓度高于148.80μg/mL时,粗提液对DPPH·的清除能力与没食子酸相当;相同浓度下,藜蒿多酚粗提液的还原能力比没食子酸弱但高于BHA,在实验浓度范围内,藜蒿多酚的还原能力相当于BHA的1.24~1.33倍。因此,藜蒿多酚具有很好的抗氧化能力,藜蒿可成为开发抗氧化药物的一种潜在资源。
[1]Julio B D,Vanessada S F,Alejandro P,et al.Antiatherogenic and anti-angiogenic activities of polyphenols from propolis[J]. Journal of Nutritional Biochemistry,2011(7):1-9.
[2]Manach C,Williamson G,Morand C,et al.Bioavailability and bioefficacy of polyphenols in humans I.Review of 97 bioavailability studies[J].American Journal of Clinical Nutrition,2005,81(1):230-242.
[3]Veenashri B R,Muralikrishna G.In vitro antioxidant activity of xylo-oligosaccharides derived from cereal and millet brans-A comparative study[J].Food Chemistry,2011,126(3):1475-1481.
[4]幸欣.藜蒿三萜的提取、分离及保护肝脏功能的研究[D].南昌:南昌大学,2005.
[5]郑功源,陈红兵,邓丹雯,等.藜蒿提取物抑菌作用的初步研究[J].天然产物研究与开发,1998,11(3):72-75.
[6]沈夕坤,王玳珠,江国荣.蒌蒿药理作用的初步研究[J].药学进展,1999,23(1):41-43.
[7]Madhava Naidu M,Shyamala B N,Pura Naik J,et al.Chemical composition and antioxidant activity of the husk and endosperm of fenugreek seeds[J].Food Science and Technology,2011,44(2):451-456.
[8]汤春甫,单杨,李高阳,等.超声波辅助提取橘皮酚酸的工艺研究[J].食品工业科技,2010,31(8):223-229.
[9]陈海光,黄敏,于立梅.超声波辅助提取青皮竹叶黄酮工艺的研究[J].食品工业科技,2010,31(9):245-247.
[10]Roberta S,Paola C,Mirco L,et al.Biochemical characterisation and antioxidant activity of mycelium of Ganoderma lucidum from central Italy[J].Food Chemistry,2009,116(1):143-151.
[11]Zovko Konccic M,Kremer D,Gruz J,et al.Antioxidant and antimicrobial properties of Moltkia petraea(Tratt.)Griseb.flower,leaf and stem infusions[J].Food and Chemical Toxicology,2010,48(6):1537-1542.
[12]Liu J,Wang C N,Wang Z Z,et al.The antioxidant and freeradical scavenging activities of extract and fractions from corn silk(Zea mays L.)and related flavone glycosides[J].Food Chemistry,2011,126(1):261-269.
[13]Xi J,Shen D J,Zhao S,et al.Characterization of polyphenols from green tea leaves using a high hydrostatic pressure extraction [J].International Journal of Pharmaceutics,2009,382(1-2):139-143.
[14]黄雪松.一些加工条件对姜酚稳定性的影响[J].食品工业科技,2006,27(2):92-94.
Study on optimization of ultrasound-assisted extraction of polyphenol from Artemisia selengnesis Turcz and its antioxidant activities
TU Zong-cai1,2,ZHANG Lu1,WANG Hui1,YE Yun-hua2,LIU Wei1
(1.State Key Lab of Food Science and Technology,Nanchang University,Nanchang 330047,China;2.Jiangxi Normal University,Nanchang 330022,China)
Taking Artemisia selengnesis Turcz as material,the optimum extracting conditions and antioxidant activity of polyphenol from Artemisia selengnesis Turcz(PAST)by ultrasound-assisted extraction was carried out.The optimal parameters were as follows:liquid/solid ratio 20∶1(mL/g),extraction times 2,ethanol concentration 30%(v/v),ultrasonic power 200W,ultrasonic time 80min and ultrasonic temperature 80℃,the highest yield(1.858%±0.023%)was obtained under this conditions.Antioxidant assays showed that the antioxidant activity of PAST increased with the increasing concentration of polyphenol.The scavenging ability on DPPH·of PAST was higher than that of BHA and corresponded to gallic acid when its concentration was above 148.80μg/mL. The reducing power of samples was:gallic acid>PAST>BHA.The reducing power of PAST,under tested concentration,was 1.24 to 1.33 fold of BHA.
Artemisia selengnesis Turcz;polyphenol;ultrasonic;extraction;antioxidant activity
TS201.1
B
1002-0306(2012)05-0239-04
2011-10-21
涂宗财(1965-),男,博士,教授,博士生导师,主要从事天然产物开发与利用研究。
国家科技型中小企业技术创新基金项目(09C26213604437);赣鄱英才555工程。
