源于鸡蛋清溶菌酶ACE抑制肽的分离纯化及结构鉴定
2012-11-15饶胜其刘锋锋徐雯琪杨严俊1
饶胜其,刘锋锋,居 涛,徐雯琪,杨严俊1,,*
(1.江南大学食品科学与技术国家重点实验室,江苏无锡214122;2.江南大学食品学院,江苏无锡214122;3.扬州大学食品科学与工程学院,江苏扬州225127)
源于鸡蛋清溶菌酶ACE抑制肽的分离纯化及结构鉴定
饶胜其1,2,3,刘锋锋2,居 涛2,徐雯琪2,杨严俊1,2,*
(1.江南大学食品科学与技术国家重点实验室,江苏无锡214122;2.江南大学食品学院,江苏无锡214122;3.扬州大学食品科学与工程学院,江苏扬州225127)
利用胃肠消化酶系水解疏水性氨基酸含量高的蛋清溶菌酶蛋白,筛选能抗胃肠消化的高活性ACE抑制肽。通过超滤、制备型反相高效液相色谱(RP-HPLC)、分析型RP-HPLC纯化、氨基酸组成分析及基质辅助激光解吸电离飞行时间串联质谱(MALDI-TOF-TOF-MS),从胃肠消化水解液中分离鉴定出两种ACE抑制肽Lys-Val-Phe(KVF)和Trp-Ile-Arg(WIR),化学合成该两种三肽后,ACE抑制活性测定结果显示其IC50值分别为14μmol/L与88.5μmol/L。研究结果表明,蛋清溶菌酶蛋白来源的ACE抑制肽有望用于高血压的预防与治疗。
溶菌酶,ACE抑制肽,分离纯化,质谱
ACE抑制肽是一类能降低人体血压的小分子多肽,通常为2~12个氨基酸残基,是血管紧张素转化酶(ACE)的抑制剂,可通过抑制体内血管紧张素Ⅱ和促进纾缓激肽的生成达到降低血压的目的[1]。自从Ferreira等[2]首次从蛇毒中发现了一种具有ACE抑制活性的肽以来,降血压肽的研究已引起了各国研究学者的兴趣,经过几十年的发展,人们已通过不同提取方法(天然产物的直接提取、微生物发酵及蛋白酶水解法等),利用多种生化分离技术(超滤、凝胶色谱、离子交换色谱或RP-HPLC制备色谱等),结合目标肽的氨基酸组成与质谱分析,现已分离鉴定出多种结构、序列及长度大小不一的ACE抑制肽[3-5],其中90%以上的ACE抑制肽都来源于蛋白的酶解产物。但是体内外实验表明,只有能抵抗胃肠消化酶消化(如LHLPLP[6]、IQP[7]、VPP与IPP[8]等)或能被胃肠消化酶(如KVLPVPQ[9]等)或ACE酶(如VWIS[10]、LKPNM[11]等)降解成更小片段的、依然具有甚至更强ACE抑制活性的肽段才具有体内降压效果,此类ACE抑制肽(也可以称为降压肽)是广大学者研究的重点。近年来,尽管研究学者已从鸡蛋蛋白中鉴定出不同长度的ACE抑制肽[12-15],但是由于溶菌酶在鸡蛋总蛋白中所占比例小(不到5%),属于低丰度蛋白,筛选时很容易被漏掉。经过氨基酸序列组成分析,溶菌酶蛋白序列具有高比例的疏水性氨基酸与碱性氨基酸,适合筛选ACE抑制肽[16]。本研究利用胃肠消化模拟体系水解蛋清溶菌酶,旨在筛选能抗胃肠消化的高活性ACE抑制肽,发掘新的活性肽段,扩大降压肽肽库,为降压肽的构效关系及降压机理提供活性肽段来源。
1 材料与方法
1.1 材料与仪器
溶菌酶 大连绿雪蛋品发展有限公司;血管紧张素转换酶(ACE)、马尿酰组胺酰亮氨酸(HHL) 美国Sigma公司。
Ultra 15超滤离心管 美国Millipore公司;紫外分光光度计UV-2450日本岛津公司;pH计 梅特勒-托利多仪器(上海)有限公司;真空离心浓缩仪 FABCONCO公司;Waters 1525液相色谱仪、基质辅助激光解吸电离飞行时间串联质谱(MALDI-TOF-TOF MS) 美国Waters公司。
1.2 实验方法
1.2.1 体外消化模拟 参考Vermeirssen等[17]的方法。称取200mg高纯溶菌酶粉末,用100mL稀的HCl(pH2)溶液重悬溶解,在加酶水解前于80℃恒温水浴锅中加热20min(变性蛋白,使得蛋白结构疏松,易于受到蛋白酶的降解),待冷却至室温后,先后用胃蛋白酶(pH2,酶/底物=1/50,w/w)与胰蛋白酶(pH7.5,酶/底物=1/50,w/w)和胰凝乳蛋白酶(pH7.5,酶/底物=1/50,w/w)的复合酶于37℃各水解5h,并定时取少量样品于-20℃冻藏待用,待反应完毕后,95℃,加热15min终止酶反应。整个水解过程于酶反应器中进行,且通过酸碱滴定控制pH。水解液离心并超滤(截留分子量3ku)后,收集滤过液,冻干,-20℃冻藏。
1.2.2 ACE抑制肽的纯化 称取一定量的酶水解液的冻干粉溶解在超纯水中(浓度6mg/mL),经脱气及0.22μm水膜过滤处理后,上制备柱Sunfire Pre C18column(19×150mm,5μm,Waters)纯化。色谱条件如下:流动相A为0.065%的三氟乙酸(TFA),流动相B为乙腈(含0.05%TFA);上样量1mL;流速为7mL/min;检测波长为214nm;梯度洗脱条件:0~5min,5%B;5~65min,5%~65%B。分管收集各个组分峰,于离心真空浓缩仪中蒸干,分别加入200μL超纯水重悬溶解,-20℃冻藏。
将ACE抑制活性高且产率高的F8组分进一步用分析柱XBridgeTMC18column(4.6mm×150mm)纯化。色谱条件如下:流动相A为0.065%TFA,流动相B为乙腈(含0.05%TFA),上样量20μL;流速为1mL/min;检测波长214nm;梯度洗脱条件如下:0~45min,10%~25%B。收集主要组分,多次上样并将相同峰合并,后于真空离心浓缩仪中蒸干,加入200μL超纯水重悬溶解,-20℃冻藏。
1.2.3 ACE抑制肽的液质联用(UPLC-MS/MS)鉴定
利用液质联用鉴定分析型RP-HPLC色谱得到的高ACE抑制活性组分的氨基酸序列。色谱条件为:色谱柱Acquity UPLC BEH C18column(2.1×120mm,1.7μm,Waters);流动相为乙腈/甲酸(流速0.3mL/min);梯度洗脱条件如下:乙腈在20min内浓度由0上升到20%;色谱洗脱出的多肽进入基质辅助激光解吸电离飞行时间串联质谱(MALDI-TOF-TOF-MS)检测。质谱条件:质量扫描范围为50~2000m/z;毛细管电压为3.5kV;锥孔电压为30V;单级质谱及二级质谱的碰撞能量分别为6eV和20eV;离子源温度为100℃。采用MassLynx4.1软件解析MS/MS图谱及鉴定多肽的氨基酸序列,并将鉴定出的多肽序列与溶菌酶的一级氨基酸序列进行匹配。
1.2.4 ACE抑制率的测定 样品ACE抑制率的测定参考Cushman的方法并稍做改动[18]。每个测试反应的总体积为0.2mL。测定流程如下:a.于2mL的eppendorf管中加入80μL HHL(溶解在0.1mol/L含0.3mol/L氯化钠的硼酸盐缓冲液中,5mmol/L,pH=8.3),加入一定体积的测试样品,并用0.1mol/L硼酸盐缓冲液定容至190μL,将此混合液短暂离心混匀后,放入37℃恒温水浴中保温5min;b.逐管加入10μL ACE酶液(3mU),启动反应后37℃恒温保育30min;c.加入0.2mL 1mol/L HCl终止反应,再加入1.2mL预冷(-20℃)的乙酸乙酯,经15s振荡混匀后,4500r/min离心5min,移取0.8mL酯层,转入另一个离心管中,于真空离心浓缩仪中蒸干(80℃,30min),重新溶于0.8mL的去离子水中,剧烈振荡混匀后在228nm处测定吸光度。空白对照管除在反应前先加入0.2mL的1mol/L HCl外,其余操作相同。抑制率计算式如下:
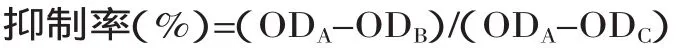
式中:ODB为存在抑制剂时的吸光值;ODA为不存在抑制剂时的吸光值(用去离子水代替水解液);ODC为抑制剂与酶都不存在时的吸光值(用去离子水代替水解液,并在反应前加盐酸终止反应)。ACE抑制率为50%时对应的肽含量为IC50值。
1.2.5 邻苯二甲醛(OPA)法测定肽浓度及蛋白水解度[19]OPA试剂的配制:准确称取40mg OPA溶解于1mL甲醇中,分别加入2.5mL质量分数20%的SDS、25mL浓度为0.1mol/L的硼砂及100μLβ巯基乙醇,用蒸馏水定容到50mL,此为OPA试剂,且使用前即时配制。用不同浓度的胰酶水解的酪蛋白胨来制作标准曲线,100μL样品溶液与2mL试剂室温下反应2min,在340nm下比色,查标准曲线即可以得到多肽的含量。蛋白水解度计算公式如下:
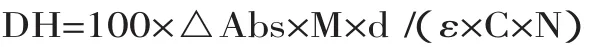
式中:△Abs指被测样品在340nm处的吸收值与未水解样品在340nm处的吸收值的差值;M指被测蛋白的相对分子质量(溶菌酶蛋白分子量为14304u);d指稀释倍数(41);ε指340nm处的摩尔消光系数(6000/mol·cm);C指被测蛋白的质量浓度(2mg/mL);N表示每个蛋白分子的肽键总数(128)。
1.2.6 氨基酸组成分析 采用邻苯二甲醛(OPA)柱前衍生反相高效液相色谱法测定[20]。将样品加入6mol/L HCl溶液,真空封口,在1℃下水解24h,冷却定容、过滤、蒸干,OPA柱前衍生[脯氨酸与氯甲芴甲酯(FMOC)反应]后上氨基酸专用高效液相色谱仪分析。
1.2.7 数据统计分析 采用SPSS 12.0软件对数据进行统计分析,用Duncan’s多重分析进行组间显著性检验,显著水平为P<0.05。
2 结果与讨论
2.1 溶菌酶的体外模拟消化
为了从溶菌酶蛋白中分离鉴定出能抗胃肠消化的高活性ACE抑制肽,本研究对高纯溶菌酶进行了胃肠蛋白酶的分步水解。溶菌酶蛋白经胃蛋白酶水解5h后,其水解产物的ACE半抑制浓度(IC50值)就达到(144.2±1.3)μg/mL,但此时对应的水解度仅为6.2%。研究报道溶菌酶高度α螺旋的二级结构具有较强的抗胃蛋白酶消化性,是导致水解度过低的原因[21]。
溶菌酶蛋白经胃蛋白酶水解5h后,进一步受到肠道消化酶(胰蛋白酶和胰凝乳蛋白酶)5h的水解,其终产物的水解度增加至22.5%,IC50值也降低至(15.6±1.4)μg/mL,相对胃蛋白酶水解液,其ACE抑制活性提高了近10倍。说明随后的肠道消化酶对于高活性ACE抑制肽的释放起了决定性的作用,证明这种模拟体内消化过程的分步水解法很适合从食源性蛋白中筛选抗胃肠消化的ACE抑制肽。
2.2 RP-HPLC分离纯化ACE抑制肽

图1 制备型RP-HPLC分离水解液中ACE抑制肽的图谱Fig.1 Chromatogram of ACE inhibitory peptides from gastrointestinal digestion separated by preparative RP-HPLC
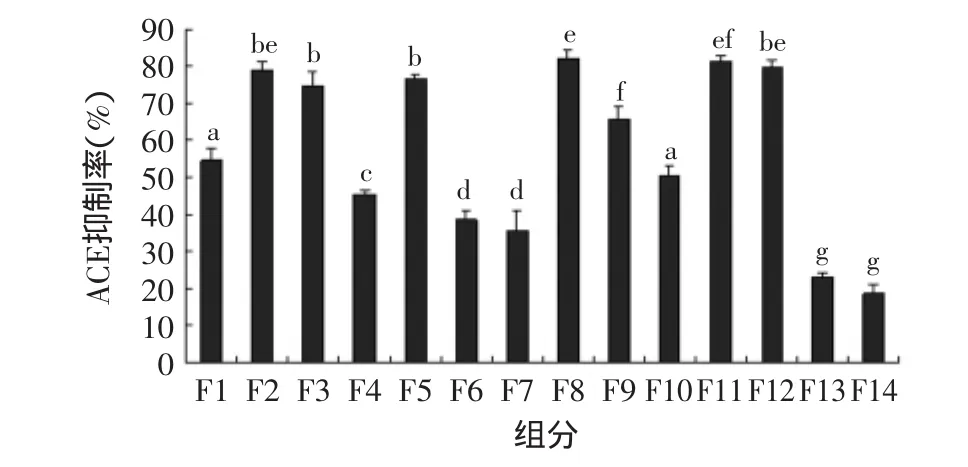
图2 制备型RP-HPLC收集组分的ACE抑制活性Fig.2 ACE inhibitory activity of fractions obtained from preparative RP-HPLC
水解液经制备型RP-HPLC分离后,分步收集了14个组分,如图1所示。将收集到的组分离心真空浓缩蒸干溶剂后,分别加入200μL 0.1mol/L硼酸盐缓冲液(含0.3mol/L NaCl,pH8.3)溶解,并取样测定各组分的ACE抑制活性,结果见图2。半数以上组分的ACE抑制率在50%以上,本研究中选择了产率高且活性最高的F8组分进行下一步的分离纯化。F8组分经分析型RP-HPLC分离后得到两个主要组分F8-a与F8-b,重复上样,收集并合并相同峰,用离心真空浓缩仪蒸干溶剂,分别加水重悬,检测其ACE抑制活性,结果显示,F8-a与F8-b组分的ACE抑制率分别为23.2%与91.3%(图3)。
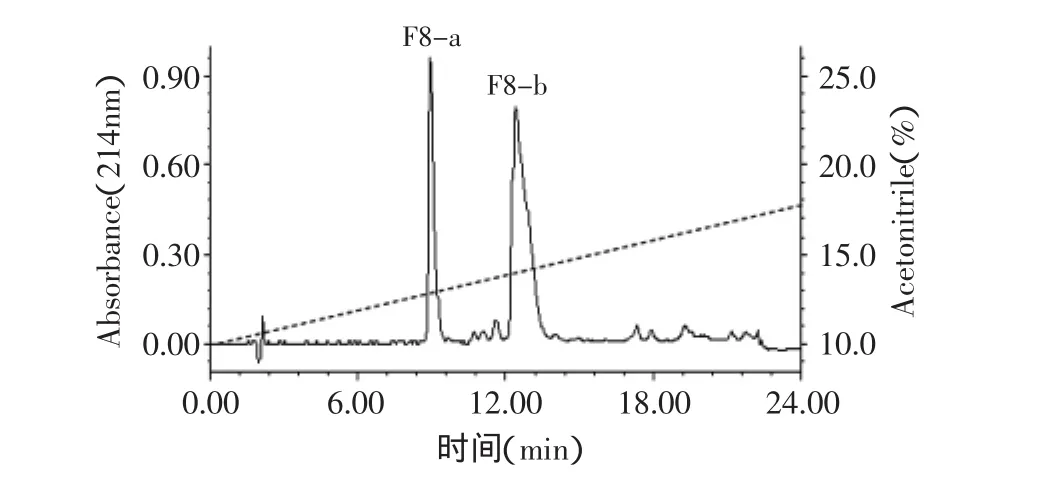
图3 组分F8的分析型RP-HPLC分离色谱图Fig.3 Chromatography of the fraction F8 peptides separated by analytical RP-HPLC
2.3 肽序列分析
基质辅助激光解吸电离飞行时间质谱(Matrix-Assisted Laser Desorption/Ionization Time of Flight Mass Spectrometry,MALDI-TOF-MS)是近年发展起来的一种新型的软电离质谱,能精确测定蛋白质或多肽的相对分子量,分析速度快,操作容易,灵敏度和分辨率较高且样品用量少,同时结合液相色谱的联用技术可以提高鉴定多肽物质的效率,尤其是当各种原理的质谱技术串联应用时,不但可以得到多肽的相对分子量信息,还能对其序列结构进行解析[22]。

图4 组分F8-b的一级质谱图Fig.4 MS spectrum of the fraction F8-b
对F8-b组分进行MALDI-TOF MS分析,如图4,该组分的一级质谱图(6eV的低能量碰撞)上出现两个丰度最强的的离子峰393.24m/z和474.27m/z,并均具有对应的二聚体离子峰785.53m/z和947.63m/z,据此判别393.24m/z和474.27m/z为组分F8-b中的两种主要母离子(A)和(B)。分别选择该两种母离子进入MALDI-TOF-TOF二级质谱,经较高电子能量(本研究中使用20eV)的惰性气体碰撞后产生多种肽链碎片,基于这些碎片及其质量数差值,通过质谱分析的MaxEnt3计算软件和PepSeq序列分析软件即可推断出该肽段序列。肽链在适宜能量碰撞条件下,其碎裂具有一定的规律,主要在肽主链骨架上三种不同的键处断裂,而对多肽侧链化学键的裂解非常微弱,因而肽链的断裂方式和形成的碎片类型表现出相当程度的选择性,可能形成的碎片离子见图5。其中,酰胺键相对于其它化学键更容易断裂,因此,b系列离子和y系列离子出现的机率较大[23],是解析氨基酸序列的关键离子,其它系列离子可以用于辅助解析肽序列。在本研究中,组分F8-b中两种母离子(图4A和图4B)的二级质谱图分别见图6A和图6B,利用软件解析得到母离子的氨基酸序列分别为KVY与WIR。从图6A可看出,序列KVY的bn和yn两个系列碎片离子都得到了较好匹配(序列匹配度达到100%),WIR的yn系列碎片离子也得到了很好的匹配(序列匹配度得到98%),且两肽序列均与母体蛋白溶菌酶相匹配,分别位于溶菌酶N端序列的f(1-3)与f(123-125)位置。另外,该组分的多肽氨基酸分析的结果也与质谱解析出来的这两个三肽的氨基酸序列组成相吻合,有关KVY和WIR的结构表征信息见表1。
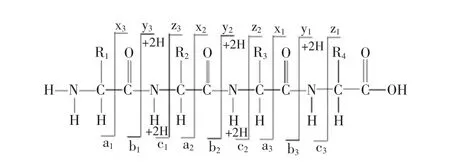
图5 肽链骨架断裂及其命名Fig.5 Fragmentation of peptide backbone and the nomenclature

图6 组分F8-b中主要离子峰的二级质谱图Fig.6 MS/MS spectrum of the precursor ions from MS of the fraction F8-b
2.4 ACE抑制肽的构效关系
对鉴定出的两个三肽KVF与WIR化学合成后,进行了体外ACE抑制活性测定,结果显示其IC50值分别为14μmol/L与88.5μmol/L。Ondetti等[24]的研究认为,C-末端三肽残基很可能是与ACE活性位点结合的关键部位,特别是对疏水性氨基酸残基(包括芳香族与带支链的脂肪族氨基酸)的亲和力较强。Cheung等[25]研究也认为,活性较强的ACE抑制肽C-末端氨基酸一般为具有环状结构的芳香族氨基酸(如W、Y和F)或脯氨酸。本研究中三肽KVF的C-末端为芳香族氨基酸Phe,而且C末端倒数第二位置的Val也为疏水的带支链的脂肪族氨基酸,这种序列结构很可能对于其ACE抑制活性起了关键作用。而且,本研究中的ACE抑制三肽KVF含有同样或类似的已经报道的二肽序列VF、VW、VY和IW(其IC50分别为9.2、1.4、7.1、2.0μmol/L)[26],且与油菜籽来源的RIY(IC50值为28μmol/L)[27]具有很类似的三肽结构,都是N-末端为碱性氨基酸及C-末端为芳香族氨基酸,这类三肽结构很可能易于与ACE的活性位点结合,从而对ACE的活性起到抑制作用。也有不与Ondetti和Cheung的ACE抑制模型相一致的,比如C-末端为Arg的AVYPQR、ALPMHIR与ALKAWSVAR,同样具有很强的ACE抑制活性,其IC50值分别为15、42.6、3μmol/L[28],Meisel认为是Arg上带正电荷的胍基对ACE的抑制作用起了重要作用[29]。本研究中分离鉴定出的三肽WIR的C-末端也为Arg,同时倒数第二位置为带支链的脂肪族氨基酸Ile及N-末端为疏水性的芳香族氨基酸Trp,这些位置的氨基酸应该都贡献了对ACE的抑制作用。
3 结论
总之,本研究通过体外消化模拟,从溶菌酶蛋白的胃肠消化酶酶解产物中分离鉴定出两种高活性的ACE抑制三肽KVY和WIR,其IC50分别为14μmol/L与88.5μmol/L,实验结果表明,溶菌酶来源的ACE抑制肽有潜力被用于预防与治疗高血压。进一步的原发性高血压大鼠实验有待证实溶菌酶的胃肠消化水解液及本研究中纯化鉴定的两种ACE抑制肽的体内降压效果。

表1 ACE抑制肽的结构表征Table 1 Structural characterization of ACE inhibitory peptides
[1]CIJohnston.FranzVolhardLecture.Renin-angiotensinsystem:a dual tissue and hormonal system for cardiovascular control[J]. Journal of Hypertension-Supplement,1992,10(7):13-26.
[2]S H Ferreira,M Rocha e Silva.Potentiation of bradykinin and eledoisin by BPF(bradykinin potentiating factor)from Bothrops jararaca venom[J].Experientia,1965,21(6):347-349.
[3]P Jakala,H Vapaatalo.Antihypertensive peptides from milk proteins[J].2010(3):251-272.
[4]L Vercruysse,J Van Camp,G Smagghe.ACE inhibitory peptides derived from enzymatic hydrolysates of animal muscle protein:A review[J].Journal of Agricultural and Food Chemistry,2005,53(21):8106-8115.
[5]C Guang,R D Phillips.Plant food-derived angiotensin I-converting enzyme inhibitory peptides[J].Journal of Agricultural and Food Chemistry,2009,57(12):5113-5120.
[6]A Quiros,M D Contreras,M Ramos,et al.Stability to gastrointestinal enzymes and structure-activity relationship of beta-casein-peptideswith antihypertensive properties[J]. Peptides,2009,30(10):1848-1853.
[7]J Lu,D F Ren,Y L Xue,et al.Isolation of an antihypertensive peptide from alcalase digest of spirulina platensis[J].Journal of Agricultural and Food Chemistry,2010,58(12):7166-7171.
[8]Y Nakamura,N Yamamoto,K Sakai,et al.Purification and characterization of angiotensin I-converting enzyme inhibitors from sour milk[J].Journal of Dairy Science,1995,78(4):777-783.
[9]M Maeno,N Yamamoto,T Takano.Identification of antihypertensive peptides from casein hydrolysate produced by a proteinase from Lactobacillus helveticus CP790[J].Journal of Dairy Science,1996,73:1316-1321.
[10]E D Marczak,H Usui,H Fujita,et al.New antihypertensive peptides isolated from rapeseed[J].Peptides,2003,24:791-798.
[11]H Fujita,K Yokoyama,M Yoshikawa.Classification and antihypertensive activity of angiotensin I-converting enzyme inhibitory peptides derived from food proteins[J].Journal of Food Science,2000,65:564-569.
[12]H Yoshii,N Tachi,R Ohba,et al.Antihypertensive effect of ACE inhibitory oligopeptidesfrom chicken egg yolks[J]. Comparative Biochemistry and Physiology C-Toxicology and Pharmacology,2001,128(1):27-33.
[14]M Miguel,M Manso,A Aleixandre,et al.Vascular effects,angiotensin I-converting enzyme(ACE)-inhibitory activity,and antihypertensive properties of peptides derived from egg white[J]. Journal of Agricultural and Food Chemistry,2007,55:10615-10621.
[15]J B Liu,Z P Yu,W Z Zhao,et al.Isolation and identification of angiotensin-converting enzyme inhibitory peptides from egg white protein hydrolysates[J].Food Chemistry,2010,122:1159-1163.
[16]辛志宏,马海乐,吴守一.食品蛋白质中降血压肽的功能与应用[J].食品与发酵工业,2003,29(8):84-87.
[17]V Vermeirssen,J Van Camp,L Devos,et al.Release of angiotensin I converting enzyme(ACE)inhibitory activity during in vitro gastrointestinal digestion:from batch experiment to semicontinuous model[J].Journal of Agricultural and Food Chemistry,2003,51(19):5680-5687.
[18]D W Cushman,H S Cheung.Spectrophotometric assay and properties of the angiotensi-converting enzyme of rabbit lung [J].Biochemical Pharmacology,1971,20:1637-1648.
[19]F C Church, H E Swaisgood, D H Porter,etal. Spectrophotometric assay using o-phthaldialdehyde for determination of proteolysis in milk and isolated milk-proteins [J].Journal of Dairy Science,1983,66:1219-1227.
[20]牟德海.OPA柱前衍生反相高效液相色谱法测定氨基酸含量[J].色谱,1997,15(4):319-321.
[21]S J You,C C Udenigwe,R E Aluko,et al.Multifunctional peptides from egg white lysozyme[J].Food Research International,2010,43(3):848-855.
[22]苏珊娜·尼尔森主编,杨严俊等译.食品分析[M].第二版.北京:中国轻工出版社,2002:474-475.
[23]李宇航,戴海学,李晓蓉.葛根素的电喷雾电离裂解规律解析[J].质谱学报,2007(4):224-228.
[24]M A Ondetti,D W Cushman.Enzymes of the reninangiotensin systemand their inhibitors[J].Annual Review of Biochemistry,1982,51:283-308.
[25]H Cheung,F Wang,M A Ondetti,et al.Binding of peptide substrates and inhibitors of angiotensin-converting enzyme. Importance of the COOH-terminal dipeptide sequence[J]. Journal of Biological Chemistry,1980,255:401-407.
[26]JLoponen.Angiotensin converting enzyme inhibitory peptides in Finnish cereals:a database survey[J].Agricultural and Food Science,2004,13(1-2):39-45.
[27]E D Marczak,H Usui,H Fujita,et al.New antihypertensive peptides isolated from rapeseed[J].Peptides,2003,24(6):791-798.
[28]R J FitzGerald,H Meisel.Milk protein-derived peptide inhibitors of angiotensin-I-converting enzyme[J].British Journal of Nutrition,2000,84:33-37.
[29]H Meisel.Overview on milk protein-derived peptides[J]. International Dairy Journal,1998,8:363-373.
Isolation and identification of ACE inhibitory peptides from the gastrointestinal digests of egg white lysozyme
RAO Sheng-qi1,2,3,LIU Feng-feng2,JU Tao2,XU Wen-qi2,YANG Yan-jun1,2,*
(1.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China;3.School of Food Science and Engineering,Yangzhou University,Yangzhou 225127,China)
The objective was to screen potent ACE inhibitory peptides,which were resistant to gastrointestinal digestion,from enzymatic hydrolysate of egg white lysozyme by gastrointestinal enzymes.Two angiotensin I-converting enzyme(ACE)inhibitory peptide KVF and WIR,were purified from the gastrointestinal digests of egg white lysozyme by centrifugal ultrafiltration,preparative reverse-phase high-performance liquid chromatography(RP-HPLC)and analytical RP-HPLC,and identified by matrix assisted laser desorption ionization time of flight tandem mass spectrometry(MALDI-TOF-TOF-MS)based on analysis of amino acids composition.After KVF and WIR was chemically synthesized,ACE inhibitory activities(IC50)of these two tripeptides were determined as 14μmol/L and 88.5μmol/L,respectively.The results suggested that the ACE inhibitory peptides from egg white lysozyme may have potential for use in the prevention and treatment of hypertension.
lysozyme;ACE inhibitory peptide;isolation;mass spectrometry
TS201.2+5
A
1002-0306(2012)05-0090-05
2011-03-24 *通讯联系人
饶胜其(1981-),男,在读博士研究生,研究方向:食品生物技术。
国家863计划项目(2007AA10Z330)。
