硝酸酯类槲皮素衍生物的制备及抗氧化活性研究
2012-11-15李芳耀杨新平文杜鹃邓海东
韦 静,李芳耀,杨新平,文杜鹃,邓海东
(1.桂林医学院研究生学院,广西桂林541004;2.桂林医学院药学院,广西桂林541004)
硝酸酯类槲皮素衍生物的制备及抗氧化活性研究
韦 静1,李芳耀2,*,杨新平2,文杜鹃2,邓海东2
(1.桂林医学院研究生学院,广西桂林541004;2.桂林医学院药学院,广西桂林541004)
以槲皮素为起始原料,通过两步反应制备两种新型硝酸酯类槲皮素衍生物,其结构经1H-NMR及ESI-MS确证,初步考察产物对DPPH·和·OH自由基的清除性能。结果表明,两种槲皮素衍生物对DPPH·清除率分别为88.7%和90.1%,对·OH清除率分别为78.6%和80.6%,其IC50分别为4.2、4.5mg/L和19.2、22.3mg/L。
槲皮素,抗氧化活性,衍生物
自由基是人体正常代谢过程中的产物,其含量过多或过少都会产生氧化应力,从而导致DNA和蛋白质受损。研究表明,衰老、动脉粥样硬化、糖尿病、恶性肿瘤、白内障等众多疾病都与活性氧自由基密切相关。从中草药活性成分中寻找和开发具有较强清除自由基作用的低毒抗氧化剂已成为人们研究的热点[1]。槲皮素是最广泛存在的一种天然黄酮类化合物,是多种中草药(如黄芪、绞股蓝、天胡荽和香青兰等)的有效成分[2-4]。槲皮素具有广泛的药理作用和生物活性,如保护心肌缺血、增强免疫功能及镇痛等作用,并且还具有抗氧化、抗炎、抗衰老、抗突变、抗癌、抗菌、抗病毒、抗动脉粥样硬化等多种生理功能[5-6],研究表明,槲皮素与某些金属离子形成配合物后,具有更强的清除自由基活性[7-8]。硝酸酯类化合物具有舒张血管平滑肌、抑制心肌收缩力、抗血小板聚集和抗血栓形成、抗血细胞黏附、抗血管平滑肌细胞的增殖、抑制内皮素的生成等生物活性[9],但其抗氧化活性研究未见文献报道。基于以上考虑,本研究以槲皮素为先导物,通过不同的碳链偶联硝酸酯基团,设计合成了2个新型硝酸酯类槲皮素衍生物。制备方案如图1,目标产物的结构经1H-NMR和MS谱确证,初步研究了产物的体外抗氧化活性。
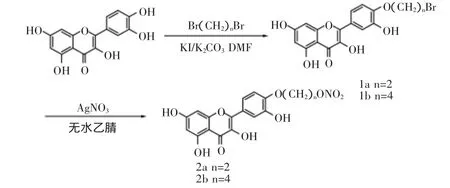
图1 目标产物的合成路线Fig.1 The synthetic routes of target compounds
1 材料与方法
1.1 材料与仪器
二苯代苦味酰自由基(DPPH·) Sigma公司;其它试剂 均为市售分析纯,必要时经无水处理。
超导核磁共振仪 瑞士Bruck公司;电喷雾质谱仪 美国Bruck公司;TU-1901型双光路紫外可见分光光度计 北京普析通用仪器有限责任公司;ZF7三用紫外分析仪 巩义市予华仪器有限责任公司。
1.2 实验方法
1.2.1 4′-溴乙氧基槲皮素(1a)和4′-溴丁氧基槲皮素(1b)的制备 将0.75g槲皮素溶解于20mL无水DMF中,加入2.09g无水碳酸钾,常温下反应1h。然后加入1.3mL 1,2-二溴乙烷,升温至70℃,恒温反应5h,TLC跟踪反应进程。然后将烧瓶中的溶液倒入装有大量冰水的烧杯中,并加入NaCl,抽滤,得到沉淀,柱层析分离得到淡黄色结晶0.38g,产率为35.2%。同法制备4′-(2-硝基氧基)乙氧基槲皮素(2a),得淡黄色结晶0.49g,产率为43.1%。
1.2.2 4′-(2-硝基氧基)乙氧基槲皮素(2a)和4′-(2-硝基氧基)乙氧基槲皮素(2b)的制备 将0.72g硝酸银溶入6.0mL无水乙腈中,避光,加热至50℃,迅速加入4′-溴乙氧基槲皮素(1a)0.28g与无水乙腈的混合液10mL,加毕,升温至80℃,恒温反应7h,TLC跟踪反应进程。反应结束,抽滤,滤饼用少量乙腈洗涤,收集滤液并减压浓缩,得到黄色固体。用柱层析分离得到淡黄色固体0.19g,产率为71.2%。1H-NMR(CDCl3,500 MHz)δ:4.04(2H,t,-CH2-O),4.23(2H,t,-CH2-ONO2),4.34~4.38(3H,s,5-OH,7-OH,3’-OH),6.40(1H,s,8-CH),6.50(1H,s,6-CH),7.04(1H,s,5’-CH),7.70~7.73(2H,m,1’-CH and 6’-CH),12.62(1H,s,3-OH);ESIMS m/z:393[M+H]+。同法制备4′-(2-硝基氧基)乙氧基槲皮素(2b),产率为65.3%。δ:1.89~1.94(4H,m,-CH2CH2CH2CH2-),4.03(2H,t,-CH2-O),4.25(2H,t,-CH2-ONO2),4.07~4.45(3H,s,5-OH,7-OH,3’-OH),6.33(1H,s,8-CH),6.42(1H,s,6-CH),7.07(1H,s,5’-CH),7.70~7.74(2H,m,1’-CH and 6’-CH),12.62(1H,s,3-OH);ESI-MS m/z:421[M+H]+。
1.2.3 DPPH·清除能力测定 产物对DPPH·清除作用的测定参考文献[10]的方法。分别将各种不同浓度化合物2a~2b的甲醇溶液0.1mL,加到3.9mL 0.004% DPPH的甲醇溶液中,30min后在517nm处测其吸光度,同时测定DPPH空白溶液的吸光度,每样品平行测3次,取其平均值,绘制DPPH·清除率对化合物浓度曲线,如图1,计算半清除率IC50值。
1.2.4 ·OH清除活性测定 参考文献[11],在反应体系中加入0.2mol/L、pH=7.4的磷酸缓冲溶液1.0mL,520mg/L的番红溶液0.2mL,1.0mL EDTA-Fe2+,然后加入不同浓度的样品试液7.0mL,最后加入6%H2O2溶液0.8mL,混合均匀,在40℃水浴保温0.5h,在波长520nm处测吸光度。空白组以等体积的去离子水代替样品溶液;对照组以等体积的去离子水代替样品溶液和EDTA-Fe2+溶液,每样品平行测3次,取其平均值,绘制清除·OH的活性曲线,如图2,计算半清除率IC50值。
2 结果与讨论
设计并合成两个新型硝酸酯类槲皮素衍生物,其结构经1H-NMR及ESI-MS确证,所合成的2个硝酸酯类槲皮素衍生物B环上5′和6′位置的1H-NMR都向低场移动,初步确定烃基在4′位取代。将目标产物溶解于一定量的甲醇中,测定试样的加AlCl3的紫外吸收光谱,然后加入盐酸再测,对比两次测定的紫外光谱发现几乎没有任何变化,充分说明了B环上没有邻二羟基存在,可以确定烃基在4′位取代。
2a和2b的1H NMR谱大部分相差不大,只是2b比2a在化学位移1.89~1.94ppm处多4个氢,这是2b比2a多两个亚甲基的缘故。2a与1a相比,由于硝基氧基取代了溴,导致原来与溴相连的亚甲基上的氢向低场移动,化学位移从3.68ppm增为4.23ppm,2b与1b的氢谱也有类似的变化,导致原来与溴相连的亚甲基上的氢化学位移从3.66ppm增为4.25ppm,说明硝基氧基已经取代了溴。

图2 产物和槲皮素清除DPPH·的活性Fig.2 Scavenging capability of target compounds and quercetin on DPPH free radicals
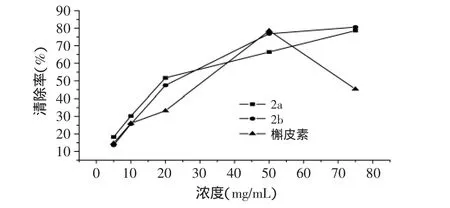
图3 产物和槲皮素清除·OH的活性Fig.3 Scavenging capability of target compounds and quercetin on hydroxyl free radicals
目标产物2a和2b对DPPH·清除率分别为88.7%和90.1%,IC50分别达到4.2、4.5mg/L;对·OH清除率分别为78.6%和80.6%,IC50分别达到19.2、22.3mg/L,表明产物均具有较强的清除自由基的能力。槲皮素浓度在50mg/mL时达到阈值,继续增加其浓度,其清除·OH能力下降[12]。
3 结论
通过对槲皮素的结构修饰,得到两个硝酸酯类槲皮素衍生物,通过体外对自由基的清除作用证实产物可有效清除DPPH·和·OH,其对DPPH·和·OH的半清除率均小于槲皮素,分别为4.2、4.5mg/L和19.2、22.3mg/L,其中2b对·OH清除率分别为80.6%,有望通过进一步结构修饰,开发出新型自由基清除剂。
[1]Pan YM,Liang Y,Wang HS,et al.Antioxidant activities of several Chinese medicine herbs[J].Food Chemistry,2004,88(3):347-350.
[2]石继亮,单玉,张振秋,等.HPLC法同时测定黄芪中槲皮素、山奈酚、芒柄花素的含量[J].药物分析,2010,30(1):114-116.
[3]陈代武,李杰红.绞股蓝中槲皮素提取条件的优化[J].时珍国医国药,2009,20(6):1407-1408.
[4]王祥培,许士娜,吴红梅,等.天胡荽药材中槲皮素的薄层鉴别与含量测定[J].时珍国医国药,2010,21(1):44-45.
[5]舒毅,谭陶,张思宇,等.槲皮素的药理学研究进展[J].华西药学杂志,2008,23(6):689-691.
[6]王艳芳,王新华,朱宇同.槲皮素药理作用研究进展[J].天然产物研究与开发,2003,15(2):171-173.
[7]吴春,黄梅桂,车春波.槲皮素-锌(Ⅱ)配合物清除自由基的活性研究[J].食品工业科技,2010,31(1):128-129.
[8]谢伟玲,杨培慧,蔡继业.锗(Ⅳ)-槲皮素配合物的制备、表征及其抗氧化活性测定[J].分析化学,2010,38(12):1809-1812.
[9]罗刚,陈宇英.硝酸酯类一氧化氮供体药物研究进展[J].中国新药杂志,2010,19(15):1322-1328.
[10]Larrauri J A,Sanchez Moreno C,Saura Calixto F.Scavenging capaeity of extracts from red and white grape pomace peels[J].J Agriculture Food Chemistry,1998,46(7):2694-2697.
[11]刘锡建.沙棘果渣总黄酮的提取、精制和抗氧化性能研究[D].北京:北京化工大学,2004.
[12]Ca0 G,Softc E,Prior R L.Antioxidant and prooxidant behavior of flavonoids:structure-activity relationships[J].Free Redical Biology&Medicine,1997,22(5):749-760.
Study on preparation and antioxidant activity of quercetin derivatives coupled with nitrate moiety
WEI Jing1,LI Fang-yao2,*,YANG Xin-ping2,WEN Du-juan2,DENG Hai-dong2
(1.Graduate College,Guilin Medical University,Guilin 541004,China;2.Pharmacy College,Guilin Medical University,Guilin 541004,China)
Two novel quercetin derivatives coupled with nitrate moiety were prepared with alkylene dibromide and AgNO3from quercetin.Their structures were characterized by1H-NMR and ESI-MS.Their capability of scavenging the DPPH·and·OH radicals were evaluated.The preliminary assay results showed that the products possessed strong scavenging activity on reducing power on DPPH·and·OH radicals with maximum scavenging rate 88.7%,90.1%and 78.6%,80.6%,effectively scavenged DPPH·and·OH radicals with IC50of 4.2,4.5mg/L and 19.2,22.3mg/L,respectively.
quercetin;antioxidant activity;derivative
TS201.2
A
1002-0306(2012)05-0095-03
2011-05-26 *通讯联系人
韦静(1979-),女,硕士研究生,讲师,研究方向:药物分子与生物大分子相互作用。
广西教育厅科研立项项目(201010LX343);桂林医学院青年教师科研启动基金。
