CO2及温度对显微活细胞培养系统动态观察活细胞Ca2+变化的影响
2012-11-14吴伟全李元歌王思捷王永存
吴伟全,李元歌,王思捷,王永存,吴 平
(1、广东医学院临床医学研究中心,广东 湛江 524001;2、广东医学院附属医院放射科,广东 湛江 524001;3、广东医学院附属医院肿瘤科,广东 湛江524001)
随着生物医学研究的发展,通过激光扫描共聚焦显微镜动态观察活细胞内离子变化,特别是钙离子,是目前研究的热点[1]。而动态观察活细胞内离子变化实验研究中,通过维持最佳CO2及温度条件去维持细胞活性状态尤为关键。但是目前活细胞内离子变化动态观察中,CO2及温度条件改变对活细胞活性状态产生影响尚不完全清楚。本实验通过显微活细胞培养系统改变CO2及温度条件,探讨CO2及温度对动态观察活细胞Ca2+变化的影响,为活细胞动态观察实验研究中维持最佳CO2及温度条件提供理论和实验依据。
1 材料和方法
1.1 材料、主要仪器及试剂 活细胞A549为本实验室保存。激光扫描共聚焦显微镜(德国Leica公司);显微活细胞培养系统(德国IncubatorS-2、CTIController 3700 digital、Tempcontrol 37-2 digital);35 mm NEST激光共聚焦培养皿 (耐思生物科技有限公司);DMEM高糖培养基(Gibco公司);新生小牛血清(民海生物公司);青霉素-链霉素双抗试剂(杭州吉诺公司);0.25%胰酶 (Trypsin)-0.02%EDTA溶液 (杭州吉诺公司);PBS缓冲液(武汉博士德公司);Fluo-4/AM 荧光染色剂(美国Invitrogen公司)。
1.2 活细胞A549的激光共聚焦培养皿培养 人肺上皮细胞株A549细胞接种于35 mm NEST激光共聚焦培养皿,培养于DMEM高糖培养液中,其中含小牛血清10%、青霉素(100 mg/L)和链霉素(100 mg/L),置于37℃、5%CO2培养箱中无菌培养。第二天细胞长满70%~80%皿底可用于活细胞动态观察。
1.3 显微活细胞培养系统的建立 将显微培养器IncubatorS-2安置于激光扫描共聚焦显微镜的镜头上,IncubatorS-2与温度控制装置Tempcontrol 37-2 digital及CO2控制装置CTI-Controller 3700 digital管道联通,CTI-Controller 3700 digital再与CO2钢瓶管道联通,建立显微活细胞培养系统[2]。
1.4 CO2及温度的控制和实验分组 CO2及温度可以通过CTI-Controller 3700 digital和Tempcontrol 37-2 digital正常工作进行控制。细胞分为A组:5%CO2维持37℃温度正常实验组、B组:无CO2但维持37℃温度组和C组:5%CO2室温温度组三个组,每组重复3次。
1.5 活细胞Ca2+变化的动态观察 将各组细胞培养于35 mm激光共聚焦培养皿中间的圆形凹槽里。染色前吸除培养皿的培养液,用PBS洗2~3次;向培养皿中轻轻滴入Fluo-4/AM工作液200μl,使其覆盖凹槽里全部细胞;37℃、5%CO2培养箱中孵育30 min;吸除染液,用PBS洗2~3次;再用800μl的DMEM高糖培养液覆盖凹槽里全部细胞,将激光共聚焦培养皿放在显微培养器IncubatorS-2里,加H2O2后,用激光扫描共聚焦显微镜动态观察Ca2+的变化。
1.6 统计学方法 实验数据采用SPSS 17.0软件进行统计学分析。计量数据用±s表示,采用方差分析(One-Way-ANOVA),多样本均数比较选用LSD法、Dunnett法。P<0.05表示差异有统计学意义。
2 结果
2.1 显微活细胞培养系统能有效控制活细胞的CO2及温度 显微培养器IncubatorS-2、温度控制装置 Tempcontrol 37-2 digital和 CO2控制装置CTI-Controller 3700 digital三者结合激光扫描共聚焦显微镜,建立的显微活细胞培养系统能有效控制CO2及温度,正常情况下可以维持活细胞的5%CO2及37℃温度,以维持活细胞较好的状态(见图1、图 2)。

图1 CO2控制装置CTI-Controller 3700 digital

图2 温度控制装置Tempcontrol 37-2 digital
2.2 CO2及温度对活细胞A549内Ca2+变化的影响细胞内Ca2+变化结果见图3、图4、图5和表1。A549细胞内可见钙离子表达,表现为绿色荧光,其强弱反映细胞内钙离子浓度高低。A组A549细胞呈长梭形,状态较好,加H2O2后荧光强度从2 min到5 min内随着时间的延长逐步增强(P<0.05);B组A549细胞大部分呈长梭形,状态一般,加H2O2后荧光强度从1 min到5 min内随着时间的延长逐步减弱 (P<0.05);C组A549细胞大部分呈长梭形,状态一般,加H2O2后荧光强度从2 min到5 min内随着时间的延长逐步减弱 (P<0.05)。与A组的 比较,B 组 1 min、 2 min、3 min、4 min 和 5 min时间点荧光强度分别减弱(P<0.05);与A组的比较,C 组 2 min、3 min、4 min 和 5 min 时间点荧光强度分别减弱(P<0.05)。
3 讨论
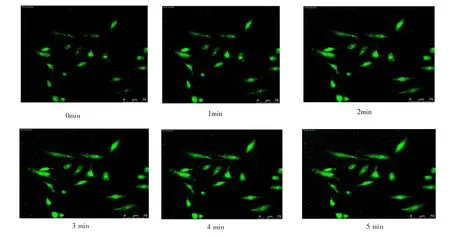
图3 A组A549细胞内Ca2+变化的动态观察

图4 B组A549细胞内Ca2+变化的动态观察
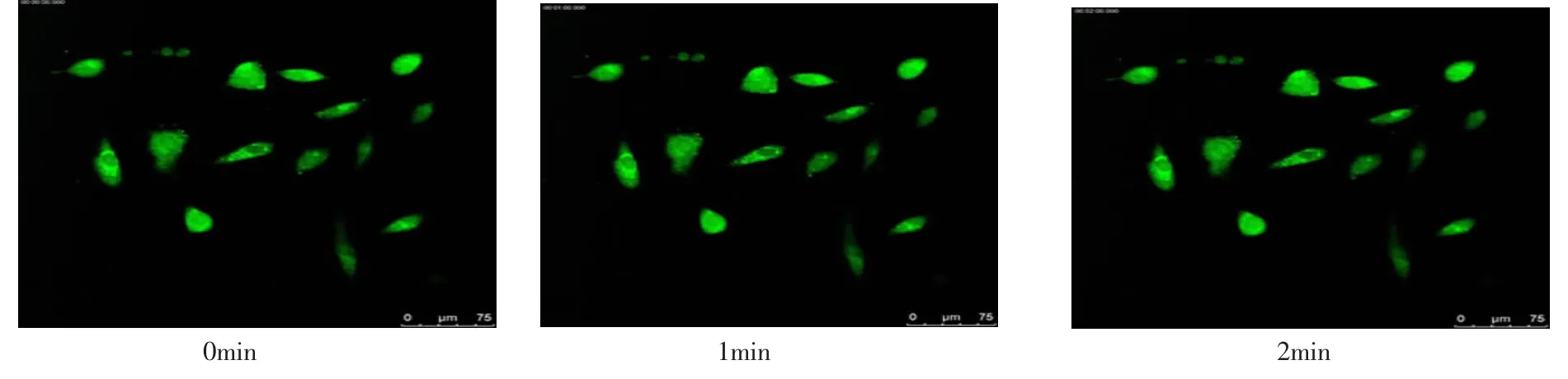

图5 C组A549细胞内Ca2+变化的动态观察

表1 三组A549细胞不同时间点荧光强度比较
激光扫描共聚焦显微镜是80年代发展起来的一项划时代意义的高科技新产品,它是在荧光显微镜成像基础上加装了激光扫描装置,激发荧光探针,从而得到细胞的荧光图象,在亚细胞水平上观察诸如Ca2+、膜电位等生理信号及细胞形态的变化,成为生物医学研究领域中强有力的研究工具[3]。本院临床医学研究中心配置是德国Leica TCSII激光扫描共聚焦显微镜,具有活细胞动态观察成像、多重荧光分离及重组成像和三维重构成像等功能。另外通过显微培养器IncubatorS-2、温度控制装置Tempcontrol 37-2 digital和 CO2控制装置CTI-Controller 3700 digital三者结合激光扫描共聚焦显微镜,建立的显微活细胞培养系统,实验结果表明其能有效控制CO2及温度。
细胞内钙作为第二信使对细胞生长分化起着重要作用,而目前用于监测细胞内游离钙的方法少之又少,激光扫描共聚焦显微镜的诞生为人们提供了一种有效工具[4]。研究表明10μM H2O2对细胞内游离钙的刺激在短时间内是上升的[5]。本实验对照组A组在5%CO2维持37℃温度时,活细胞动态观察结果显示10μM H2O2对A549细胞内游离钙的刺激在短时间内也是上升的,与相关研究一致。
CO2是细胞培养生存必需条件之一。细胞培养时一般把细胞置于95%空气加5%二氧化碳混合气体环境中。CO2既是细胞代谢产物,也是细胞生长繁殖所需成分它在细胞培养中的主要作用在于维持培养基的pH值[6]。温度对细胞培养的有重要意义。维持培养细胞旺盛生长,必须有恒定适宜的温度(维持37℃)。温度上升不超过39℃时,细胞代谢与温度成正比;41℃1 h,细胞器结构发生改变,细胞线粒体损伤,大部分细胞调亡;当温度在43℃以上1h,细胞全部死亡[7]。而低温对细胞也有一定影响,细胞处在4℃~36℃之间,细胞的代谢速度会减慢[8]。因此,本实验作为对照组A组是采用CO2及温度是5%CO2维持37℃,结果显示活细胞A549呈长梭形,状态较好。
本实验中通过温度控制装置Tempcontrol 37-2 digital及CO2控制装置CTI-Controller 3700 digital改变温度及CO2,探讨CO2及温度对动态观察活细胞Ca2+变化的影响。实验结果显示B组在无CO2但维持37℃温度时,活细胞A549大部分呈长梭形,状态一般,加药物后荧光强度从1 min到5 min内随着时间的延长逐步减弱;与对照组比较,其 1 min、 2 min、3 min、4 min和 5 min时间点荧光强度分别减弱。实验结果显示C组在5%CO2室温温度时,活细胞A549大部分呈长梭形,状态一般,加药物后荧光强度从2 min到5 min内随着时间的延长逐步减弱。与对照组比较,其2 min、3 min、4 min和5 min时间点荧光强度分别减弱。实验结果表明CO2及温度改变对动态观察活细胞Ca2+有较大的影响,实验结果B组及C组的活细胞由于CO2或温度的改变,活细胞状态一般,动态观察中可能发生荧光淬灭,因此荧光逐步减弱。而A组活细胞A549呈长梭形,状态较好,因此维持5%CO2及37℃为活细胞动态观察实验中CO2及温度的最佳条件。
[1]Zhou YJ,Song YL,Zhou H,et al.Influx of extracellular calcium participates in rituximab-enhanced ionizing radiation-induced apoptosis in Raji cells[J].Toxicol Lett,2012,209(3):221-6.
[2]Kawaguchi A,Ogawa M,Saito K,et al.Differential expression of Pax6 and Ngn2 between pair-generated cortical neurons [J].J Neurosci Res,2004,78(6):784-95.
[3]Hanrahan O,Harris J,Egan C.Advanced microscopy:laser scanning confocal microscopy[J].Methods Mol Biol.2011,784:169-80.
[4]Ma HL,Xu SS,He RH,et al.Study on Ca2+transmembrane behaviors of magnetic-treated S.aureus with Fura-2/AM fluorescence probe and LCSM[J].Guang Pu Xue Yu Guang Pu Fen Xi,2012,32(2):407-10.
[5]黄文峰,廖贵华.H2O2对原代培养的猪肺动脉内皮细胞钙离子的影响[J].社区医学杂志,2010,8(19):1-3.
[6]Anderson KM,Jajeh J,Guinan P,et al.In vitro effects of dichloroacetate and CO2on hypoxic HeLa cells.Anticancer Res,2009,29(11):4579-88.
[7]杜 娟,狄和双,王根林.奶牛乳腺上皮细胞系的建立及高温对细胞超微结构的影响[J].生物工程学报,2007,23(3):471-476.
[8]池 贝,刘 娜,董大鹏,等.非冻存低温下维持贴壁培养细胞[J].实验与检验医学,2011,29(1):35-36.
