色胺酮对小鼠急性和亚急性毒性实验研究
2012-11-13李捷缪珊王四旺王剑波谢艳华
李捷 缪珊 王四旺 王剑波 谢艳华
第四军医大学天然药物学教研室,陕西西安 710032
色胺酮对小鼠急性和亚急性毒性实验研究
李捷 缪珊 王四旺 王剑波 谢艳华
第四军医大学天然药物学教研室,陕西西安 710032
目的观察色胺酮灌胃后小鼠产生的急性毒性反应,以评价色胺酮原料药的安全性。方法将色胺酮设定3个剂量组,灌胃给药,小鼠未出现死亡,故以高、中、低三个给药剂量进行亚急性毒性研究。连续喂养观察体态行为,30 d后摘眼球取血作血常规检测。结果试验小鼠的行为未出现异常,无小鼠死亡。各组小鼠的体重及其增重、进食量、食物利用率与对照组比较差异均无统计学意义(均P>0.05);各计量组血常规指标与对照组比较,差异无统计学意义(P>0.05)。结论色胺酮具有较好的安全性。
色胺酮;安全性;急性毒性试验;小鼠
色胺酮(TRYP)为吲哚喹啉类生物碱,其化学名称为吲哚[2,1-b]喹唑啉-6,12-二酮(6,12-dihydro-6,12-dioxoindo lo-[2,1-b]-quinazoline),主要存在于马蓝(Strobilanthes cusia)、蓼蓝(Polygonum tinetorium Lour)、菘蓝(Isatis tinctoria L.)等产蓝植物中,现也可通过微生物发酵或人工合成得到[1]。近年来药理研究表明其具有抗菌、抗炎、抗肿瘤、抗疟和杀虫作用,特别是可以通过多种途径对肿瘤细胞增殖具有抑制作用[1-9]。经文献报道和本课题组研究发现,色胺酮对K562白血病细胞有突出的抑制和诱导凋亡的作用[2-3]。为了评价其成药的安全性,为进一步制剂的剂量设计提供参考,笔者对其极性毒性进行了研究,现将结果报道如下:
1 仪器与试药
ABX MICROS 60三分类细胞计数仪(西京医院儿科);COBAS INTEGRA 400 Plus全自动生化分析仪;分析天平(德国赛多利斯)。
色胺酮(TRPY)粉末由西北大学生命科学院提供,经HPLC法检测其含量高于95%,其他试剂均为分析纯,临用前配制成混悬液用以灌胃。
昆明种小鼠,雄性,体重(20±2)g,使用许可证号:SCXK(军)字第2007-007号。
2 方法与结果
2.1 急性毒性实验
取适应性饲养3 d后的小鼠10只,禁食不禁水12h,每组于1 d内按50mg/kg剂量灌胃给药3次,每8小时给药1次。给药后仔细观察小鼠的外观、行为、活动、精神、食欲、皮毛、呼吸和鼻、眼、口及大小便等。结果连续观察3 d,体重略有减轻,但未见死亡,其他未见异常,无法测出半数致死量(LD50)。对小鼠进行大体解剖,发现胃肠道有明显的黄色粉末状物体,推测是未被完全吸收的色胺酮粉末,其他未见明显异常。
2.2 亚急性毒性实验
2.2.1日常行为观察取小鼠40只,随即分为对照组和高、中、低三个剂量组。根据药代动力学研究[10]定其剂量分别为:高剂量组80 mg/kg、中剂量组50 mg/kg、低剂量组25 mg/kg,对照组给同体积生理盐水,连续给药30 d。每日观察动物的精神、活动、毛色状态、记录摄食量及体重变化。见表1、2。结果表明各剂量组体重和进食量与对照组比较差异均无统计学意义(P>0.05)。
2.2.2 血常规检查末次给药后2 h眼球取血,进行血常规和生化指标测定,即红细胞(RBC)、白细胞(WBC)计数、血红蛋白(HGB)、平均血红蛋白(MCH)等。见表3。

3 讨论
白血病是严重危害人类生命健康的造血系统恶性肿瘤。当前,白血病的临床治疗仍采用传统的大剂量联合化疗,但此疗法不良反应大,复发率高,尤其对机体免疫与造血系统有很大损害。从祖国医学宝库中寻找抑制白血病细胞恶性增殖并诱导其凋亡的中药是值得探索的途径之一。经文献报道和本课题组研究发现,从板蓝根中提取的喹啉类生物碱色胺酮对K562白血病细胞有突出的抑制和诱导凋亡的作用[2-3]。本实验通过对其急性和亚急性毒性研究,结果发现在高、中、低三种剂量连续用药30 d后,小鼠体征和各生理指标与正常组比较差异无统计学意义(P>0.05),表明色胺酮安全性良好,在解决其溶解度问题后可进一步制成制剂作为治疗白血病的新药开发。
表1 给药期间小鼠体重变化(±s,g,n=10)

表1 给药期间小鼠体重变化(±s,g,n=10)
时间对照组给药组高剂量组中剂量组低剂量组给药前给药后第5天第10天第15天第20天第25天第30天21.5±1.1 25.0±1.3 26.8±1.5 29.1±2.0 33.1±1.8 37.1±1.3 36.2±2.6 18.9±1.4 21.9±1.5 26.7±1.5 28.7±1.8 29.8±1.9 35.0±1.3 36.4±2.4 18.9±1.4 21.9±1.5 26.7±1.5 28.7±1.8 29.8±1.9 35.0±1.3 36.4±2.4 20.8±1.9 23.2±1.4 25.4±1.5 27.8±2.1 31.6±2.0 37.5±1.9 37.9±1.6
表2 给药后小鼠进食量变化(±s,g,n=10)
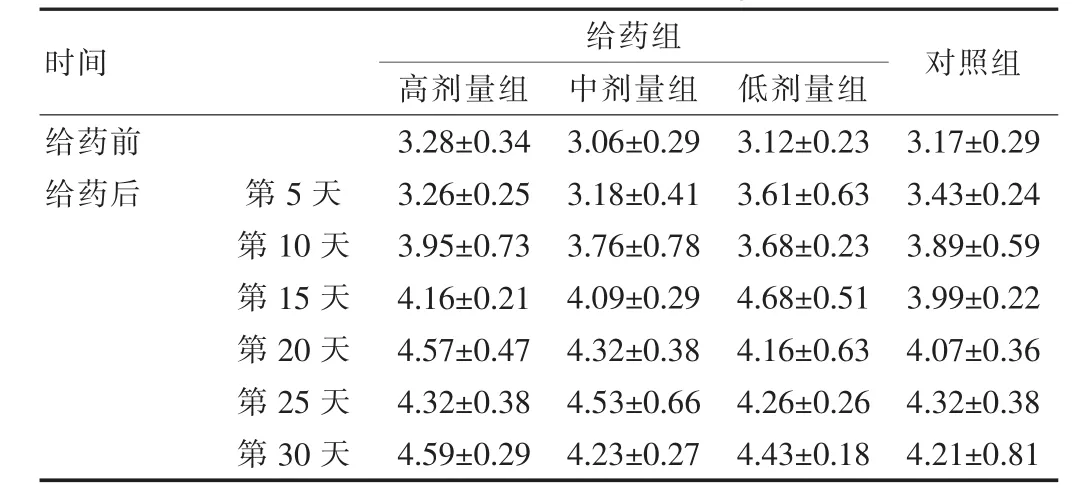
表2 给药后小鼠进食量变化(±s,g,n=10)
时间对照组给药组高剂量组中剂量组低剂量组给药前给药后第5天第10天第15天第20天第25天第30天3.28±0.34 3.26±0.25 3.95±0.73 4.16±0.21 4.57±0.47 4.32±0.38 4.59±0.29 3.06±0.29 3.18±0.41 3.76±0.78 4.09±0.29 4.32±0.38 4.53±0.66 4.23±0.27 3.12±0.23 3.61±0.63 3.68±0.23 4.68±0.51 4.16±0.63 4.26±0.26 4.43±0.18 3.17±0.29 3.43±0.24 3.89±0.59 3.99±0.22 4.07±0.36 4.32±0.38 4.21±0.81
表3 给药后小鼠血常规变化(±s,n=10)

表3 给药后小鼠血常规变化(±s,n=10)
组别RBC(×1012/L)WBC(×109/L)HGB(g/L)MCH(pg)对照组低剂量组中剂量组高剂量组8.86±1.88 9.28±2.03 9.71±2.72 9.72±1.54 8.84±2.19 9.95±2.06 10.51±1.56 10.06±2.80 146.95±7.46 151.20±7.64 148.96±10.34 143.39±10.64 14.87±0.71 14.53±0.88 15.00±0.45 14.78±0.67
表4 给药对小鼠脏器系数影响(±s,‰,n=10)

表4 给药对小鼠脏器系数影响(±s,‰,n=10)
脏器对照组给药组高剂量组中剂量组低剂量组心肝脾肺肾脑5.59±1.61 56.81±8.13 5.03±1.01 5.81±1.07 12.32±2.51 7.98±1.76 5.24±0.99 54.43±7.49 4.59±1.54 5.71±0.83 13.89±2.25 7.69±1.07 5.29±0.75 51.86±6.23 4.25±1.87 6.47±1.07 14.88±2.71 8.11±1.18 5.13±0.73 52.05±9.60 4.51±1.00 6.11±0.94 14.25±1.95 7.34±1.39
[1]缪珊,孙纪元,谢艳华,等.色胺酮的研究进展[J].中国药理学通报,2008,24(2):152-155.
[2]王振义.肿瘤诱导分化及凋亡疗法的现状[N].中国医学论坛报,2001,27(1):72-75.
[3]Kimoto T,Hino K,Koya MS,et al.Cell differentiation and apoptosis of monocytic and promyelocytic leukemia cells(U-937 and HL-60)by tryptanthrin,an active ingredient of Polygonum tinctorium Lour[J].Pathol lnt,2001,51(5):315-325.
[4]Mu BZ.A new cytotoxic active principle isolated from Polygonum tinctorium[J].NatMed,1999,53(2):72-79.
[5]Motoki T,Takami Y,Yagi Y,et al.Inhibition of Hepatocyte Growth Factor Induction in Human Dermal Fibroblasts by Tryptanthrin[J].Biol Pharm Bull,2005,28(2):1-6.
[6]Sharma VM,Prasanna P,Seshu KV,et al.Novel indolo[2,1-b]quinazoline analogues as cytostatic agents:synthesis,biological evaluation and structure-activity relationship[J].Bioorg Med Chem Lett,2002,12(17):2303-2307.
[7]Koya MS,Kimoto T,Micallef MJ,et al.Prevention of azoxy-ethanenduced intestinal tumors by a crude ethyl a cetate-xtract and tryptanthrin extracted from Polygonum tinctorium Lour[J].Anti-ancer Re,2001,21(5):3295-3300.
[8]缪珊,张海,石小鹏,等.色胺酮对乳腺癌MCF-7细胞凋亡的诱导作用[J].现代生物医学进展,2010,10(6):1065-1068.
[9]缪珊,张海,石小鹏,等.色胺酮对人白血病细胞株K562细胞增殖抑制、凋亡诱导的影响[J].中国药理学通报,2009,25(2):256-259.
[10]李捷,缪珊,王四旺,等.HPLC法测定大鼠血浆中色胺酮的浓度及药代动力学参数[J].中国药理学通报2012,28(2):270-274.
Acute and sub-acute toxicity test of TRYP in m ice
LIJie MIAO Shan WANG Siwang WANG Jianbo XIE Yanhua
Department of Nature Medicine,the Fourth Military Medical University,Shaanxi Province,Xi′an 710032,China
ObjectiveTo evaluate the safety of TRYP by observing the acute toxic reaction ofmice after oral administration.MethodsThe mice were oral administrated with TRPY at three different dosages.No death ofmice was found.So three doses of the high,middle and low for subacute toxicity study were given.After feeding for 30 days,the blood hematology was detected.ResultsDreg-treated mice had no behavior anomaly and death in the observation period.The difference of body weight,weight increased,food in-take and utilization ratio in each group was not significant(P>0.05).The hematology in each dose group had no significant difference compared with control group(P>0.05),either.ConclusionTRYP is relatively safe.
TRYP;Safety;Acute toxicity;Mice
R282.71
A
1673-7210(2012)11(b)-0013-02
国家“重大新药创制”科技重大专项(项目编号:2011ZX09401-308)。
李捷(1983-),女,硕士研究生,助教;研究方向:中药药理学。[通讯作者]王四旺(1958-),男,教授,博士生导师;研究方向:中药新药开发。
2012-07-05 本文编辑:卫轲)
