内毒素诱导的葡萄膜炎中虹膜固有组织细胞上MyD88与TLR-4的共表达△
2012-11-13许邦丽
许邦丽 王 婧 齐 欣 杨 硕 卢 弘
急性前葡萄膜炎的发生主要与革兰阴性细菌感染有关,革兰阴性细菌细胞壁的脂多糖(lipopolysaccharide,LPS)是固有免疫反应的主要启动因子。Toll样受体-4(Toll-like receptor-4,TLR-4)是革兰阴性细菌细胞壁LPS的模式识别受体,在机体的固有免疫和适应性免疫中起重要作用。在我们的前期研究中发现内毒素诱导的葡萄膜炎(endotoxin-induced uveitis,EIU)中虹膜固有层组织巨噬细胞参与炎症反应,并发现在炎症过程中TLR-4的高表达[1],提示TLR-4可能在急性前葡萄膜炎的发生、发展中具有一定作用[2],由此我们推测TLR-4与LPS配体结合启动了炎症过程。本研究利用髓样分化因子88(myeloid differentiation factor 88,MyD88)通过LPS刺激 C3H/HeN(野生型)小鼠和C3H/HeJ(TLR-4基因缺陷型)小鼠,检测TLR-4及MyD88在EIU巨噬细胞上的表达,探讨TLR-4、MyD88依赖信号途径在急性前葡萄膜炎发病机制中的作用。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 清洁级健康雄性C3H/HeN小鼠25只,6~8周龄,购于北京维通利华实验动物有限公司。雄性C3H/HeJ小鼠5只,6~8周龄,购于南京大学模式动物研究所。C3H/HeN组分为LPS注射后 0 h、12 h、24 h、48 h、72 h 不同时间点,每个时间点5只。
1.1.2 主要试剂与仪器 霍乱弧菌内毒素 LPS(18001株,古典生物型,小川血清型,兰州生物制品研究所),TLR-4抗体、MyD88抗体、CD163抗体(美国Santa Cruz公司),FITC标记驴抗大鼠二抗、TRITC标记驴抗山羊二抗、Dylight649标记的驴抗兔二抗(美国Jackson公司)。眼前节照相系统(Topcon眼前节照相系统),立体视显微镜、荧光显微镜、激光共聚焦显微镜(德国Leica公司)。
1.2 实验方法
1.2.1 动物模型的制作与临床观察 将霍乱弧菌内毒素LPS溶于无菌生理盐水中,配成浓度为2 g·L-1的注射液,每只小鼠腹腔注射0.1 mL,注射后每隔2 h用裂隙灯观察小鼠眼前节,必要时复方托品酰胺散瞳检查,详细记录临床体征并拍照。
1.2.2 动物灌注及标本制备 进行小鼠心脏灌注,以消除血液对免疫组织化学结果的影响。小鼠腹腔注射 175 g·L-1水合氯醛(2 mL·kg-1)深麻醉,麻醉完全后仰卧固定于软木板上,用体积分数70%酒精消毒,腹部正中切口,至剑突后改为2条旁矢状切口,暴露胸腔,左心室内插管,插管成功后打开PBS阀门,立即在右心房做一1~2 mm切口使血液和灌注液流出,用肝素化的PBS(pH值7.4,每毫升PBS含1 U肝素)100~150 mL灌注,直至流出液体变为无色时,改为40 g·L-1多聚甲醛50 mL进行固定,可见小鼠肢体僵硬,四肢和尾巴肌肉痉挛,肠系膜血管透明、肝脏苍白。摘除眼球放入40 g·L-1多聚甲醛中继续固定1~2 h后,立体视显微镜下,在盛有PBS的培养皿中,将小鼠虹膜、睫状体分离,放入装有PBS的Eppendorf管中,置于-80℃下冻存备用。
1.2.3 虹膜、睫状体铺片免疫荧光三标记 为了观察整个细胞的形态,增加组织样本量,采用虹膜、睫状体铺片的方法,用免疫荧光三标记检测CD163、TLR-4、MyD88的共表达。20 mmol·L-1EDTA 四钠抗原修复,37℃,3 min,将标本放入24孔培养板,PBS洗5 min×3次;3 g·L-1Triton X-100室温30 min;PBS洗5 min×3次;含体积分数3%BSA和体积分数10%驴血清的PBS孵育抗原封闭,室温1 h,PBS洗5 min×3次;1∶50山羊抗小鼠CD163、1∶50大鼠抗小鼠TLR-4、1∶50兔抗小鼠MyD88一抗同时孵育(用 0.2 g·L-1Triton X-100 稀释),每孔 200 μL,4℃过夜;第 2天室温平衡 30 min;PBS洗5 min×3次;在避光条件下,1∶50 TRITC标记驴抗山羊二抗孵育,每孔 200 μL,室温 2 h;PBS洗10 min×3次;1∶50 FITC标记驴抗大鼠二抗孵育,每孔200 μL,室温2 h,PBS洗 10 min ×3 次;1∶100 Dylight649标记的驴抗兔二抗孵育,每孔200 μL,室温2 h,PBS洗10 min×3次;抗荧光衰减封片剂封片。分别以PBS或亲和纯化正常驴IgG代替一抗作为阴性对照,阴性对照抗体浓度与一抗浓度相同,孵育条件相同,荧光显微镜观察并拍照,相同视野的一对影像重叠后用影像处理软件(Adobe Photoshop CS3)进行共表达分析。部分铺片用激光共聚焦显微镜检查。虹膜铺片每象限取位于虹膜中部的一个高倍镜视野进行计数,同一视野不同焦点平面进行叠加后总的阳性细胞数为该视野的细胞数。4个视野的平均值作为该眼球虹膜的阳性细胞数。
1.3 统计学分析 采用SPSS 11.5统计软件,全部数据以均数±标准差(±s)表示。对多个样本虹膜内CD163阳性细胞数、TLR-4阳性细胞数以及MyD88阳性细胞数分别采用单因素方差分析进行检验,P<0.05为差异有统计学意义。
2 结果
2.1 EIU模型临床表现 C3H/HeN小鼠霍乱弧菌内毒素LPS注射后12 h结膜囊内出现白色分泌物,瞳孔区偶见白色渗出,晶状体前表面可见色素性颗粒,24~48 h时前房内炎症达到高峰,散瞳后可见部分虹膜后粘连,72 h炎症逐渐消退(图1A)。C3H/HeJ小鼠霍乱弧菌内毒素LPS注射后在整个观察过程中没有发现炎症反应(图1B)。
2.2 虹膜、睫状体铺片免疫荧光三标记 CD163、TLR-4和MyD88的表达 在内毒素诱导的C3H/HeJ小鼠虹膜中未检测到CD163、TLR-4和 MyD88阳性细胞。而C3H/H3N小鼠注射LPS后,在虹膜和睫状体中可见CD163标记的巨噬细胞表达,阳性细胞呈绿色荧光,定位于细胞膜、细胞浆,大部分细胞为类圆形。TLR-4阳性细胞呈红色荧光,MyD88阳性细胞呈蓝色荧光,IgG阴性对照中未见阳性细胞的表达(图2)。C3H/HeN小鼠腹腔注射LPS后在虹膜铺片内0 h未见TLR-4、MyD88与CD163阳性表达,12 h后可见阳性细胞,24 h阳性细胞数较12 h明显增多,差异均有统计学意义(均为P<0.05);48 h阳性细胞数与24 h相比,差异均无统计学意义(均为P>0.05);72 h阳性细胞数较48 h减少,差异均有显著统计学意义(均为P<0.01,见表1)。

Figure 1 Clinical manifestations of EIU.A:C3H/HeN mice at 24 hours after LPS injection,part of posterior synechia was seen after mydriasis;B:C3H/HeJ mice after LPS injection,no anterior chamber inflammation was seen EIU模型临床表现。A:C3H/HeN小鼠注射LPS后24 h,散瞳后部分虹膜后粘连;B:C3H/HeJ小鼠注射LPS后,前房无炎症表现
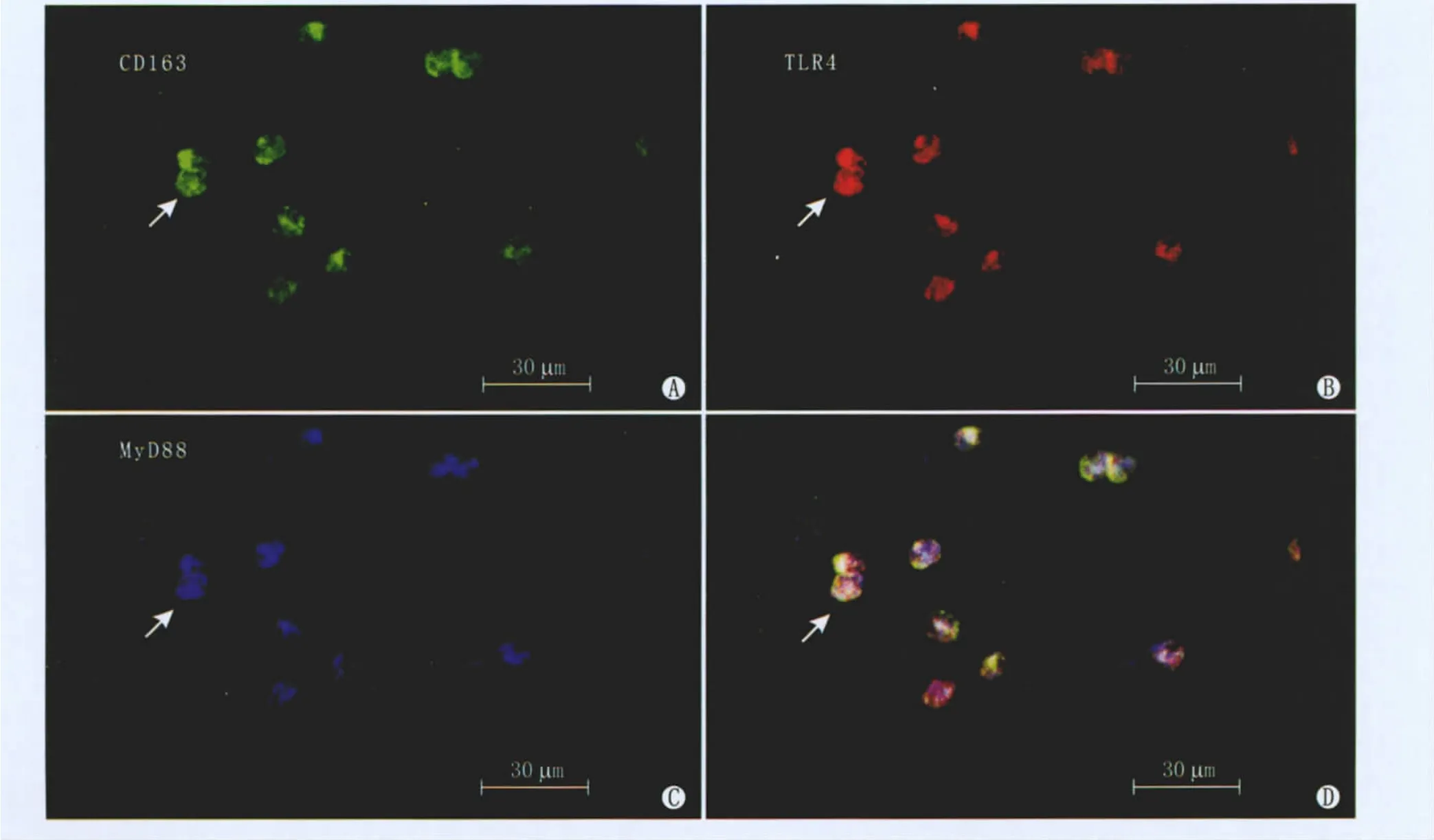
Figure 2 Images of immunofluorescence and laser confocal microscope scanning at 24 hours.A:Immunofluorescence displayed CD163 labeled macrophages;B:Immunofluorescence displayed TLR-4;C:Immunofluorescence displayed MyD88;D:Laser confocal microscope scanning clearly showed the co-expression of TLR-4 and MyD88 on macrophages marked by CD163 24 h虹膜免疫荧光与激光共聚焦显微镜扫描结果。A:免疫荧光显示CD163标记的巨噬细胞;B:免疫荧光显示TLR-4;C:免疫荧光显示MyD88;D:激光共聚焦显微镜扫描显示TLR-4和MyD88在CD163标记的巨噬细胞上共表达

表1 C3H/HeN小鼠注射LPS后不同时间点CD163、TLR-4、MyD88 阳性细胞数Table 1 CD163+,TLR-4+and MyD88+cells in C3H/HeN mice at different time points after LPS injection
3 讨论
葡萄膜炎是常见的致盲眼病,前葡萄膜炎是葡萄膜炎中最常见的一种类型[3],由于其病因、发病机制还不十分明确,因此尚无理想有效的治疗方法。虽然免疫抑制剂和糖皮质激素有一定的疗效,但仍不能阻止葡萄膜炎的复发,最终致使视功能下降或视力丧失。所以,深入研究急性前葡萄膜炎的发病机制,寻找新的免疫疗法是葡萄膜炎研究领域中的重要课题之一。
有文献报道,急性前葡萄膜炎的发生主要与革兰阴性细菌感染有关[4]。卢弘[5]用霍乱弧菌内毒素在Wistar大鼠成功地诱导出临床可见的葡萄膜炎。Chang等[6]在正常人虹膜、睫状体内发现有 TLR-4阳性的树突状细胞。Chen等[1]发现在大鼠EIU中TLR-4表达增高。
组织固有的巨噬细胞是机体内最早吞噬外来抗原并对感染做出反应的细胞之一。CD163是体内血红蛋白的特异清道夫受体,也是组织固有巨噬细胞的表面标记蛋白。近年来CD163被认为是选择性活化的巨噬细胞的标记,表达于巨噬细胞表面的一类模式识别受体,且在免疫抑制中起作用[7],能识别细菌和真菌细胞壁多糖和脂质,介导吞噬作用。它们以化学修饰的蛋白质、多核苷酸、多糖和磷脂等作为配体并可促进其胞吞作用,起着清除体内有毒物质及衰老、凋亡或坏死细胞的作用。CD163作为一种跨膜蛋白存在于活化的巨噬细胞膜表面,当机体出现炎症反应时,巨噬细胞大量活化,高表达CD163,本研究发现虹膜、睫状体均可见类圆形巨噬细胞,血管周围多见,且在CD163高表达的同时TLR-4表达也增高。TLR-4基因敲除的小鼠不能诱导出葡萄膜炎。同样本研究在小鼠EIU模型的虹膜铺片中,用免疫荧光三标记的方法进一步证实了在巨噬细胞上TLR-4和MyD88共表达,MyD88与TLR-4的表达曲线基本一致,TLR-4基因敲除的小鼠 TLR-4和MyD88均无表达,提示在TLR-4的介导下巨噬细胞参与了机体的固有免疫,可能通过MyD88依赖信号途径导致后续炎症的级联扩大。
目前发现TLR信号通路有两条:一条为MyD88依赖信号途径,一条为 MyD88非依赖信号途径。MyD88依赖信号途径是所有TLR(TLR-3除外)共有的,MyD88为TLR信号转导途径中的主要接头蛋白,它的C端含TLR结构域与TLR胞内区结合,N端通过死亡结构域(death domain,DD)募集下游含有DD结构域的信号分子使信号下传,可激活核因子-κB和激活蛋白-1,进而促进核因子-κB控制的基因表达,参与炎症介质(IL-1、IL-2、IL-6、TNF-α 等)、黏附分子以及NO合酶等的转录,促进表达共刺激因子CD40、CD80、CD86,并且通过反馈环路导致炎症过程的放大和持续[8-11]。Li等[12]在大鼠的 EIU模型中发现TLR4、MyD88、核因子-κB表达上调。这说明急性前葡萄膜炎的发病过程中,MyD88在LPS活化通路中发挥着至关重要的作用,TLR-4对其下游信号分子的激活是通过MyD88依赖信号途径转导的。Xu等[13]在小鼠EIU模型中,发现房水中炎症介质(IL-1、IL-2、IL-6、TNF-α 等)升高。由此,TLR-4可能在急性前葡萄膜炎的发生、发展中起着关键作用[14]。
TLR的发现是免疫学的一项重大进展,TLR-4是一类重要模式识别受体,能识别外源性和内源性配体,TLR能有效识别“非己”成分而被活化,然后通过上调与吞噬有关的基因表达,增强巨噬细胞、中性粒细胞的吞噬能力及杀伤能力,不仅在天然免疫中发挥重要作用,还是连接天然免疫与特异性免疫的主要桥梁。本研究发现在C3H/HeN小鼠的EIU模型中,CD163标记的巨噬细胞中TLR-4、MyD88共表达,进一步揭示虹膜固有层巨噬细胞参与了机体的固有免疫,LPS激活了细胞膜表面的TLR-4,并且通过MyD88依赖信号途径向下游转导。目前的研究还只是处于初步阶段,我们期望通过对转导通路上的上游关键分子的阻断为治疗急性前葡萄膜炎提供新的思路。
1 Chen W,Hu X,Zhao L,Li S,Lu H.Expression of toll-like receptor 4 in uvea-resident tissue macrophages during endotoxin-induced uveitis[J].Mol Vis,2009,15(6):619-628.
2 卢 弘,陈 巍,赵 丽.Toll样受体-4在内毒素诱导的葡萄膜炎中的表达及意义[J].眼科,2008,17(1):48-51.
3 Rathinam SR,Namperumalsamy P.Global variation and pattern changes in epidemiology of uveitis[J].Indian J Ophthalmol,2007,55(2):173-183.
4 Wakefield D,Montanaro A,McCluskey P.Acute anterior uveitis and HLA-B27[J].Surv Ophthalmol,1991,36(3):223-232.
5 卢 弘.霍乱弧菌内毒素诱导大鼠葡萄膜炎的组织切片研究[J].眼科新进展,2002,22(6):384-386.
6 Chang JH,McCluskey P,Wakefield D.Expression of toll-like receptor 4 and its associated lipopolysaccharide receptor complex by resident antigen-presenting cells in the human uvea[J].Invest Ophthalmol Vis Sci,2004,45(6):1871-1878.
7 Polfliet MM,Fabriek BO,Daniels WP,Dijkstra CD,van den Berg TK.The rat macrophage scavenger receptor CD163:expression,regulation and role in inflammatory mediator production[J].Immunobiology,2006,211(6-8):419-425.
8 Sandor F,Buc M.Toll-like receptors.I.structure,function and their ligands[J].Folia Biologica(Praha),2005,51(5):148-156.
9 Janssens S,Beyaert R.Role of Toll-like receptors in pathogen recognition[J].Clin Microbiol Rev,2003,16(4):637-646.
10 Gioannini TL,Teghanemt A,Zhang D,Coussens NP,Dockstader W,Ramaswamy S,et al.Isolation of an endotoxin-MD-2 complex that produces Toll-like receptor 4-dependent cell activation at picomolar concentrations[J].Proc Natl Acad Sci USA,2004,101(12):4186-4191.
11 Lu YC,Yeh WC,Ohashi PS.LPS/TLR4 signal transduction pathway[J].Cytokine,2008,42(2):145-151.
12 Li S,Lu H,Hu X,Chen W,Xu Y,Wang J.Expression of TLR4-MyD88 and NF-κB in the iris during endotoxin-induced uveitis[J].Mediators Inflamm,2010,2010:748218.Epub 2010 Aug 3.
13 Xu Y,Chen W,Lu H,Hu X,Li S,Zhao L.The expression of cytokines in the aqueous humor and serum during endotoxin-induced uveitis in C3N/HeN mice[J].Mol Vis,2010,16(12):1689-1695.
14 Chi ZL,Hayasaka S,Zhang XY,Hayasaka Y,Cui HS.Effects of rolipram,a selective inhibitor of type 4 phosphodiesterase,on lipopolysaccharide-induced uveitis in rats[J].Invest Ophthalmol Vis Sci,2004,45(8):2497-2502.
