Colivelin对视神经保护作用的初步研究
2012-11-13黄敏丽
刘 欣 黄敏丽
外伤性视神经病变(traumatic optic neuropathy,TON)是因各种外力伤及头部或眼部后发生的视神经损伤,最终诱发视网膜神经节细胞(retinal ganglion cell,RGC)死亡(主要是通过细胞凋亡的方式),其结果常导致视力永久性丧失[1]。随着交通及体育运动的发展,TON发病率逐渐增多,已成为常见的眼外伤急症。时至今日,临床上对此病尚无有效的治疗方法,虽可行视神经管减压开放术和大剂量糖皮质激素治疗,但也只能挽救部分视力,视功能损害已不可逆转。因此,寻找安全有效的新疗法,已经成为TON发生后视功能保护研究的热点和难点。Colivelin是一种新近合成的生物活性肽,具有神经保护作用,能够促进受损初级皮层神经元的存活[2]。本研究通过建立大鼠视神经夹伤模型来探讨不同剂量Colivelin对视神经的保护作用及其机理,为临床防治视神经损伤性疾病提供新的思路和线索。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 健康清洁级2月龄雌性Wistar大鼠40只(80眼,广西医科大学动物实验中心提供),体质量230~300 g,统一编号后随机分为模型组、安慰剂组及Colivelin低剂量组、Colivelin中剂量组、Colivelin高剂量组,每组8只,均做单侧视神经损伤模型,模型组一侧未做任何处理的8眼为空白对照组。
1.1.2 实验试剂和仪器 无创血管夹(上海医疗器械公司),微量进样器(上海安亭微量进样器厂),病理图像分析系统(德国LEICA公司),Colivelin(上海吉尔生化有限公司),TUNEL试剂盒(德国Roche公司),Caspase-3抗体(美国 NeoMarkers公司),DAB显色试剂盒(福州迈新生物技术开发有限公司)。
1.2 方法
1.2.1 动物损伤模型的建立 100 g·L-1水合氯醛(350 mg·kg-1)腹腔注射麻醉后,在手术显微镜下切开外眦,沿角膜缘向上剪开球结膜至10点钟位,向前牵拉眼球,在眼外肌之间钝性分离,暴露视神经,于球后2 mm处用无创血管夹夹闭视神经20 s。眼底检查视网膜血管无出血及梗塞为造模成功,纳入实验观察。
1.2.2 大鼠用药剂量及方法 将Colivelin溶于磷酸缓冲液(PBS),配制成浓度为 10-6μmol·L-1、10-4μmol·L-1及 10-2μmol·L-1的溶液。根据分组不同自外伤后起30 min,用微量进样器向玻璃体内注射不同浓度的药物5 μL:Colivelin低剂量组注射10-6μmol·L-1Colivelin,Colivelin 中剂量组注射10-4μmol·L-1Colivelin,Colivelin 高剂量组注射10-2μmol·L-1Colivelin,安慰剂组注射 PBS 缓冲液,空白对照组及模型组不给予任何治疗。
1.2.3 标本取材及切片制作 各组动物于注药7 d后,用颈椎脱臼法处死,立即摘除眼球,40 g·L-1多聚甲醛固定,1 d后于锯齿缘后0.5 mm处剪开眼球壁,去除眼前节及眼内容物,石蜡包埋,将眼球沿纵向做5 μm视网膜连续切片。每只眼球取3张切片,每张切片取3个视野(400倍)。
1.2.4 观察项目和方法 视网膜后极部前后方向全层切片HE染色后,观察各组视网膜形态学变化并进行RGC计数,RGC计数为视网膜切片3个400倍光镜视野下RGC计数的平均值。TUNEL染色后观察凋亡细胞所在细胞层次,RGC平均凋亡率为3个400倍光镜视野下RGC凋亡细胞数与RGC总数之比。免疫组织化学法观察3个400倍光镜视野下视网膜中caspase-3的平均光密度值。
1.3 统计学分析 应用SPSS 13.0统计软件进行统计分析,计数资料以均数±标准差表示,运用单因素方差分析对数据进行统计学处理,并用LSD检验进行两两比较,以P<0.05为差异有统计学意义。
2 结果
2.1 视网膜HE染色
2.1.1 病理组织形态学观察 空白对照组大鼠视网膜层次清晰,各层细胞排列整齐密集,细胞核清楚;模型组及安慰剂组可见视网膜各层结构明显变薄,RGC排列稀疏,细胞数目明显减少,出现大量核固缩;Colivelin低剂量组部分RGC出现核固缩,与模型组和安慰剂组相比,RGC数目有所增加;Colivelin高剂量组仅见少量RGC核固缩,RGC数目明显增加,各层细胞排列整齐、致密;Colivelin中剂量组病理改变程度居低剂量组与高剂量组之间(图1)。
2.1.2 RGC计数 注药后7 d,空白对照组每400倍光镜视野下RGC数量为25.750±1.264;模型组及安慰剂组 RGC数量下降明显,分别为8.236±1.239和8.514±1.222;Colivelin治疗后 RGC 数量较模型组、安慰剂组增加,其中,Colivelin低剂量组RGC 数量为 14.500 ±1.021,Colivelin中剂量组为16.250±1.319,Colivelin高剂量组为 18.097±1.323。经统计学处理,除模型组与安慰剂组之间差异无统计学意义(P>0.05)外,其他各组之间差异均有统计学意义(均为P<0.05),且RGC计数随Colivelin药物浓度增加而增加。
2.2 TUNEL染色及计数结果 TUNEL染色结果见图2。模型组和安慰剂组注药后7 d TUNEL染色可见大量凋亡细胞,Colivelin治疗组凋亡细胞数量随Colivelin注射浓度的增加依次递减。模型组RGC细胞凋亡率为(60.928±2.961)%,安慰剂组为(61.446±2.755)%,Colivelin低剂量组为(58.432± 2.835)%,中剂量组为(51.948±2.802)%,高剂量组为(47.656±2.331)%。空白对照组视网膜切片TUNEL染色未见明显凋亡细胞。经统计学处理,模型组与安慰剂组之间差异无统计学意义(P>0.05),其他各组间差异均有统计学意义(均为P<0.05)。
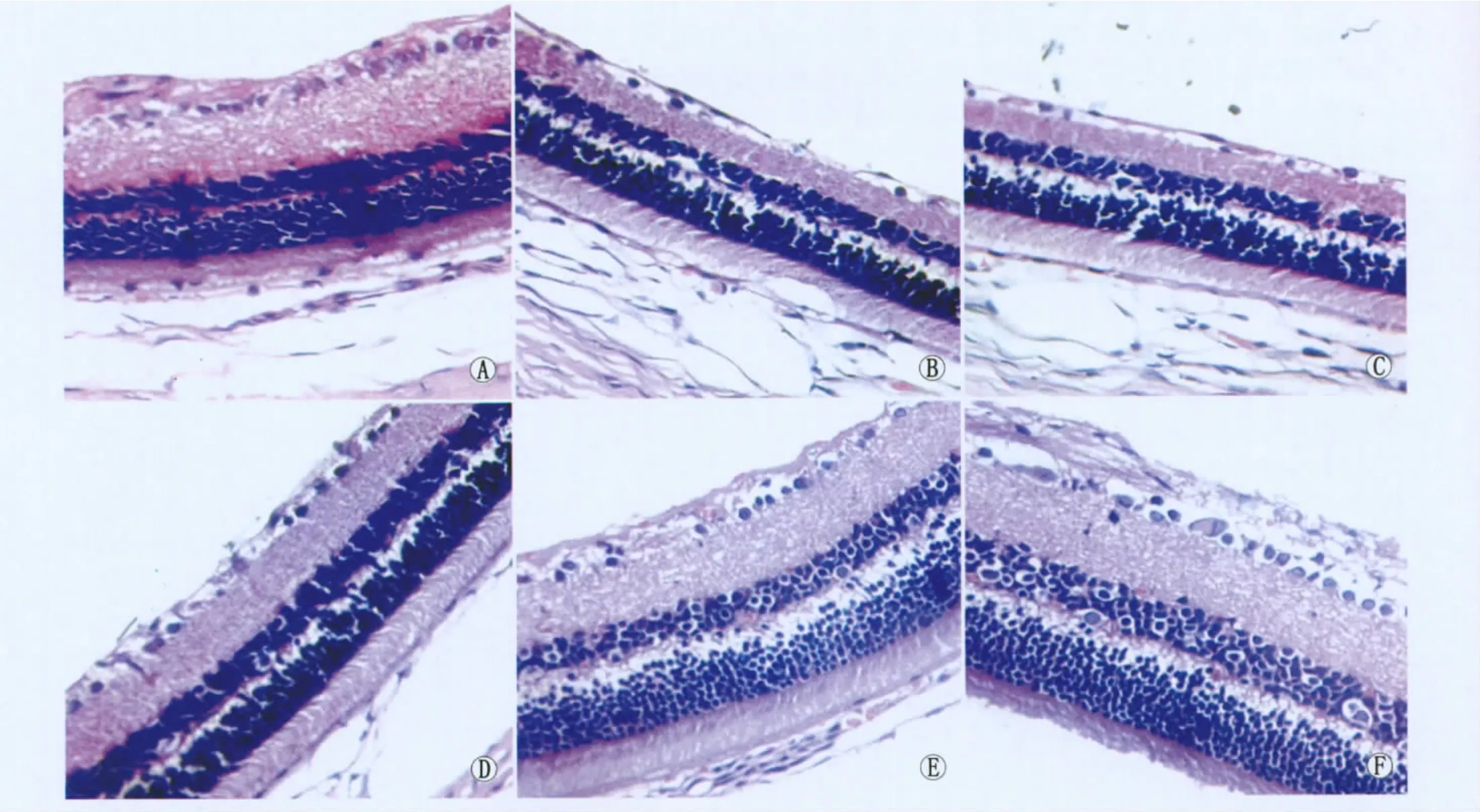
Figure 1 Retinal HE staining(×400).A:Normal control group;B:Model group;C:PBS control group;D:Low-dose colivelin group;E:Medium-dose colivelin group;F:High-dose colivelin group 视网膜HE染色结果(×400)。A:空白对照组;B:模型组;C:安慰剂组;D:Colivelin低剂量组;E:Colivelin中剂量组;F:Colivelin高剂量组
2.3 Caspase-3标记及计数结果 Caspase-3免疫组织化学的阳性表达为细胞核及细胞浆呈棕黄色。结果显示,空白对照组视网膜观察不到阳性染色,模型组、安慰剂组、Colivelin低剂量组、Colivelin中剂量组、Colivelin高剂量组均可观察到阳性染色,主要位于RGC层、内核层及外核层(图3)。空白对照组caspase-3平均光密度值极低,为0.177±0.133;模型组及安慰剂组的表达明显增强,分别为0.482±0.012和0.486±0.012,但此两组间差异无统计学意义(P>0.05);Colivelin低剂量组、Colivelin中剂量组、Colivelin高剂量组caspase-3平均光密度值分别为0.411±0.017、0.326 ±0.018、0.234 ±0.016,均低于模型组及安慰剂组,但均高于空白对照组,不同药物剂量组间差异亦均有统计学意义(均为P<0.05)。
3 讨论
视神经损伤后,引起视功能下降的病理基础是RGC 的继发性损伤[3-4]。研究证实[5],RGC 数目在视神经轴断后明显下降。因此,保护RGC、促进RGC存活是TON发生后要解决的关键问题。本实验也表明,视神经夹挫伤后大鼠RGC大量丢失。
视神经损伤后,RGC死亡是多途径、多因素的。近年来越来越多的研究表明凋亡在TON发生后RGC的死亡机制中占重要地位,是各种视神经病变导致视力不可逆转的共同通路[6]。Quigley等[7]首次在灵长类动物的实验中证明了视神经损伤后RGC的凋亡。RGC发生凋亡主要是一种视神经损伤后期(5~14 d)的继发性改变,可能与轴索机械损伤后导致膜完整性破坏,轴浆运输中断所致营养因子缺乏以及缺血后神经失去营养支持而触发凋亡启动程序有关。Bien等[8]通过实验证明,视神经损伤后7 d左右RGC凋亡达高峰,抑制外伤性视神经损伤后早期凋亡程序的启动,减少RGC的凋亡有助于急性视神经病变的早期治疗。

Figure 2 Retinal TUNEL staining(×400).A:Normal control group;B:Model group;C:PBS control group;D:Low-dose colivelin group;E:Mediumdose colivelin group;F:High-dose colivelin group 视网膜TUNEL染色结果。A:空白对照组;B:模型组;C:安慰剂组;D:Colivelin低剂量组;E:Colivelin中剂量组;F:Colivelin高剂量组(×400)

Figure 3 Immunohistochemical staining of caspase-3 in retina(×400).A:Normal control group;B:Model group;C:PBS control group;D:Low-dose colivelin group;E:Medium-dose colivelin group;F:High-dose colivelin group 视网膜caspase-3免疫组织化学染色结果。A:空白对照组;B:模型组;C:安慰剂组;D:Colivelin低剂量组;E:Colivelin中剂量组;F:Colivelin高剂量组(×400)
在诸多参与细胞凋亡发生的因素中,caspase家族介导的蛋白酶级联反应过程起着非常重要的作用,目前认为凋亡可能就是caspase蛋白酶级联反应切割底物的过程。尽管对于不同信号转导途径诱发的凋亡过程中,参与的caspase有所不同,但caspase-3作为细胞凋亡蛋白酶级联反应中的公共下游效应分子而备受关注,它是家族中最重要的凋亡执行者,负责对全部或部分关键性蛋白的剪切,因此caspase-3是细胞进入程序性死亡的特异性标志[9]。本实验通过建立外伤性视神经损伤动物模型初步证明,Colivelin发挥抗凋亡作用是通过减少caspase-3表达来完成的。
目前国内外对视神经损伤的治疗尚无统一标准,主要治疗方法包括视神经管减压术及糖皮质激素治疗以解除对视神经的压迫、消除视神经水肿。但国际视神经外伤研究小组认为[10],激素治疗和视神经管减压术均不是治疗TON的金标准。Mariak等[11]通过对患者3~11 a的临床随访观察也证实,通过上述方法的治疗均不能有效阻止视神经萎缩的发生。故而,寻找一种有效的、安全的新疗法具有重要意义。近年来越来越多的文献报道视神经损伤后,RGC数量因凋亡而发生明显减少,同时视神经的再生修复也受到阻碍。因此,在视神经损伤的治疗中,减少RGC的凋亡及在此基础上促进其轴突的再生成为目前研究的热点[12]。Colivelin是一种新近合成的杂交肽,他是由ADNF-9和一种humanin衍生物组合而成。研究发现,该药在治疗神经损伤方面有较好的效果。目前国内外关于Colivelin的研究大多局限于中枢神经系统疾病。Chiba等[2]研究发现Colivelin在 100 fmol·L-1浓度下完全抑制了由 25 μmol·L-1Aβ1-43、V642I-APP 和 M146L-PS1 过表达所诱导的神经细胞死亡,并在超过1 nmol·L-1的浓度水平仍然保持了它的神经保护活性。Sari等[13]通过给予怀孕7 d母鼠以酒精流质饮食的方法制作胎儿酒精暴露模型,证实腹腔注射Colivelin后可抑制脑细胞凋亡并促进神经元的存活,具有明显的神经保护作用。但Colivelin在眼科保护RGC方面的研究尚未见报道,其在体内是否对RGC具有保护作用,且保护作用是否呈剂量依赖性是值得深入探讨的问题。
鉴于此,本实验选择不同剂量的Colivelin作用于外伤性视神经损伤动物模型,采用HE染色法观察RGC形态、计数RGC数,TUNEL染色法检测RGC凋亡情况及免疫组织化学法测定caspase-3的表达,以此来研究Colivelin对夹挫伤后RGC存活的影响,并初步探讨产生这一作用的机制。本实验HE染色结果显示模型组及安慰剂组较空白对照组视网膜各层结构变薄,RGC核固缩,排列稀疏,RGC数目明显减少。玻璃体内注射不同剂量的Colivelin后,RGC数目随剂量增加而增多。TUNEL染色结果显示空白对照组未见凋亡细胞,大鼠夹挫伤后7 d凋亡细胞明显增多,而Colivelin注射后凋亡细胞仅有少量增多,并且这种抑制作用具有明显的剂量依赖性。另外,从caspase-3免疫组织化学结果中可见,视神经夹挫伤后大鼠RGC的caspase-3表达增加,Colivelin能够通过抑制caspase-3的表达而促进RGC存活,而且这种抑制作用同样具有剂量依赖性。
综上所述,视神经夹挫伤后,大鼠玻璃体内注射Colivelin,能有效抑制RGC的凋亡,减少RGC的丢失,降低caspase-3的表达,提示该药的视神经保护作用可能与抑制caspase-3的表达有关。这为临床治疗TON提供了新的思路。视神经的损伤与修复是一个多环节、多因素的过程,而Colivelin对视神经夹挫伤治疗的机理及临床应用价值需要更广泛的实验来确立。
1 Swanson KI,Schlieve CR,Lieven CJ,Levin LA.Neuroprotective effect of sulfhydryl reduction in a rat optic never crush model[J].Invest Ophthalmol Vis Sci,2005,46(10):3737-3741.
2 Chiba T,Yamada M,Hashimoto Y,Sato M,Sasabe J,Kita Y,et al.Development of a femtomolar-acting humanin derivative named colivelin by attaching activity-dependent neurotrophic factor to its N-terminus:characterization of colivelin-mediated neuroprotection against Alzheimer’s disease-relevant insults in vitro and in vivo[J].J Neurosci,2005,25(44):10252-10261.
3 Steinapir KD,Goldberg RA.Traumatic optic neuropathy[J].Surv Ophthalmol,1994,38(6):487-518.
4 Slater BJ,Mehrabian Z,Guo Y,Hunter A,bernstein SL.Rodent anterior ischemic optic neuropathy(rAION)induces regional retinal ganglion cell apoptosis with a unique temporal pattern[J].Invest Ophthalmol Vis Sci,2008,49(8):3671-3676.
5 Levkovitch-Verbin H,Quigley HA,Martin KR,Zack DJ,Pease ME,Valenta DF.A model to study differences between primary and secondary degeneration of retinal ganglion cells in rats by partial optic nerve transection[J].Invest Ophthalmol Vis Sci,2003,44(8):3388-3393.
6 Agudo M,Perez-Marin MC,Lonngren U,Sobrado P,Conesa A,Canovas I,et al.Time course profiling of the retinal transcriptome after optic nerve transection and optic nerve crush[J].Mol Vis,2008,14:1050-1063.
7 Quigley HA,Nickells RW,Kerrigan LA,Pease ME,Thibault DJ,Zack DJ.Retinal ganglion cell death in experimental glaucoma and after axotomy occurs by apoptosis[J].Invest Ophthalmol Vis Sci,1995,36(5):774-786.
8 Bien A,Seidenbecher CI,Bockers TM,Sabel BA,Kreutz MR.Apoptotic versus necrotic characteristics of retinal ganglion cell death after partial optic never injury[J].J Neurotrauma,1999,16(2):153-163.
9 Sekiguchi M,Kobayashi H,Sekiguchi Y,Konno S,Kikuchi S.Sympathectomy reduces mechanical allodynia,tumor necrosis factor-alpha expression,and dorsal root ganglion apoptosis following nerve root crush injury[J].Spinec Phila Pa 1976,2008,33(11):1163-1169.
10 Singer CF,Kronsteiner N,Marton E,Walter I,Kubista M,Czerwenka K,et al.Interleukin-1 system and sex steroid receptor gene expression in human endometrial cancer[J].Gynecol Oncol,2002,85(3):423-430.
11 Mariak Z,Mariak Z,Obuchowska I,Stankiewicz A,Proniewska-Skreket E,Zalewska R.Remote results of conservative treatment of traumatic optic neuropathy[J].Neurol Neurochir Pol,1998,32(5):1165-1172.
12 秦怀宇,田 琳.视神经损伤后视网膜节细胞的凋亡及视神经的再生与修复[J].临床和实验医学杂志,2007,6(4):157-159.
13 Sari Y,Chiba T,Yamada M,Rebec GV,Aiso S.A novel peptide,colivelin,prevents alocohol-induced apoptosis in fetal brain of C57BL/6 mice:signaling pathway investigations[J].Neuroscience,2009,164(4):1653-1664.
