整合素β1介导的ERK/MAPK通道在人晶状体上皮细胞转分化中的作用△
2012-11-13朱玉广张立华钟莹莹杜孝楠
朱 艳 朱玉广 张立华 钟莹莹 杜孝楠 张 荣 王 杰
晶状体上皮细胞(lens epithelial cells,LEC)的转分化是后囊膜混浊(posterior capsular opacification,PCO)的主要病理改变[1]。转化生长因子-β2(transforming growth factor β2,TGF-β2)是促进 LEC 转分化最主要的因子[2-3]。TGF-β可以调节多种细胞整合素β1的表达[4],但TGF-β对人晶状体上皮细胞(human lens epithelial cells,HLEC)整合素 β1 表达的作用鲜见报道。MAPK信号转导通路是整合素β1介导的信号转导通路之一,整合素介导的细胞与细胞外基质蛋白的黏附能够激活ERK信号通路。最近研究发现,整合素介导的信号通道参与了TGF-β2介导的LEC移行[5]。因此,我们推测,整合素介导的ERK/MAPK信号通道可能参与了LEC转分化过程。为了验证推测,我们设计此课题,以探讨PCO的发病机制。
1 材料与方法
1.1 主要试剂 DMEM培养基(Hyclone公司)、胎牛血清(Gibco公司)、TGF-β2(Perprotech 公司)、兔抗人整合素β1抗体、兔抗人磷酸化ERK(pERK)抗体、兔抗人F-actin抗体(Santa Cruz公司)、二步法免疫细胞化学检测试剂盒(北京中杉金桥)、PCR扩增试剂盒(Casarray公司)、PCR引物(上海生工)。
1.2 HLEC的培养与传代 人晶状体取自本院角膜移植术后供体眼球(死亡时间<24 h,年龄<40岁)。供体眼球用体积分数70%酒精消毒,庆大霉素溶液冲洗。无菌条件下剖开眼球,除去角膜和虹膜,沿赤道部剖开晶状体,将前囊膜剪成1 mm×1 mm组织块,种植在培养皿中,滴入2滴DMEM培养液,将培养皿放入温箱贴壁0.5~1.0 h。取出培养皿,加入含体积分数15%胎牛血清的DMEM培养液,放入CO2培养箱培养,以后每3~4 d换1次培养液。1~2周近融合,待细胞90%融合时,胰蛋白酶消化,1∶3传代,选择传5代的细胞进行实验。
1.3 MTT法检测TGF-β2对HLEC增殖的影响将HLEC以每孔10×103个接种于96孔培养板中,每孔100 μL,孵育24 h后加入 TGF-β2使之终质量浓度分别为 0 ng·L-1和 10 ng·L-1、33 ng·L-1、100 ng·L-1、333 ng·L-1、1000 ng·L-1,每组 6 孔,继续培养12 h、24 h、48 h、72 h,之后加入 MTT 溶液(每孔20 μL),孵育4 h,小心吸去培养液,加入 DMSO 每孔 150 μL,振荡 10 min,结晶充分溶解后,在Powerwave XS全波长酶标仪(美国Bio-Tek公司)上测量其在490 nm处的吸光度A值,计算细胞存活率。根据MTT法结果选择最佳TGF-β2干涉浓度、刺激时间进行后续实验。
1.4 免疫细胞化学法检测 HLEC中整合素 β1、pERK、F-actin的表达 制作细胞爬片,待HLEC达80%融合后,血清饥饿培养24 h进行实验。实验分为对照组和实验组。对照组加入无血清培养基,实验组加入终浓度为100 ng·L-1TGF-β2的培养基,培养48 h后进行免疫细胞化学染色,检测整合素β1、pERK、F-actin的表达。
光镜下细胞浆含棕黄色颗粒者为阳性细胞。每组各取5张爬片,每张爬片随机选取5个完整而不重叠的高倍镜视野(×400),使用Imagepro plus显微图像分析系统,得出阳性细胞表达的吸光度A值,进行分析。
1.5 RT-PCR 检测 HLEC 中整合素 β1、pERK、F-actin mRNA的表达 收集对照组和实验组HLEC,Trizol法提取细胞的总RNA,按PCR扩增试剂盒说明步骤,反转录为cDNA后进行PCR反应,引物序列:整合素β1 415 bp,上游引物5’-TCAAGCGGGCTGAAGACTATCC-3’,下游引物 5’-AGCCGTGTCACATTCCACCAAC-3’;pERK 31 bp,上游引物 5’-TGCTGCTCTGCCTTTGTCTGC-3’,下游引物5’-CCCACCTCCACTTCTGTTCACC-3’;F-actin 433 bp,上游引物5’-AGGTGCAGGAGAAGTCCAGTG’,下游引物 5’-GAGGGAGCAGGAAACGAGTGT-3’。扩增产物行琼脂糖凝胶电泳,Eagle EyeⅡ型图像系统分析,得出代表各电泳条带产量的灰度值,以β-actin作为内参,计算整合素β1、pERK及F-actin mRNA的相对表达量。
1.6 统计学分析 所有实验数据以均数±标准差表示,采用SPSS 13.0统计软件进行分析,各样本经W检验呈正态分布,组间差异比较采用两独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 MTT法检测TGF-β2对HLEC增殖的影响选取10~1 000 ng·L-1中5 个浓度的 TGF-β2 分别作用于 HLEC,作用时间为 12 h、24 h、48 h、72 h。结果表明,当作用浓度为100 ng·L-1时达到了最强的抑制作用。取最佳TGF-β2干涉浓度100 ng·L-1分别作用于 HLEC 12 h、24 h、48 h、72 h,结果表明,培养48 h达到了最强的抑制作用(图1)。
2.2 免疫细胞化学法检测整合素β1、pERK、F-actin的表达 对照组HLEC表达整合素β1、pERK及F-actin,吸光度 A 值分别为 0.045 ±0.011、0.025 ±0.009、0.079 ±0.024;实验组 HLEC 中整合素 β1、pERK及F-actin表达的相对表达量分别为0.116±0.031、0.123 ±0.028、0.140 ±0.033,与对照组相比差异均有统计学意义(均为 P<0.01)。TGF-β2明显促进整合素β1、pERK及F-actin的表达(图2)。
2.3 RT-PCR 检测整合素 β1、pERK、F-actin mRNA的表达 整合素β1、pERK及F-actin mRNA和管家基因β-actin mRNA经RT-PCR后,分别产生1条415 bp、312 bp、433 bp及578 bp的电泳条带。图像分析系统分析显示,对照组整合素β1、pERK及F-actin mRNA的相对表达量分别为0.246±0.051、0.338 ± 0.092、0.138 ± 0.027,实 验组分 别为0.658 ±0.146、0.582 ±0.171、0.760 ±0.193,与对照组相比差异均有统计学意义(均为P<0.01)。TGF-β2明显促进整合素β1、pERK及F-actin mRNA的表达(图3)。
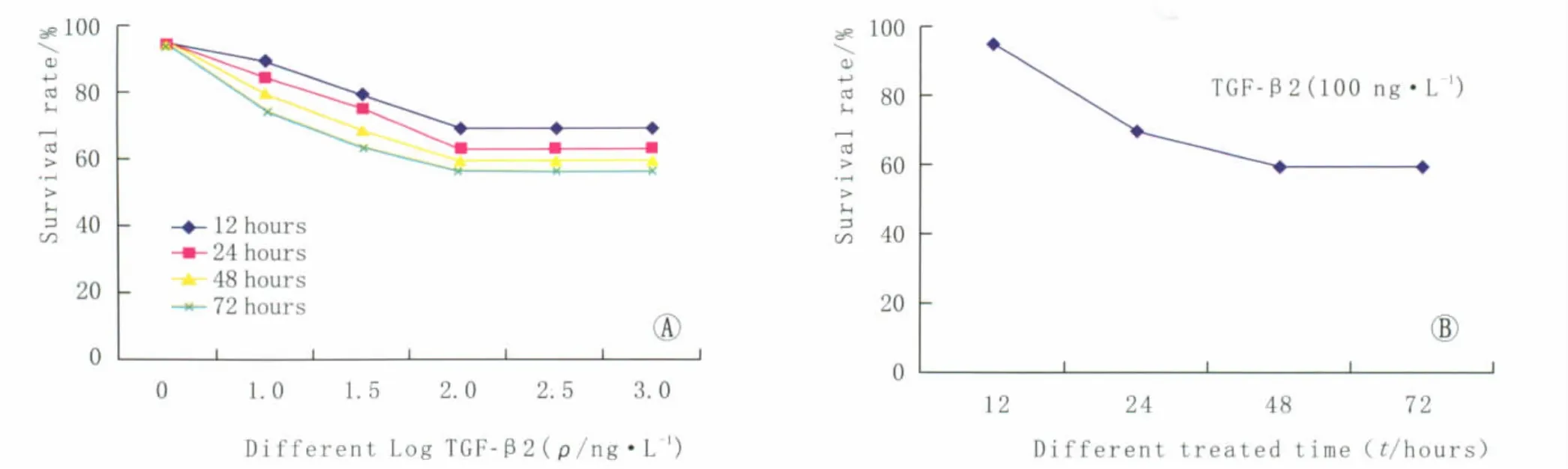
Figure 1 Effect of TGF-β2 on proliferation of HLEC.A:Different concentrations of TGF-β2;B:Different treated time of TGF-β2 TGF-β2 对 HLEC增殖的影响。A:TGF-β2的作用浓度;B:TGF-β2的作用时间

Figure 2 Immunohistochemistry staining image of HLEC in experimental group(SP,×400).A:Integrin β1;B:pERK;C:F-actin 实验组 HLEC 免疫细胞化学染色图像(SP,×400)。A:整合素β1;B:pERK;C:F-actin
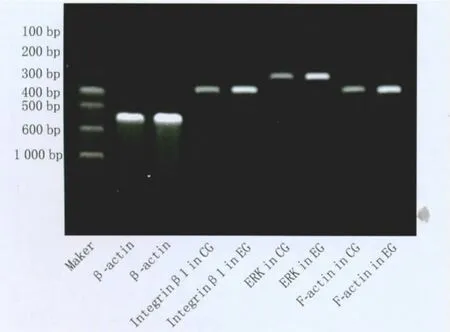
Figure 3 Electrophoresis results of RT-PCR.CG:Control group;EG:Experimental group RT-PCR电泳结果。CG:对照组;EG:实验组
3 讨论
PCO是白内障摘出术后后囊膜的继发混浊,是影响术后远期视力的最主要原因。目前认为,术后残留的HLEC增殖、移行及转分化是引起PCO的主要原因[3]。
TGF-β2是重要的调节因子,与囊膜下型白内障以及PCO的形成有密切关系。研究发现,TGF-β2能够诱导LEC发生异常的生长、分化[6]并发生凋亡,导致体外培养的大鼠晶状体发生前囊膜下混浊[7-8]。1994年Liu等[9]首次发现 TGF-β 可以诱导鼠 LEC发生转分化之后,转分化在PCO形成中的作用日益受到人们的关注。
整合素属于黏附分子超家族成员,主要涉及细胞与细胞外基质的结合,参与细胞黏附、移行和再循环[10]。Nishi等[11]用免疫组织化学的方法证明整合素β1在LEC中存在,认为整合素直接或间接参与了LEC对后囊膜的黏附,提示整合素分子在PCO的形成上具有一定作用。
目前对于整合素β1介导的LEC转分化的上游信号通路的研究逐渐增多。MAPK信号途径是整合素β1介导的信号通路之一,MAPK包括ERK、JNK、P38通路。ERK途径与转分化有关,是MAPK的经典途径。MAPK的活化调控许多生物效应,包括细胞增殖及整合素介导的细胞黏附、转分化等[12]。最近发现,整合素介导的信号通道参与了TGF-β2介导的LEC的移行[5]。但整合素β1介导的MAPK通道在LEC转分化中的作用未见报道。
本实验中,在TGF-β2的诱导下,我们用免疫细胞化学染色法检测到HLEC表达整合素β1和pERK明显增多,RT-PCR扩增产物电泳结果显示HLEC中整合素β1 mRNA和pERK mRNA表达也明显增多。提示在TGF-β2的诱导下整合素β1的表达增多,并激活了整合素 β1介导的下游信号转导通路——ERK/MAPK信号通路。同时,作为细胞骨架蛋白主要成分之一的F-actin及其mRNA的表达明显上升,提示整合素β1介导的ERK/MAPK信号通路可能参与了HLEC转分化的发生,促进了PCO的形成。
本研究发现,TGF-β2诱导 HLEC整合素 β1、pERK和F-actin的表达明显升高。我们推测可能的机制为:TGF-β2一方面抑制了HLEC的增殖,另一方面诱导了整合素β1的表达;整合素β1一方面介导细胞内骨架蛋白(F-actin)与细胞外基质连接,促使细胞运动、移行使后囊发生皱缩,参与PCO的形成,另一方面介导ERK/MAPK信号通道的表达,作用于细胞骨架蛋白,从而使F-actin表达增加,引起HLEC发生黏附、移行,参与PCO的发生。但ERK/MAPK信号通道并没有引起HLEC的增殖,推测可能有其他信号通路参与。但是,作为PCO发生的重要信号通路,整合素β1介导的ERK/MAPK通道可能为PCO的防治提供了一个新的治疗靶点。
1 Suetsugu-Maki R,Maki N,Fox TP,Nakamura K,Cowper-Solari R.A complement receptor C5a antagonist regulates epithelial to mesenchymal transition and crystallin expression after lens cataract surgery in mice[J].Mol Vis,2011,17:949-964.
2 de Iongh RU,Wederell E,Lovicu FJ,McAvoy JW.Transforming growth factor-beta-induced epithelial-mesenchymal transition in the lens:a model for cataract formation[J].Cells Tissues Organs,2005,179(1-2):43-55.
3 Yao K,Ye PP,Tan J,Tang XJ,Shen Tu XC.Involvement of PI3K/Akt pathway in TGF-beta2-mediated epithelial mesenchymal transition in human lens epithelial cells[J].Ophthalmic Res,2008,40(2):69-76.
4 Margadant C,Sonnenberg A.Integrin-TGF-beta crosstalk in fibrosis,cancer and wound healing[J].EMBO Rep,2010,11(2):97-105.
5 Yao K,Tan J,Ye P,Wang K,Xu W,Shen Tu X,et al.Integrin beta 1-mediated signaling is involved in transforming growth factor-beta 2-promoted migration in human lens epithelial cells[J].Mol Vis,2007,13:1769-1776.
6 Hales AM,Chamberlain CG,MCAvoy JW.Cataract induction in lenses cultured with transforming growth factor-β[J].Invest Ophthalmol Vis Sci,1995,36(8):1709-1713.
7 Srinivasan Y,Lovicu FJ,Overbeek PA.Lens-specific expression of transforming growth factor βl in transgenic mice causes anterior subcapsular cataracts[J].J Clin Invest,1998,101(3):625-634.
8 Gordon-Thomson C,de Iongh RU,Hales AM,Chamberlain CG,McAvoy JW.Differential cataract genic potency of TGF-beta l,beta 2,and beta 3 and their expression in the postnatal rat eye[J].Invest Ophthalmol Vis Sci,1998,39(8):1399-1409.
9 Liu J,Hales AM,Chamberlain M,McAvoy JW.Induction of cataract-like changes in rat lens epithelial explants by transforming growth factor-beta[J].Invest Ophthalmol Vis Sci,1994,35(2):388-401.
10 Baker EL,Zaman MH.The biomechanical integrin[J].J Biomech,2010,43(1):38-44.
11 Nishi O,Nishi K,Mano C,Ichihara M,Honda T,Saitoh I.Inhibition of migrating lens epithelial cells by blocking the adhesion molecule integrin:a preliminary report[J].J Cataract Refract Surg,1997,23(6):860-865.
12 Cargnello M,Roux PP.Activation and function of the MAPKs and their substrates,the MAPK-activated protein kinases[J].Microbiol Mol Biol Rev,2011,75(1):50-83.
